
- •Алгебраическая форма стехиометрических уравнений
- •Стехиометрически независимые уравнения
- •Сложная реакция
- •Если воздействовать на систему, находящуюся в химическом равновесии, то состояние системы изменяется таким образом, что это воздействие ослабляется.
- •5. Удаление компонента продукта. В процессе с реакцией
- •Равновесие в технологических расчетах
- •2. Скорость превращения и скорость реакции
- •3. Кинетическое уравнение.
- •Химические процессы
- •Хп в непористом зерне
5. Удаление компонента продукта. В процессе с реакцией
A + B = R + S
удаляется продукт S, так что в смеси поддерживается его концентрация СS. Условие равновесия (3.51) примет вид:
 (3.52)
(3.52)
Из (3.52) следует: удаление S, т.е. уменьшение СS, будет компенсироваться увеличением хР – степенью превращения исходного вещества. Такой прием увеличения равновесной степени превращения используется, например, в реакционно-ректификационном процессе – в нем, например, отгоняется летучий побочный продукт, что обеспечивает более глубокое протекание реакции.
Равновесная степень превращения метана в его реакции с водяным паром при начальном соотношении пар : метан = 2:1 равна 0,54 (Р = 4 МПа, Т = 1100 К).
Избыток водяного пара до соотношения пар : метан = 4:1, которое используется в промышленности, позволяет увеличить максимальное (равновесное) превращения метана до 0,74.
Равновесие в технологических расчетах
Термодинамический анализ реакционной смеси устанавливает влияние условий (начальный состав, температура, давление) на равновесное соотношение реагентов, т.е. состав смеси при полном завершении химического превращения, максимально возможные превращения. Из получаемых данных делают выводы о целесообразности процесса, возможной полноте превращения, условиях достижения желаемого выхода продуктов и т.д.
Выбор условий проведения процесса в промышленности покажем на примерах двух обратимых процессов, протекающих с использованием катализаторов.
1. Синтез аммиака N2 + 3H2 = NH3
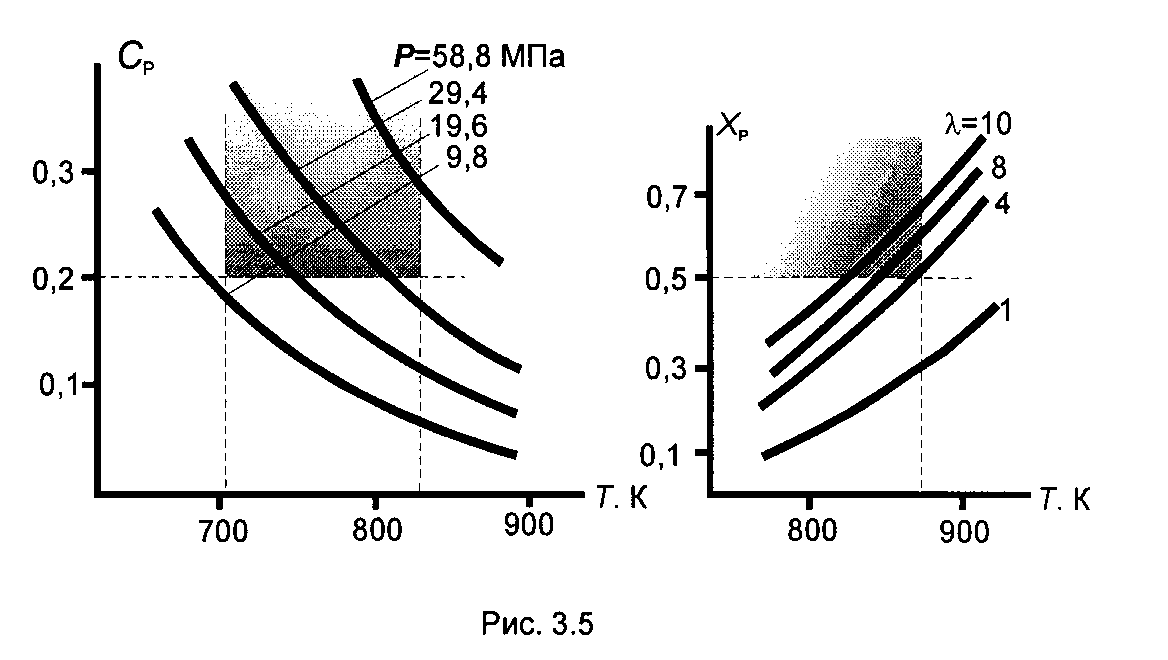
Реакция экзотермическая, протекает с уменьшением объема. Процесс целесообразно проводить при повышенном давлении. Температура процесса ограничена снизу – активностью катализатора, сверху – его термостойкостью. Поэтому режим процесса должен быть ограничен температурным интервалом 700 – 830 К. Промышленный интерес представляет процесс с образованием аммиака более 20 %. На рис. 3.5,а представлены зависимости равновесной концентрации аммиака от температуры при разных давлениях и выделена область необходимых температур (700 – 850 К) и концентраций аммиака (более 20 %). Следует, что давление синтеза должно быть более 25 Мпа. В промышленности процесс ведут при 30 Мпа.
1. Дегидрирование бутана C4H10 = C4H10 + H2.
Реакция эндотермическая, протекает с увеличением объема. Процесс целесообразно проводить при пониженном давлении или разбавлении исходной смеси инертом. Понижение давления ниже атмосферного создает риск аварийной ситуации –при нарушении уплотнений в оборудовании проникший внутрь воздух создает взрывоопасную смесь с углеводородами. Поэтому используют разбавление водяным паром. Эндотермическую реакцию надо проводить при максимально возможной температуре. В данном процессе она ограничена температурой 873 К – ее превышение приводит к термической деструкции углеводородов. Превращение бутана в промышленном процессе - не менее 50 %. На рис. 3.5,б представлены зависимости равновесной степени превращения бутана от температуры при разных его разбавлениях давлениях (соотношении пар : газ l) и выделена область необходимых температур и степеней превращения. Следует, что процесс надо проводить при разбавлении бутана водяным паром в соотношении не менее, чем 8 : 1.
Анализ равновесных условий может определить направление разработок процесса. Изомеризация пентана представлена схемой превращений
(1) CH3
CH3-CH2-CH2-CH2-CH3 CH3-CH-CH2-CH3
CH3
CH3-CH-CH3
CH3
В этой схеме два из трех изомерных превращений - стехиометрически независимые. Константы равновесия реакций (1) и (2):
Кр1 = 0,528ехр(-958/Т); Кр2 = 0,00412ехр(-2454/Т)
В равновесии Кр1 = Сизо/Сн, Кр2 = Снео/Сн, где Сн, Сизо, Снео - равновесные концентрации соответствующих изомеров, причем исходная смесь содержит только н-пентан и потому Сн = 1 - Сизо - Снео. Его степени превращения в изо- и нео- пентаны – xизо и xнео соответственно. Из условий равновесия получим:
![]()
Содержание всех изомеров представлено на рис. 3.6.

Наибольший интерес представляет изо-пентан. Максимальный его выход будет в области 600 К, но при этом остается более 30 % н-пентана и значительное количество, около 6%, нео-пентана, что нежелательно. Более благоприятными будут условия, при которых протекает изомеризация н-пентана только в изо-пентан. В этом случае при низких температурах возможно превратить более 90 % пентана в изо-пентан – пунктирные линии на рис. 3.6. Практически это осуществляется подбором активного катализатора, ведущего изомеризацию селективно, исключительно до изо-пентана, что было успешно достигнуто.
Кинетические закономерности
1. Схема превращения.
Кинетика химических реакций описывает, как и с какой скоростью превращаются вещества.
Для предсказания количества оставшихся и образовавшихся компонентов надо иметь стехиометрические уравнения, количество которых определено из условия их независимости. Стехиометрия окисления аммиака представлена двумя уравнениями:
4NH3 + 5O2 = 4NO + 6H2O
(1)
4NH3 + 3O2 = 2N2 + 6H2O
Если бы имело место только параллельное окисление NH3 до NO и N2, то процесс описывался бы пунктирными линиями на рис. 1: когда весь аммиак окислится, содержание NO и N2 не будет меняться. Реальное изменение концентраций NO и N2 представлено сплошными линиями на рис. 1. Содержание NO сначала растет, а затем уменьшается. Значит, наряду с образованием NO в соответствие с первым уравнением в (1) происходит его дальнейшее превращение. Установлено, что кроме реакций (1) имеют место следующие превращения:
2
 NO
= N2 + O2
; 6NO + 4NH3
= 5N2 + 6H2O
(2)
NO
= N2 + O2
; 6NO + 4NH3
= 5N2 + 6H2O
(2)
Схема превращения показывает реальные взаимодействия между компонентами - пути превращения - в реагирующей системе. Может быть представлена химическими уравнениями протекающих реакций подобно (1)-(2) или графически:

Схема превращения состоит из частных реакций, или этапов. Кинетические уравнения не могут быть записаны произвольно, и их число должно соответствовать реальным путям превращения компонентов.
Схема превращения необходима, чтобы предсказывать изменение содержания веществ в реагирующей системе по мере протекания в ней химических превращений
