
- •Алгебраическая форма стехиометрических уравнений
- •Стехиометрически независимые уравнения
- •Сложная реакция
- •Если воздействовать на систему, находящуюся в химическом равновесии, то состояние системы изменяется таким образом, что это воздействие ослабляется.
- •5. Удаление компонента продукта. В процессе с реакцией
- •Равновесие в технологических расчетах
- •2. Скорость превращения и скорость реакции
- •3. Кинетическое уравнение.
- •Химические процессы
- •Хп в непористом зерне
Химическая технология – переработка в процессе которой превалируют физические и химические являются, которые приводят к коренному изменению состава, свойств, строения веществ.
ХТ – наука естественно-прикладная о сп. и процессах производства продуктов (предметах потребления и средств производства) осуществляется с участием хим. превращений технологически, экономически и социально целесообразным путем.
Предметом ХТ является химическое производство. Цель: создание целесообразным методом продукта.
Методы: экспериментальный, математическое моделирование, системный анализ.
Химическое производство – это совокупность процессов переработки сырья в нужные продукты с использованием химических превращений, осуществляемых в предназначенных для этого машинах и аппаратах.
Химическое производство – объект исследования науки химическая технология, совокупность процессов и операций осуществляемых в машинах и аппаратах и предназначенный для переработки сырья путем химических превращений для получения продуктов.
Требования:
Получение в производстве необходимого продукта
Экологическая безопасность
Безопасность, надежность эксплуатации
Максимальное использование сырья и энергии
Максимальная производительность труда
Состав:
Сырье – подготовка сырья – переработка сырья – выделение продукта – очистка – энергетическая система – водоподготовка – система управления.
Методы ХТ:
1. математическое моделирование – метод исследования объекта на модели (явление, процессы): полученные свойства модели переносятся на свойства моделируемого объекта.
Модель – специально созданный объект любой природы, более простой по сравнению с исследуемым объектом, который надо изучить.
Модель:
физическая (изучение гидродинамических свойств)
математическая (описывание процессов системой математических уравнений), делится на реальную и знаковую.
Теория химических процессов
Физико-химические закономерности
Стехиометрические уравнения показывают, в каких соотношениях вещества вступают в химическое взаимодействие.
Общий вид стехиометрического уравнения:
nAA + nBB + .... = nRR + nSS +...
где А, В,... - исходные вещества; R, S,... - продукты; nA, nB,nR ,, nS ... - стехиометрические коэффициенты.
Стехиометрическое уравнение устанавливает соотношение между количествами превратившихся веществ:
(NA0 – NA)/ nA = (NB0 – NB)/ nB = (NR – NR0)/ nR = (NS – NS0)/ nS,
где NA0, NB0, NR0, NS0 - начальные количества компонентов A, B, R, S; NA, NB, NR0, NS - количества тех же компонентов после превращения.
Алгебраическая форма стехиометрических уравнений
Используя алгебраическую форму стехиометрического уравнения, получим такой вид записи соотношения между количествами превратившихся веществ:
(N1 - N10)/ 1 = (N2 - N20)/ 2 = ..... = (N i – N i0)/ i = const,
где N10, N20,..., N i0 - начальные количества компонентов;
N1, N 2… N i - количества компонентов после превращения;
1, 2 ... i - соответствующие стехиометрические коэффициенты.
Исходные вещества убывают и для них (Ni - Ni0) < 0, продукты образуются и для них (Ni - Ni0) > 0.
Соответствующий знак имеют стехиометрические коэффициенты i:
для исходных веществ (i < 0), для продуктов (i > 0).
Стехиометрически независимые уравнения
На основании стехиометрической количественной связи между реагентами можно рассчитать состав реакционной смеси в химическом превращении. Таким образом, стехиометрические уравнения служат для составления материальных балансов в химически реагирующей системе и на этой основе- тепловых балансов и расчетов основных технологических показателей, таких как расходный коэффициент, степень превращения, выход продукта, селективность.
Для расчета материальных и тепловых балансов необходимо использовать только стехиометрически независимые уравнения, т.е. Такую систему уравнений, в которой ни одно из них не может быть получено линейной комбинацией других.
Базисная система стехиометрических уравнений
Базисная система стехиометрических уравнений, однозначно и полно описывающая процесс, должна содержать число стехиометрически независимых уравнений, определяемых уравнениями:
Для реакции обмена:
У = В – (Э – 1),где У – число уравнений в базисной системе, В-число веществ, Э-число элементов, из которых состоят вещества
Для ОВР:
У = В – Э (соблюдается не только поэлементный баланс, но и баланс по электронам)
Степень превращения - отношение количества превращенного исходного вещества N0 – N к его начальному количеству N0.
Степень превращения может быть определена для любого исходного реагента, например, xА = (NА0 – NА)/NА0, xВ = (NВ0 - NВ)/NВ0.
Связь между степенями превращения двух исходных веществ:

Степень превращения
Количество любого вещества Ni в реагирующей смеси можно определить по формуле:

В сложной реакции полнота превращения определяется для каждого стехиометрического уравнения. Определив xAj - его степень превращения в каждом j-ом уравнении, можно рассчитать количество Ni любого компонента:

Стехиометрия в технологических расчетах
Концентрации компонентов в реакционной смеси.
И стехиометрические уравнения, и степень превращения определяют изменение количества вещества. На практике состав смеси выражают через концентрации компонентов:
![]()
![]()
Общее количество реагирующей смеси

Стехиометрия в технологических расчетах
Величина - изменение числа молей в реакции, по ней судим об изменении объема.
Начальные концентрации
![]() ,
то
,
то
![]()
Выход продукта- это отношение количества исходного вещества например А, к количеству А, превратившегося в продукт.
Для продукта R: ЕR= А(NR – NR0)/ NА0*А
Для простой реакции: ЕR=ХА
Для сложной реакции вводится понятие селективности – показывает, какая доля превратившегося исходного вещества пошла на образование заданного.
![]()
ER и SR имеют значение для сложных реакций,
для простых SR =1., ER= XA
Интегральная селективность по продукту – это отношение количества исходного вещества, превращенного в данный продукт, ко всему количеству превращенного реагента.
Интегральная селективность по продукту R (при NR0 = 0)
SR = А1 *NR /R(NА0 - NА)
Для двух последовательных реакций:
АA
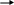 RR
SS
RR
SS
Интегральная селективность по продукту R (при NR0 = 0)
SR = А *NR /R(NА0 - NА)
Термодинамические закономерности.
Химическое равновесие определяется условием DGP,T = 0.
Уравнение Вант-Гоффа (![]() )
определяет зависимость энергии Гиббса
DGP,T
от состава реакционной смеси.
)
определяет зависимость энергии Гиббса
DGP,T
от состава реакционной смеси.
Назовем равновесными состав смеси и концентрации компонентов при химическом равновесии, и тогда:

Выражение в квадратных скобках определяет константу равновесия химического превращения КР, представленного стехиометрическим уравнением:
(1)![]() и
и
![]()
т.е. константа равновесия Kp - термодинамическая функция, зависящая только от температуры:
 (0)
(0)
Отметим, что концентрации в уравнении (1) определены относительно стандартного состояния, т.е. они безразмерные. Соответственно, Kp – также безразмерная величина. На практике используют концентрации веществ разной размерности, соответственно, равновесный состав смеси, определяют из уравнений:
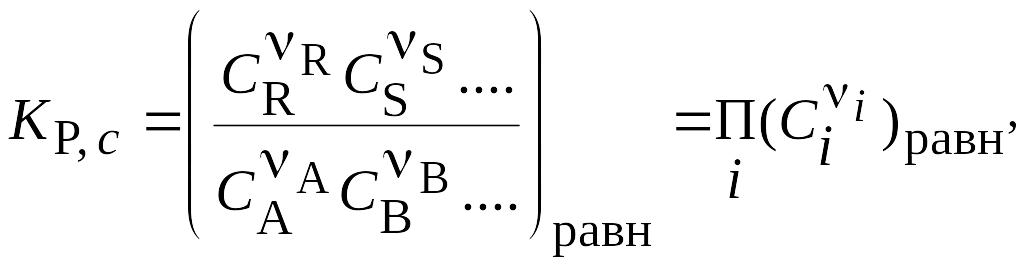 (2) или
(2) или
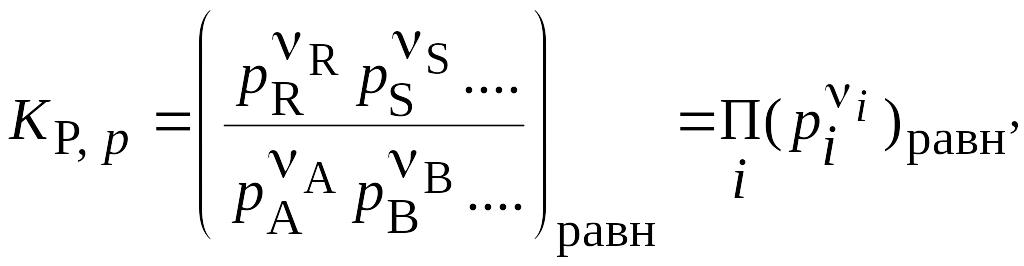 (3)
(3)
где Ci и pi – соответственно равновесные концентрации и парциальные давления компонентов; nA, nB, nR, nS, - стехиометрические коэффициенты. ni - стехиометрические коэффициенты в уравнении реакции в алгебраической форме.
Для неидеальной смеси в (2) используют активности вместо концентраций, а в (3) - летучести вместо парциальных давлений.
Если реакционная смесь идеальна (небольшие температуры и давления, разбавленные растворы), то, используя справочные значения или и DST, можно рассчитать KP из (0).
Многие реальные смеси являются не идеальными, и для них используют формулы расчета KP в таком виде:
![]()
KP будет увеличиваться с ростом температуры для эндотермических реакций (QP < 0) и уменьшаться для экзотермических (QP > 0)

Если какой-то компонент в реагирующей системе находится в твердом состоянии, то его концентрация тем самым фиксирована. Эту постоянную величину обычно включают в константу равновесия. В таком случае в выражение, например, (3) войдут равновесные парциальные давления только газообразных компонентов.
Для упомянутой выше реакции сажеобразования
СО + Н2 = Ств + Н2О
углерод (сажа) Ств образуется в твердом состоянии, и

Равновесный состав реагирующей смеси
Концентрации всех компонентов в реагирующей смеси связаны между собой стехиометрическим уравнением, их можно определить через начальный состав и степень превращения ключевого компонента x.
В равновесии достигается равновесная степень превращения xр, так что выражение (2) или (3) примет вид
КР = f(xР) (4
Определив из него xр, далее находят равновесные концентрации всех компонентов. Приведем примеры.
Простая реакция.
Простая обратимая реакция: А = R.
Начальная концентрация компонента А - СA0, компонент R - отсутствует.
В равновесном состоянии СА,равн= cA0(1-xР)
и СR,равн= СA0xР.
Из (2) получим
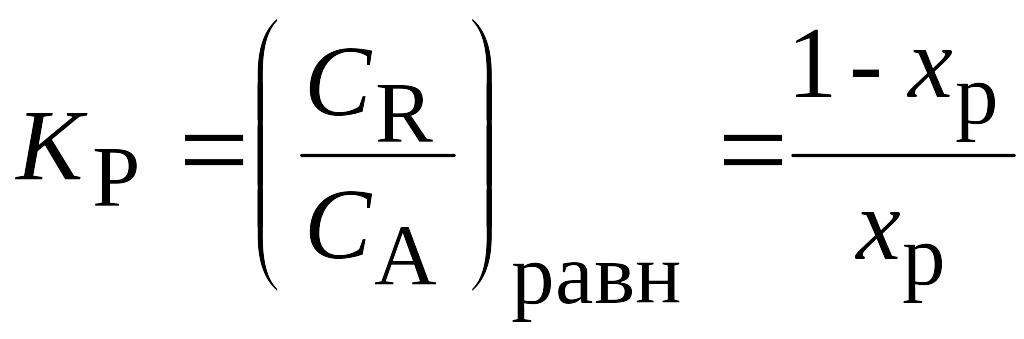 ,
,
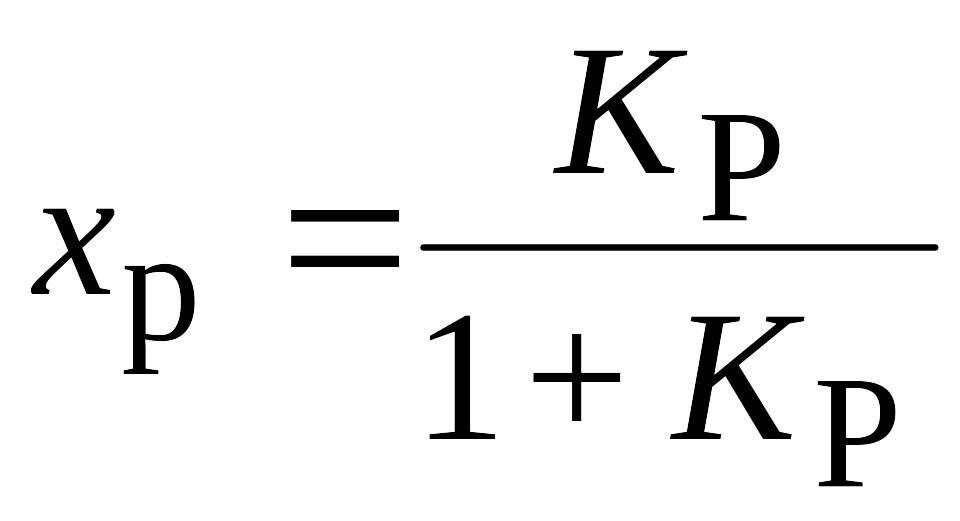 (5)
(5)
Учитывая зависимость КР(Т) для экзо- и эндотермических реакций, можно построить зависимость xР(Т) для этих реакций - рис. 3.3.

2. Конверсия СО с водяным паром: СО + Н2О = СО2 + Н2. Для нее

где парциальные давления компонентов pi = РСi;
Р - общее давление.
Концентрации СО, Н2О, СО2, Н2 в начальной смеси С10, С20, С30, С40, а в равновесии - С1р, С2р, С3р, С4р соответственно.
Выразим Сip через равновесную степень превращения xP:
С1р = С10(1 - xР); С2р = С20 - С10ХР; С3р = С30 + С10XР; С4р = С40 + С10XР;
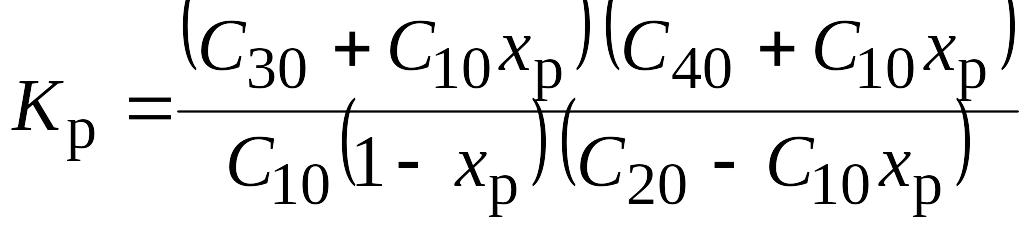
тогда из (3.39) получим квадратное уравнение относительно xP:
Его решение
![]()
где а = КР/[2С10(КР - 1)], b = (С20/С10) [КР - С30С40/(С10С20)]. (0 < XР < 1)
3. Не всегда можно получить аналитическое выражение для xр.
Реакция SO2 + 0,5O2 = SO3 протекает с изменением объема.
Начальные концентрации SO2 и O2 - С10 и С20 соответственно.
Парциальные давления компонентов получим из определения pi = РСi
Р - общее давление.
Концентрации компонентов выразим через степень превращения SO2 - x:

(индекс "3" относится к SO3).
В условиях равновесия

Уравнение решают методом подбора xр, после чего находят концентрации всех компонентов.
