
- •Алгебраическая форма стехиометрических уравнений
- •Стехиометрически независимые уравнения
- •Сложная реакция
- •Если воздействовать на систему, находящуюся в химическом равновесии, то состояние системы изменяется таким образом, что это воздействие ослабляется.
- •5. Удаление компонента продукта. В процессе с реакцией
- •Равновесие в технологических расчетах
- •2. Скорость превращения и скорость реакции
- •3. Кинетическое уравнение.
- •Химические процессы
- •Хп в непористом зерне
Сложная реакция
Для расчета равновесного состава смеси, в которой протекает сложная реакция, описываемая несколькими уравнениями, надо использовать только стехиометрически независимые уравнения как при расчете состава реагирующей смеси .Возможная последовательность расчета такая.
Определяется базисная система стехиометрически независимых уравнений, позволяющая выразить концентрации всех компонентов смеси через степени превращения ключевого вещества в каждом уравнении выбранной системы.
Обозначим их C(x). Число определенных степеней превращения и количество уравнений в базисной системе совпадают.
Например, для конверсии метана определена базисная система уравнений
CН4 + Н2О = СО + 3Н2;
СН4 + 2Н2О = СO2 + 4Н2.
и получены выражения для концентраций всех веществ, т.е. C(x).
2. Сложное превращение может быть представлено протекающими реакциями, не обязательно совпадающими с уравнениями для расчета состава реагирующей смеси, но их число такое же, как в базисной системе уравнений. Для этих уравнений известны константы равновесия, и можно определить уравнения равновесия. Обозначим их KPj(C).
В примере конверсии метана такими реакциями являются реакции
CН4 + Н2О = СО + 3Н2;
СО + Н2О = СО2 + Н2,
и химическое равновесие - KP(C) - определяется уравнениями:

где КР1, КР2 – константы равновесия; р1, р2, р3, р4, р5 – равновесные парциальные давления соответственно CН4, Н2О, Н2, СО, СО2; Сi – соответствующие концентрации (мольные доли).
3. Полученные зависимости C(x) подставляем в выражения KPj(C) и получаем зависимости KPj(х), в которых x становятся равновесными степенями превращения XР, т.е. получаем зависимости KP(XР). Для заданных условий (температура, давление) определяем константы равновесия реакций, и из уравнений KP(XР) определяем все значения XP. Теперь из имеющихся зависимостей C(x) можно рассчитать равновесный состав реакционной смеси – концентрации всех компонентов.
Изменение химического равновесия достигается изменением внешних условий. Направленность влияния определяется правилом, называемом принципом Ле-Шателье:
Если воздействовать на систему, находящуюся в химическом равновесии, то состояние системы изменяется таким образом, что это воздействие ослабляется.
СПОСОБЫ УПРАВЛЕНИЯ ХИМИЧЕСКИМ ПРОЦЕССОМ
Рассмотрим возможности воздействия на равновесие:
Температура;
Давление;
Разбавление реакционной смеси;
Избыток одного из компонентов;
Удаление продукта из реакционной смеси.
1. Температура. Повышение температуры связано с подводом дополнительного тепла. Химически реагирующая система будет противодействовать этому – поглощать тепло. В эндотермической реакции превращение и, следовательно, поглощение тепла увеличиться, т.е. равновесная степень превращения увеличится. В экзотермической реакции произойдет уменьшение выделения тепла вследствие уменьшения превращения, т.е. равновесная степень превращения уменьшится. Такое изменение xр(Т) показано на рис. 3.3. Из этого и следует способ увеличения xр: увеличение температуры для эндотермической реакции и уменьшение - для экзотермической.
2. Давление. В соответствие с принципом Ле-Шателье увеличению давления P должно противодействовать смещение равновесия, приводящее к уменьшению P, т.е. к уменьшению объема реакционной смеси. Если реакция протекает с уменьшением объема, то увеличение P приведет к большему превращению (увеличению xр). И наоборот - в системе, где реакция протекает с увеличением объема, равновесие сдвинется в сторону уменьшения xр.
Такой же вывод получим из анализа уравнения равновесия. Используя связь pi = PСi и уравнение для газо-фазных реакций, преобразуем последнее к виду

где nD = (nR + nS + ...) - (nA + nB + ...) - изменение числа молей в реакции.
Если реакция протекает с увеличением объема (nD > 0), то увеличение Р (и также РnD) приведет к уменьшению концентраций продуктов R и S, т.е. к уменьшению степени превращения.
Если nD < 0, то увеличение Р (уменьшение РnD) компенсируется ростом концентраций продуктов и степени превращения
Синтез аммиака (N2 + 3H2 = 2NH3) протекает с уменьшением объема. Исходная смесь - стехиометрическая с отношением Н2 : N2 = 3:1, которое сохраняется в течение реакции. Обозначим Ср - равновесная концентрация NH3. Тогда равновесные концентрации N2 и Н2 соответственно равны 0,75(1 - Ср) и 0,25(1 - Ср). Уравнение равновесия:

При давлении Р = 0,1 МПа образуется менее 1% аммиака. С увеличением давления Р равновесная концентрация аммиака Ср также увеличивается - рис. 3.4.

Для реакций в жидких и конденсированных средах (жидких и твердых) давление практически не сказывается на равновесном составе.
3. Разбавление реакционной смеси
- добавление инертного вещества -
равнозначно уменьшению давления. Покажем
на примере реакции дегидрирования
бутана до бутилена С4Н10 = С4Н8 + Н2,
протекающей с увеличением объема
реакционной смеси. Начальное содержание
бутана С10. Равновесная степень
превращения бутана - xр, и:
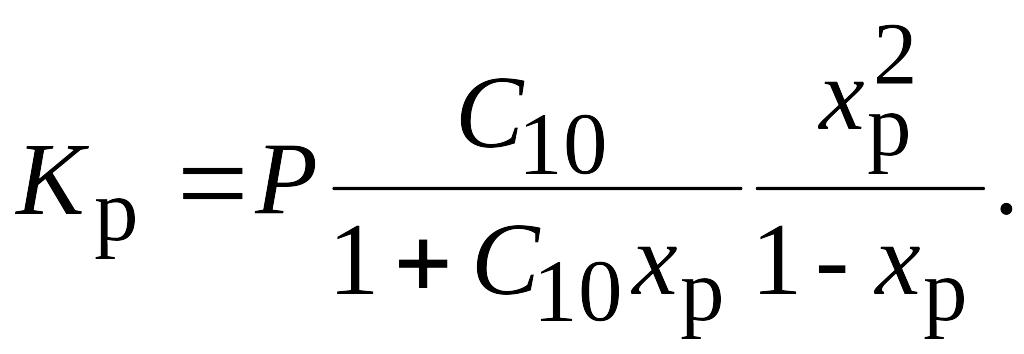
В этом уравнении использовано определение концентрации в реагирующей смеси, если реакция протекает с изменением объема.
Из полученного уравнения следует, что разбавление, т.е. уменьшение С10, будет компенсироваться увеличением xр - равновесной степени превращения бутана. Поэтому в промышленности дегидрирование бутана (как и другие процессы дегидрирования) проводят при разбавлении водяным паром.
4. Избыток одного компонента сырья.
Пусть протекает реакция
A + B = R + S.
Равновесные концентрации компонентов выразим через степень превращения А – хР:
СA = CA0(1 - хР); СB = СB0 - CA0хР = CA0(l - хР); СR = СS = CA0хР.
Здесь l = СB0/CA0 – соотношение компонентов А и В в исходной смеси. Из уравнения равновесия получим:

Пусть содержание исходного реагента В увеличено, т.е. увеличено l. Чтобы при этом выполнялось равенство, должна увеличиться хР - степень превращения компонента А. На практике избытком одного компонента (в данном примере В) увеличивают превращение более ценного компонента сырья (в данном случае А).
