
Возникает при действии на бетон природных вод, содержащих сульфаты. Разрушение проявляется в виде разбухания и искривления конструктивных элементов. В этом случае не происходит удаления составляющих из объема цементного камня, а, наоборот, в результате химических реакций между цементным камнем и веществами, поступающими из внешней среды, образуются новые соединения, объем которых больше объема цементного камня. Характерным примером такой коррозии является образование "цементной бациллы" (гидросульфоалюминат кальция).
Билет№15
Моль любого вещества (см. пример 1) содержит постоянную Авогадро NA структурных единиц (в нашем примере молекул). Молярная масса H2SO4равна 98,0 г/моль. Следовательно, масса одной молекулы
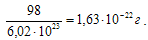
2)Электронные формулы изображают распределение электронов в атоме по энергетическим уровням и подуровням (атомным орбиталям).
Электронная конфигурация обозначается группами символов nl*, где n - главное квантовое число, l - орбитальное квантовое число (вместо него указывают соответсвующее буквенное обозначение - s, p, d. f), х - число электронов в данном подуровне (орбитали).
При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он будет обладать наименьшей энергией - меньшая сумма n+l .
Заполнение энергетических уровней и подуровней идет в такой последовательности: 1s2s2p3s3p4s3d4p5s4d5p6s(5d1)4f5d6p7s(6d1-2)5f6d7p
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И.Менделеева, то для элементов №16 (сера) и №22 (титан) электронные формулы имеют вид:
16S 1s22s22p63s23p4 22Ti 1s22s22p63s23p63d24s2
3) Обозначим концентрации реагирующих веществ: [SO2]= a, [О2] = b, [SO3] = с. Согласно закону действия масс скорости v прямой и обратной реакции до изменения объема:
vпр = Ка2b; vобр = К1с2.
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3а, [О2] = 3b; [SO3] = 3с. При новых концентрациях скорости v’ прямой и обратной реакции:
v’пр = К(3а)2(3b) = 27Ка2b; v’обр = К1(3с)2 = 9К1с2.
Отсюда:
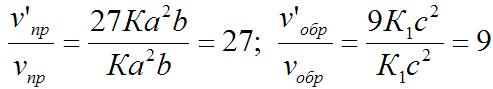
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в девять раз. Равновесие системы сместилось в сторону образования SO3.
4) Щелочи взаимодействуют в водных растворах с металлами, которым соответствуют амфотерные оксиды и гидроксиды:
2NaOH
+ Zn + 2H2O
= Na2[Zn(OH)4]
+ H2![]() .
.
В настоящее время изготовляется путем обработки в автоклаве кремнезёмсодержащего сырья концентрированными растворами гидроксида натрия или сплавлением кварцевого песка с содой. Известны также способы получения жидкого стекла, основанные на прямом растворении кремнистого сырья (Опоки, трепелы, диатомиты и др.) в растворах щелочей при атмосферном давлении и относительно невысокой температуре (температура кипения раствора щелочи).
Областей применения жидкого стекла очень много. Его, в частности, применяют для изготовления кислотоупорного цемента и бетона, для пропитывания тканей, приготовления огнезащитных красок и покрытий по дереву (антипирены), укрепления слабых грунтов, в качестве клея для склеивания целлюлозных материалов, в производстве электродов, при очистке растительного и машинного масла и др.
