
БИЛЕТ №8=9
H2so4, h3po4.(для образования кислых солей в килоте должно быть минимум 2 атома водорода)
Н2 и CL2 - ковалентная неполярная НCL - ковалентная полярная. NaCl – ионная
K = [CO]2 / [CO2] - выражение для константы равновесия. Пусть было x моль/л CO2, тогда после уменьшения концентрации в 4 раза будет x/4 моль/л. Скорость прямой реакции (до): v = k*[CO2] = k*[x] Скорость прямой реакции (после): v' = k*[CO2]' = k*[x/4] n = v'/v = (k*[x/4]) / (k*[x]) = 1/4 - скорость уменьшится в 4 раза. При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом ( В НАШЕМ СЛУЧАЕ ВПРАВО)
Это специально сконструированной электрод, в котором происходит окислительновосстановительная реакция: 2Н+ + 2е ↔ Н2. При этом концентрация ионов водорода является одномолярной, давление водорода равняется 1 атм. и поддерживается температура 25°С.
Портландцемент получают тонким измельчением клинкера и гипса. Клинкер — продукт равномерного обжига до спекания однородной сырьевой смеси, состоящей из известняка и глины определённого состава, обеспечивающего преобладание силикатов кальция (3СаО∙SiO2 и 2СаО∙SiO2 70-80 %).
БИЛЕТ №10
1) m(CuSO4) = M(CuSO4) * m(CuSO4*5H2O) / M(CuSO4*5H2O) = 160 * 25 / 250 = 16 г m(раствора) = 100 * m(CuSO4) / ω = 100 * 16 / 8 = 200 г m(H2O) = m(раствора) - m(CuSO4*5H2O) = 200 - 25 = 175 г
2) Прочность связи уменьшается, сила кислот увеличивается. Объяснить это можно ростом радиуса r атомов элементов и усилением полярности ковалентной связи Э-Н по периоду вместе с ростом Z атома элемента.
3)а) HCl + NaOH = NaCl + H2O
H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O
H+ + OH- = H2O
Б) молекулярное Na2S + Pb(NO3)2=>2Na(NO3) + PbS полное ионное 2Na(+) + S(2-) + Pb(2+) + 2NO3(-) =>2Nа(+) +2NO3(-) + PbS краткое ионное S(2-) + Pb(2+) => PbS
В) K2CO3 + H2SO4 = CO2 + H2O + K2SO4
2K(+) + CO3(2-) + 2H(+) + SO4(2-) = CO2 + H2O + 2K(+) + SO4(2-)
CO3(2-) + 2H(+) = CO2 + H2O
Г) CH3COOH + NaOH = CH3COONa + H2O
CH3COO¯ + H(+)+ Na(+)+ OH¯ = CH3COO¯ + Na(+) + H2O
H(+)+ ОН¯ = Н2О
4) а) масса цинковой пластинки уменьшится, поскольку цинк, как более активный металл, будет вытеснять медь из раствора медного купороса, т. е. окислятся:
Zn + CuSO4 → ZnSO4 + Cu
Zn – 2e → Zn2+
Cu2+ + 2e → Cu
б) масса цинковой пластинки также уменьшится:
Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
Zn – 2e → Zn2+
Pb2+ + 2e → Pb
С MgSO4 реакции не будет, а значит масса пластинки не изменится.
5)-----------
Билет №11
Cн(кислоты)*V(кислоты) = Cн(щелочи)*V(щелочи) Cн(кислоты) = 0,1*30/12 = 0,25 моль-экв/л
-------
с раствором серной кислоты будут взаимодействовать KHCO3 и Na2S. 1. 2KHCO3+H2SO4=K2SO4+2H2O+2CO2 2K+ + 2HCO3- + 2H+ +SO42- =2K+ + SO42- +2H2O+2CO2 2HCO3- +2H+ =2H2O + 2CO2 2. Na2S+ H2SO4= Na2SO4+H2S (газ) 2Na+ +S2- +2H+ +SO42-=2Na+ + SO42- +H2S S2- + 2H+ = H2S
-----
--------
Билет №12
1) В настоящее время эквивалентом элемента называют такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Например, в соединениях НС1, H2S, NH3 эквивалент хлора, серы, азота равен соответственно 1 моль, 1/2 моль, 1/3 моль
Масса 1 эквивалента элемента называется его эквивалентной массой. Так, в приведенных выше примерах эквивалентные массы хлора, серы, азота соответственно равны 32/2=16 г/моль, 14/3 = 4,67 г/моль, 12/4 = = 3 г/моль.
2)s=2,p=6,d=10,f=14
3) 3) Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы.
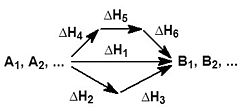
![]()
На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
![]()
Закон открыт русским химиком Г. И. Гессом в 1840 г.; он является частным случаем первого начала термодинамики применительно к химическим реакциям. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него.
