
- •1. Параметры и закономерности прямолинейного движения мт.
- •2. Криволинейное движение материальной точки.
- •3. Основные законы поступательного движения
- •4. Принципы суперпозиций и относительность движение мт.
- •1. Принцип относительности Галилея
- •5. Работа и энергия и их эквивалентность.
- •9. Колебательные движения материальной точки.
- •12. Законы сохранения в механике мт.
- •13. Условия равновесного состояния тел.
- •14. Параметры и основной закон вращательного движения.
- •15. Методика определения момента инерции тела (на примере точки). Теорема Штейнера.
- •16. Закон сохранения для вращательного движения.
- •17. Колебательное движение твердого тела, определение частоты колебаний.
- •18. Степени свободы механического движения системы тел. Закон равнораспределения энергии для газа.
- •21. Теплопроводность газа.
- •22. Внутреннее трение в газе
- •23. Диффузия в газе.
- •19. Максвелловское распределения молекул газа по скоростям.
- •24. Закон сохранения энергии для изотермического и адиабатического.
- •27. Термодинамические циклы, кпд тепловых машин.
- •25. Работа газа и его теплоемкость при изо- и адиабатных процессах.
- •26. Уравнение Пуасона, уравнение политропического процесса.
- •29. Молекулярно-кинетический смысл энтропии.
- •20. Больцмановское распределение молекул газа.
- •31. Уравнение состояния газа и его применение.
- •10. Явление резонанса при колебании мт.
22. Внутреннее трение в газе
Явление внутреннего трения (вязкости) связано с возникновением сил трения между слоями газа или жидкости, перемещающимися параллельно друг другу с различными по величине скоростями. Со стороны слоя, движущегося быстрее, на более медленно движущийся слой действует ускоряющая сила. Наоборот, медленно перемещающийся слой тормозит более быстро движущиеся слои газа. Силы трения, которые при этом возникают, направлены по касательной к поверхности соприкосновения слоев. С точки зрения кинетической теории газов, причиной внутреннего трения является наложение упорядоченного движения слоев газа с различными скоростями v и хаотического теплового движения молекул, интенсивность которого зависит от температуры.
Б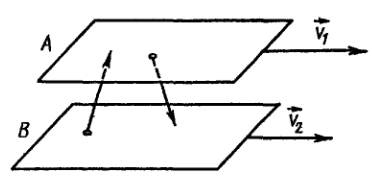 лагодаря
тепловому движению молекулы переходят
из слоя В
(рис.
1), движущегося со скоростью v2,
в слой А
движущийся
со скоростью v1.
При этом молекулы из слоя В
«переносят»
в слой А
импульсы
mv2
своего упорядоченного движения. Если
v1>v2,
то такие молекулы при столкновениях с
частицами слоя А
ускоряют
свое упорядоченное движение, а молекулы
слоя А
—
замедляют.
Наоборот, при переходе молекул из быстрее
движущегося слоя А
в
слой В
они
перекосят большие импульсы mv1,
и
соударения между молекулами приводят
к ускорению упорядоченного движения
молекул слоя В.
лагодаря
тепловому движению молекулы переходят
из слоя В
(рис.
1), движущегося со скоростью v2,
в слой А
движущийся
со скоростью v1.
При этом молекулы из слоя В
«переносят»
в слой А
импульсы
mv2
своего упорядоченного движения. Если
v1>v2,
то такие молекулы при столкновениях с
частицами слоя А
ускоряют
свое упорядоченное движение, а молекулы
слоя А
—
замедляют.
Наоборот, при переходе молекул из быстрее
движущегося слоя А
в
слой В
они
перекосят большие импульсы mv1,
и
соударения между молекулами приводят
к ускорению упорядоченного движения
молекул слоя В.
η=рD, где D=1/3<V><λ> - коэффициент диффузии.
λ/ηСР=1.
Формулы для коэф. λ, D и η связывают коэф. переноса и характеристики теплового движения молекул.
23. Диффузия в газе.
Диффузия – процесс, заключающийся в самопроизвольном (за счет теплового движения) взаимном проникновении и перемешивании частиц двух соприкасающихся газов, жидкостей и даже твердых тел. Если один газ диффундирует в другой, то процесс называется взаимодиффузией. Самодиффузия – проникновение одной части частиц газа в другую часть того же газа, например при различной концентрации частиц в различных частях объема. Процесс самодиффузии аналогичен процессам переноса (теплопроводности, внутреннего трения) и отличается от них только величиной, которая переносится.
Р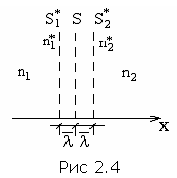 ассмотрим
диффузию на следующей модели. Пусть
объем с газом характеризуется тем, что
плотность газа (концентрация) в нем в
направлении «х»
изменяется. Получим суммарный поток
газа через сечение S
как разницу потоков от S1*
к S
и от S2*
к S.
Пусть n1*
>
n2*
.
ассмотрим
диффузию на следующей модели. Пусть
объем с газом характеризуется тем, что
плотность газа (концентрация) в нем в
направлении «х»
изменяется. Получим суммарный поток
газа через сечение S
как разницу потоков от S1*
к S
и от S2*
к S.
Пусть n1*
>
n2*
.
 .
.
Величину
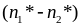 выразим через градиент концентрации
выразим через градиент концентрации

Тогда
выражение для
можно записать в виде
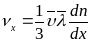 .
Сравнивая (16) с законом Фика для
самодиффузии
.
Сравнивая (16) с законом Фика для
самодиффузии
 ,
видим, что коэффициент самодиффузии
связан с микропараметрами газа выражением
,
видим, что коэффициент самодиффузии
связан с микропараметрами газа выражением
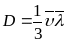 .
.
19. Максвелловское распределения молекул газа по скоростям.
1. При выводе основного уравнения кинетической теории газов мы считали, что молекулы имеют различные скорости. Опыт подтверждает это предположение. Средняя квадратичная скорость, использованная нами ранее, является одной из характеристик движения всей совокупности молекул. Она, разумеется, не имеет смысла применительно к одной какой-либо молекуле или к небольшому числу молекул.
2. Д. К Максвелл теоретически решил задачу о распределении молекул идеального газа по скоростям поступательного движения. Он установил закон, позволяющий определить, какое число молекул dn из общего количества n0 молекул идеального газа в единице объема обладает при данной температуре скоростями, лежащими в интервале от u до u+Δи. При этом Д. К. Максвелл предполагал, что газ химически однороден и находится в состоянии термодинамического равновесия.
Закон распределения молекул по скоростям имеет следующий вид:

где m — масса молекулы, k — постоянная Больцмана, Т — абсолютная температура. Из этой формулы можно определить так называемую наиболее вероятную скорость молекул иВ соответствующую максимуму выражения dn/du:

где
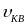 —
средняя квадратичная скорость. Таким
образом, наиболее вероятная скорость
молекул зависит только от температуры
газа и его молярной массы.
—
средняя квадратичная скорость. Таким
образом, наиболее вероятная скорость
молекул зависит только от температуры
газа и его молярной массы.
Закон максвелловского распределения молекул по скоростям может быть записан также в виде:
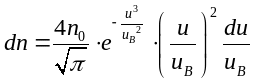
На рис. приведем кривая закона распределения молекул по скоростям

