
- •Функции белков
- •Кеталитический (активный) ценрт.
- •Конкурентное ингибирование.
- •Использование конкурентных ингибиторов как лекарственных препаратов.
- •8. Свойства ферментов.
- •3. Группа гормонов, образующихся из проопиомеланокортина
- •56. Гормоны задней доли гипофиза
- •61. Адреналин синтезируется в мозговом слое надпочечников из тирозина.
- •65. Сахарный диабет
- •79. Витамин в12 служит источником образования двух коферментов: метилкобаламина в цитоплазме и дезоксиаденозилкобаламина в митохондриях.
- •81. Витамины группы d (кальциферолы)
- •87. Роль печени в углеводном обмене
- •96. Биохимический анализ мочи
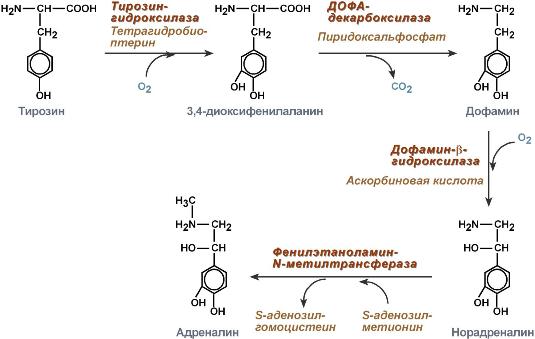
61. Адреналин синтезируется в мозговом слое надпочечников из тирозина.
Секреция гормона в кровь увеличивается при стрессе и интенсивной физической нагрузке. Мозговой слой надпочечников находится под контролем центральной нервной системы. В ткани-мишени адреналин передает сигнал посредством мембранных рецепторов. Существует несколько типов адренергических рецепторов а (а1А, а1В, а1D, а2А, а2В, а2С)и в (в1, в2, в3).
В печени есть два вида рецепторов адреналина:
в2-рецепторы
передают сигнал в клетку с помощью
аденилатциклазной системы, а а1В-рецепто-ры
— посредством инозитолфосфатной. В
обоих случаях это приводит к активации
протеинкиназ, фосфорилирующих
гликогенфосфорилазу и гликогенсинтазу,
в результате чего гликогенфосфорилаза
становится активной, а гликогенсинтаза
инактивируется. Таким образом адреналин
в печени ускоряет мобилизацию гликогена
и увеличивает поступление глюкозы
в кровь, поэтому при стрессе и интенсивной
физической работе в крови повышается
концентрация глюкозы. В мышцах адреналин
передает сигнал через в2-рецспторы. Это
вызывает активацию протеинкиназы А,
которая активирует гликогенфосфорилазу
и инактивирует гликогенсинтазу,
фосфорилируя их. В итоге в мышцах
тормозится синтез гликогена и ускоряется
его мобилизация, а образующийся в
результате этого процесса глю-козо-6-фосфат
используется как энергетический субстрат
в гликолизе. В жировой ткани адреналин
действует через в1-рецепторы и
аденилатциклазную систему. В результате
этого протеинкиназа А становится
активной и фосфорилирует гормончувствительную
ТАГ-липазу, что сопровождается ее
активацией. Фермент катализирует
реакцию гидролиза ТАГ с образованием
глицерола и жирных кислот, поступающих
из жировой ткани в кровь и периферические
органы. Следовательно, при стрессе и
интенсивной мышечной работе адреналин
в мышцах и печени ускоряет мобилизацию
гликогена и тормозит его синтез, а в
жировой ткани стимулирует липолиз.
62. Глюкагон - пептидный гормон, состоящий из 29 аминокислот. Предшественник гормона -препроглюкагон - синтезируется а-клетками поджелудочной железы и превращается в глюкагон в результате частичного протеолиза. Глюкагон - «гормон голода», сигналом для его секреции является снижение уровня глюкозы в крови. Ткани-мишени - печень и жировая ткань. Глюкагон передает сигнал в клетки с помощью аденилатциклазной системы, вызывая увеличение концентрации цАМФ, который активирует протеинкиназу A. TS глюкагона составляет 3—6 мин, он подвергается протеолизу в печени и почках. В жировой ткани глюкагон активирует ТАГ-липазу и, следовательно, ускоряет мобилизацию жира. Это приводит к увеличению концентрации жирных кислот и глицерола в крови.
В печени глюкагон в постабсорбтивный период тормозит синтез и ускоряет мобилизацию глюкогена, а при голодании более суток повышает скорость глюконеогенеза из глицерола, аминокис и лактата. Кроме того, глюкагон в печени ингибирует ацетил-КоА-карбоксилазу, снижая образование аллостерического ингибитора регуляторного фермента В-окисления карнитинацилтрансферазы - малонил-КоА. Избыточное поступление жирных кислот и активация регуляторного фермента стимулируют В-окисление жирных кислот и увеличение образования ацетил-КоА. При голодинии в митохондриях гепатоцитов скорость реакций ЦТК снижена, поэтому ацетил-КоА в основном используется для синтеза кетоновых тел. Таким образом, стимуляция глюкагоном липолиза в жировой ткани вызывает ускорение кетогенеза в печени. Глюкагон ускоряет мобилизацию гликогена и синтез глюкозы из аминокислот, лактата и глицерола в печени, а также гидролиз ТАГ в жировой ткани, обеспечивая тем самым энергетическими субстратами разные ткани.
63. Инсулин - гормон пептидной природы, который синтезируется в в-клетках островков Лангерганса поджелудочной железы в виде неактивного предшественника препроинсулина.Синтез и последующая посттрансляционная модификация инсулина включают несколько этапов. Сначала синтезируется N-концевой сигнальный пептид, обеспечивающий прохождение растущей полипептидной цепи в полость ЭР. Элонгация сигнального пептида заканчивается синтезом прспроинсулина. По мерс погружения полипептидной цепи в полость ЭР сигнальный пептид отщепляется и образуется проинсулин. Он поступает в аппарат Гольджи, где подвергается частичному протеолизу с образованием инсулина и С-пептида, которые включаются в состав секреторных гранул.
Инсулин состоит из 2 полипептидных цепей: А (21 аминокислота) и В (30 аминокислот) и содержит 3 дисульфидные связи, 2 из которых соединяют цепи А и В, а третья находится в цепи А. В печени и почках инсулин гидролизуется ферментом инсулиназой. Сигналом для секреции инсулина из поджелудочной железы в кровь служит повышение уровня глюкозы в крови в абсорбтивный период.
Инсулин влияет на скорость транспорта в клет ки глюкозы, жирных кислот, аминокислот, ионов, вызывает фосфорилирование-дефосфорилирование белков (ферментов), изменяя их активность контролирует экспрессию определенных генов.
Плазматические мембраны большинства клеток имеют рецепторы гормона, являющиеся тирозиновой протеинкиназой. Связывание инсулина с а-протомерами рецептора приводит к изменению его конформации и аутофосфорилированию в-протомеров, которые фосфорилируют белки-субстраты инсулинового рецептора. Эти белки инициируют каскад реакций, приводяший к активации специфических протеинкиназ. Протеинкиназы фосфорилируют специфические фосфопротеинфосфатазы, фосфодиэстеразу цАМФ и цГМФ, а также белковые факторы, ускоряющие экспрессию структурных генов.
64. Изменение активности под действием инсулина. Скелетные мышцы и жировая ткань являются инсулинзависимыми тканями, так как глюкоза поступает в них при участии инсулина. В клетках этих тканей гормон стимулирует перемещение белков-переносчиков глюкозы ГЛЮТ-4 из цитоплазмы в плазматическую мембрану, ускоряет транспорт в них глюкозы и, таким образом, снижает уровень глюкозы в крови. В печени инсулин ускоряет аэробный распад глюкозы, синтез гликогена, ПФП превращения глюкозы, синтез жирных кислот и жиров, синтез холестерола.
В мышцах под действием инсулина повышается активность гликогенсинтазы и увеличивается скорость синтеза гликогена. В мышцах и печени инсулин также активирует фермент фосфодиэстеразу, который гидролизует цАМФ, превращая его в АМФ. Это приводит к замедлению мобилизации гликогена.
В жировой ткани инсулин стимулирует синтез жиров, активируя ацетил-КоА-карбоксилазу и индуцируя синтез синтазы жирных кислот. Гормон ускоряет поступление жирных кислот в адипоциты, так как индуцирует синтез ЛП-липазы. Вместе с тем инсулин тормозит мобилизацию ТАГ в адипоцитах, так как вызывает активацию фосфодиэстеразы. Этот фермент гидролизует цАМФ, а уменьшение содержания цАМФ приводит к снижению активности проте-инкиназы А, вследствие чего снижается активность ТАГ-липазы и тормозится липолиз.
Действие инсулина направлено на ускорение анаболических процессов в абсорбтивный период: увеличение поступления глюкозы, жирных кислот и аминокислот в ткани, синтеза гликогена в печени и мышцах, синтеза жирных кислот и ТАГ в печени и жировой ткани, синтеза белков во многих тканях. Кроме того, инсулин по паракринному механизму тормозит секрецию гормона глюкагона а-клетками поджелудочной железы.
