
- •Функции белков
- •Кеталитический (активный) ценрт.
- •Конкурентное ингибирование.
- •Использование конкурентных ингибиторов как лекарственных препаратов.
- •8. Свойства ферментов.
- •3. Группа гормонов, образующихся из проопиомеланокортина
- •56. Гормоны задней доли гипофиза
- •61. Адреналин синтезируется в мозговом слое надпочечников из тирозина.
- •65. Сахарный диабет
- •79. Витамин в12 служит источником образования двух коферментов: метилкобаламина в цитоплазме и дезоксиаденозилкобаламина в митохондриях.
- •81. Витамины группы d (кальциферолы)
- •87. Роль печени в углеводном обмене
- •96. Биохимический анализ мочи
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.
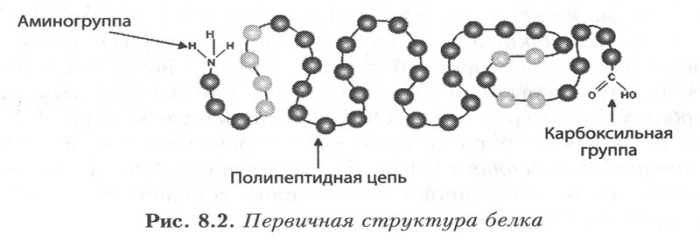
Если
молекула белка состоит всего из 10
аминокислотных остатков, то число
теоретически возможных вариантов
белковых молекул, отличающихся порядком
чередования аминокислот -
 .
Имея 20 аминокислот, можно составить из
них еще большее количество разнообразных
комбинаций. В организме человека
обнаружено порядка десяти тысяч различных
белков, которые отличаются как друг от
друга, так и от белков других организмов.
.
Имея 20 аминокислот, можно составить из
них еще большее количество разнообразных
комбинаций. В организме человека
обнаружено порядка десяти тысяч различных
белков, которые отличаются как друг от
друга, так и от белков других организмов.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Полиморфизм белков — существование разных форм белка, выполняющих одинаковые или очень сходные функции (изобелки). Примером полиморфизма белков является гемоглобин, имеющий множество форм. Гемоглоби́н A— нормальный гемоглобин взрослого человека. Этот белок представляет собой тетрамер, состоящий из двух пар полипептидных цепей — мономеров: двух мономеров α-цепей и двух мономеров β-цепей, или двух мономеров α и двух мономеров δ. Гемоглоби́н F— фетальный, плодный тип гемоглобина человека. Гемоглобин F — это белок-гетеротетрамер из двух α-цепей и двух γ-цепей глобина. Гемоглобин F обладает повышенным сродством к кислороду(в нём серин вместо лизина) и позволяет сравнительно малому объёму крови плода выполнять кислородоснабжающие функции более эффективно. Однако гемоглобин F обладает меньшей стойкостью к разрушению и меньшей стабильностью. В течение последнего триместра беременности и после рождения гемоглобин F постепенно — замещается «взрослым» гемоглобином А (HbA), менее активным транспортёром кислорода, но более стойким к разрушению и более стабильным. Молекулярные болезни – наследственные нарушения в первичной структуре булка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к образованию гемоглобина S и тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль. Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин, кератин, коллаген. Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Гидрофобные связи возникают между неполярными гидрофобными радикалами и играют важную роль в образовании третичной структуры. Водородные связи образуются между полярными (гидрофильными) незаряженными группами радикалов,имеющими подвижный атом водорода и группами с электроотрицательным атомом. Ионные связи образуются между полярными (гидрофильными) ионогенными радикалами,имеющими противоположно заряженные группы. Дисульфидная связь – ковалентнаяобразуется двумя сульфгидрильными (тиольными) группами радикалов цистеина,находящимися в разных местах полипептидной цепи(инсулин,иммуноглобулины).
Фибриллярные белки – белки вытянутой,нитевидной формы(коллаген,креатин). Гидрофобны. Глобулярные – округлые,шаровидные. Преобладают,хорошо растворимы(гемоглобин,ферменты,миоглобин). Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами и двумя β-субъединицами. С каждой субъединицей связана молекула гема, содержащая железо.
ОСОБЕННОСТИ СТРОЕНИЯ И ФУНКЦИОНИРОВАНИЯ ОЛИГОМЕРНЫХ БЕЛКОВ(гемоглобин)
Олигомерные белки могут содержать разное количество протомеров .
В состав олигомерных белков могут входить одинаковые или разные протомеры, например гомодимеры - содержащие 2 одинаковых протомера, гетеродимеры - 2 разных.
Различные по структуре протомеры могут связывать разные лиганды.
Взаимодействие одного протомера со специфическим лигандом вызывает конформационные изменения всего олигомерного белка и изменяет сродство других протомеров к лигандам (кооперативное изменение конформации протомеров).
У олигомерных белков появляется новое по сравнению с одноцепочечными белками свойство — способность к аллостерической регуляции их функций.
Функции белков
Строительная - Белки участвуют в образовании клеточных и внеклеточных структур: волос (кератин), сухожилий (коллаген) и т.д.
Транспортная - Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ.
Регуляторная - Гормоны белковой природы принимают участие в регуляции процессов обмена веществ (инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов).
Защитная - В ответ на проникновение в организм чужеродных белков или микроорганизмов образуются особые белки — антитела, способные связывать и обезвреживать их(фибрин).
Двигательная - Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных.
Сигнальная - В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку.
Запасающая - В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например железо.
Энергетическая - При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Однако в качестве источника энергии белки используются только тогда, когда другие израсходованы.
Каталитическая - Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические реакции, происходящие в клетках.
Активный центр белков - определённый участок белковой молекулы, находящийся в её углублении , сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга. Необходимое условие для функционирования белков - присоединение к нему другого вещества, которое называют "лиганд". Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандом высокоспецифично, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром. Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка структуре лиганда. Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Денатурация белков— термин означающий потерю белками их естественных свойств (растворимости, гидрофильности и др.) вследствие нарушения пространственной структуры их молекул.Процесс денатурации отдельной белковой молекулы приводит к распаду её «жёсткой» трёхмерной структуры
Гемоглоби́н — сложный железосодержащий белок кровосодержащих животных, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. Состоит из 4 протомеров двух типов. Аллостерические эффекты играют важнейшую роль в регуляции и интеграции молекулярных процессов в биологических системах. Гемоглобин является наиболее изученным аллостерическим белком. В процессе окисления молекулы гемоглобина субъединицы, присоединив молекулу кислорода, переходят в «окси»- конформацию, в то время как четвертичная конформации остается еще в «дезокси»- состоянии. Лишь после того как достаточное число субъедиииц перейдет в «окси»-состояние, четвертичная конформации также приобретает «окси»-структуру. Следовательно, «окси»-структуры субъединиц включаются в общую четвертичную «дезокси»-структуру и наоборот. Кооперативный эффект-взаимодействие олигомерного белка гемоглобина с кислородом в одном центре связывания приводит к изменению конформации всей молекулы (принцип домино). Функциональные различия между миоглобином и гемоглобином: Гемоглобин-аллостерический белок, миоглобин таковым не является. Это различие выражается тремя путями: 1. Присоединение 02 к гемоглобину повышает связывание дополнительных молекул 02 молекулой гемоглобина. Другими словами, кислород связывается с гемоглобином кооперативно. Связывание кислорода миоглобином, напротив, является некооперативным. 2. Сродство гемоглобина к кислороду зависит от рН, тогда как миоглобин такой зависимости не проявляет. Молекулы С02 также влияют на способность гемоглобина связывать кислород. 3. Сродство гемоглобина к кислороду регулируется органическими фосфорными соединениями, в частности бисфосфоглицератом. В результате гемоглобин проявляет меньшее сродство к кислороду, чем миоглобин.
дезоксирибонуклеиновые кислоты (ДНК) Нуклеотидные звенья макромолекул ДНК могут содержать аденин, гуанин, цитозин и тимин. Молекулярная масса ДНК достигает десятков миллионов а.е.м. Это самые длинные из известных макромолекул. При описании строения нуклеиновых кислот учитывают различные уровни организации макромолекул: первичную и вторичную структуру.
Первичная структура днк – это нуклеотидный состав и определенная последовательность нуклеотидных звеньев в полимерной цепи. Под вторичной структурой нуклеиновых кислот понимают пространственно упорядоченные формы полинуклеотидных цепей.
Вторичная структура ДНК - две параллельные неразветвленные полинуклеотидные цепи, закрученные вокруг общей оси в двойную спираль. Такая пространственная структура удерживается множеством водородных связей, образуемых азотистыми основаниями, направленными внутрь спирали. Водородные связи возникают между пуриновым основанием одной цепи и пиримидиновым основанием другой цепи. Эти основания составляют комплементарные пары. Образование водородных связей между комплементарными парами оснований обусловлено их пространственным соответствием. Водородные связи между другими парами оснований не позволяют им разместиться в структуре двойной спирали. ТИМИН (Т) комплементарен АДЕНИНУ (А), ЦИТОЗИН (Ц) комплементарен ГУАНИНУ (Г).
Комплементарность оснований определяет комплементарность цепей в молекулах ДНК. Комплементарность полинуклеотидных цепей служит химической основой главной функции ДНК – хранения, использования и передачи наследственных признаков.
Соотношения, выявленные Чаргаффом для аденина (А), тимина (Т), гуанина (Г) и цитозина (Ц), оказались следующими:
Количество аденина равно количеству тимина, а гуанина — цитозину.
Количество пуринов равно количеству пиримидинов.
Количество оснований с аминогруппами равно количеству оснований с кетогруппами. К генным болезням у человека относятся многочисленные болезни обмена веществ. Они могут быть связаны с нарушением обмена углеводов, липидов, стероидов, пуринов и пиримидинов, билирубина, металлов и др. Пока еще нет единой классификации наследственных болезней обмена веществ: фенилкетонурия, алкаптонурия, галактоземия, подагра и т.д.
Роль ферментов в метаболизме - Ферменты выступают в роли катализаторов— ими катализируется более 4000 разных биохимических реакций. Ферменты играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ организма. Ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Многообразие ферметнов - В настоящее время известно более 2000 ферментов, многие из которых катализируют одну реакцию, то есть превращение одного особого субстрата в определенный продукт.
Специфичность ферметнов - Ферменты обычно проявляют высокую специфичность по отношению к своим субстратам. Это достигается частичной комплементарностью формы, распределения зарядов и гидрофобных областей на молекуле субстрата и в центре связывания субстрата на ферменте. Несмотря на общий высокий уровень специфичности, степень субстратной и реакционной специфичности ферментов может быть различной. Например, эндопептидаза трипсин разрывает пептидную связь только после аргинина или лизина, если за ними не следует пролин.
Классификация ферментов: 1) Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза. 2) Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ. 3) Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин. 4) Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов. 5) Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата. 6) Лигазы, катализирующие образование химических связей между субстратами за счет гидролиза АТФ. Пример: ДНК-полимераза.
Изоферменты — это ферменты, синтез которых кодируется разными генами, у них разная первичная структура и разные свойства, но они катализируют одну и ту же реакцию.
Мультиферменты – надмолекулярные образования, которые включают несколько ферментов и коферментов, они катализируют последовательные этапы реакции преобразования одного субстрата(реакции окислительного декарбоксилирования а-кетокислот под влиянием пируватдегидрогеназы и а-кетоглутаратдегидрогеназы).
7. Механизм дейсвия ферментов: 1) На первом этапе происходит активация фермента путем связывания с аллостерическим центром регуляторных веществ (например, гормонов), что приводит к изменению конформации активного центра фермента и увеличению его способности связывать молекулу субстрата.2) На втором этапе происходит 'узнавание' ферментом своего субстрата. 3) На третьем этапе происходит формирование неактивного фермент-субстратного комплекса за счет образования гидрофобных и водородных связей между радикалами аминокислотных остатков субстратного центра и соответствующими группировками в молекуле субстрата. 4) На четвертом этапе образуется активный фермент-субстратный комплекс. При этом происходит химическое преобразование субстрата с участием каталитического центра и кофермента. В результате этого молекула субстрата меняет сою пространственную конфигурацию, в ней происходит перераспределение энергии и уменьшается прочность связей.5) На пятом этапе фермент-субстратный комплекс становиться нестабильным и затем преобразуется в комплекс фермент-продукт, который распадается на продукты реакции и фермент.
