
- •Функции белков
- •Кеталитический (активный) ценрт.
- •Конкурентное ингибирование.
- •Использование конкурентных ингибиторов как лекарственных препаратов.
- •8. Свойства ферментов.
- •3. Группа гормонов, образующихся из проопиомеланокортина
- •56. Гормоны задней доли гипофиза
- •61. Адреналин синтезируется в мозговом слое надпочечников из тирозина.
- •65. Сахарный диабет
- •79. Витамин в12 служит источником образования двух коферментов: метилкобаламина в цитоплазме и дезоксиаденозилкобаламина в митохондриях.
- •81. Витамины группы d (кальциферолы)
- •87. Роль печени в углеводном обмене
- •96. Биохимический анализ мочи
Кеталитический (активный) ценрт.
Активный центр фермента – это участок молекулы ферментного белка, который взаимодействует с субстратом во время катализа и обеспечивает превращение субстрата в процессе катализа.
Каталитический центр принимает непосредственное участие в превращении молекулы субстрата в ходе катализа. Активный центр фермента имеет строго определенную структуру. Он подобен матрице, в которую может войти молекула только определенного строения.
Кофакторы Некоторые ферменты выполняют каталитическую функцию сами по себе, безо всяких дополнительных компонентов. Однако есть ферменты, которым для осуществления катализа необходимы компоненты небелковой природы. Кофакторы могут быть как неорганическими молекулами (ионы металлов, железо-серные кластеры и др.), так и органическими (например, флавин или гем). Органические кофакторы, прочно связанные с ферментом, называют также простетическими группами. Кофакторы органической природы, способные отделяться от фермента, называют коферментами.
Коферменты, или коэнзимы — малые молекулы небелковой природы, специфически соединяющиеся с соответствующими белками, называемыми апоферментами, и играющие роль активного центра или простетической группы молекулыфермента.
Комплекс кофермента и апофермента образует целостную, биологически активную молекулу фермента.Роль коферментов нередко играют витамины или их метаболиты . Например, коферментом фермента карбоксилазы является тиаминпирофосфат, коферментом многихаминотрансфераз — пиридоксаль-6-фосфат.
Конкурентное ингибирование.
В этом случае ингибитор связывается в активном центре фермента и конкурирует за него с субстратом. Таким образом, конкурентный ингибитор не связывается с фермент-субстратным комплексом, то есть константа диссоциации Ki' >> 1.Конкурентный ингибитор обычно структурно схож с субстратом, однако фермент не способен катализировать реакцию в присутствии ингибитора из-за отсутствия у последнего необходимых функциональных групп.
Неконкурентное ингибирование.
Неконкурентный ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу с одинаковой эффективностью. Ингибитор вызывает такие конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату.
Использование конкурентных ингибиторов как лекарственных препаратов.
Многие лекарственные препараты оказывают своё терапевтическое действие по механизму конкурентного ингибирования. Например, четвертичные аммониевые основания ингибируют ацетилхолинэстеразу, катадизирующую реакцию гидролиза ацетилхолина на холин и уксусную кислоту.
8. Свойства ферментов.
Ферменты характеризуются следующими основными свойствами. 1. Все ферменты представляют собой глобулярные белки. 2. Информация о ферментах, как и о других белках, закодирована в ДНК. 3. Ферменты действуют как катализаторы. 4. Присутствие ферментов не влияет ни на природу, ни на свойства конечного продукта (или продуктов) реакции. 5. Ферменты действуют чрезвычайно эффективно, т. е. очень малое количество фермента вызывает превращение больших количеств субстрата. 6. Ферменты высокоспецифичны, т. е. один фермент катализирует обычно только одну реакцию. Каталаза, например, катализирует только расщепление пероксида водорода. 7. Катализируемая ферментом реакция обратима. 8. Активность ферментов меняется в зависимости от рН и температуры, а также от концентрации как субстрата, так и самого фермента. 9. Ферменты снижают энергию активации катализируемой реакции. 10. В молекуле фермента есть активный центр, который вступает в контакт с субстратом. Этот активный центр имеет особую форму.
Зависимость от концентрации фермента
При увеличении количества молекул фермента скорость реакции возрастает непрерывно и прямо пропорционально количеству фермента.
Зависимость скорости реакции от концентрации субстрата
При увеличении концентрации субстрата скорость реакции сначала возрастает соответственно подключению к реакции новых молекул фермента, затем наблюдается эффект насыщения, когда все молекулы фермента взаимодействуют с молекулами субстрата. При дальнейшем увеличении концентрации субстрата между его молекулами возникает конкуренция за активный центр фермента и скорость реакции снижается.
Зависимость скорости реакции от температуры
описывается колоколообразной кривой с максимумом скорости при значениях оптимальной температуры для данного фермента.
Закон о повышении скорости реакции в 2-4 раза при повышении температуры на 10°С справедлив и для ферментативных реакций, но только в пределах до 55-60°С, т.е. до температур денатурации белков. При понижении температуры активность ферментов понижается, но не исчезает совсем.
Зависимость скорости реакции от рН
Зависимость также описывается колоколообразной кривой с максимумом скорости при оптимальном для данного фермента значении рН. Для каждого фермента существует определенный узкий интервал рН среды, который является оптимальным для проявления его высшей активности. Например, оптимальные значения рН для пепсина 1,5-2,5, трипсина 8,0-8,5, амилазы слюны 7,2, аргиназы 9,7, кислой фосфатазы 4,5-5,0, сукцинатдегидрогеназы 9,0.
9. Основные механизмы регуляции действия ферментов и их роль в регуляции метаболизма. Проферменты.
Основные механизмы регуляции действия ферментов: аллостерическая регуляция, регуляция с помощью белок-белковых взаимодействий, регуляция путём фосфорилирования/дефосфорилирования молекулы фермента, регуляция частичным (ограниченным) протеолизом.
Роль в регуляции метаболизма:
1) Аллостерические ферменты играют важную роль в метаболизме, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состояния клетки. Аллостерическая регуляция имеет большое значение в следующих ситуациях: При анаболических процессах, при катаболических процессах, для координации анаболических и катаболических путей, для координации параллельно протекающих и взаимосвязанных метаболических путей.
2) Некоторые ферменты изменяют свою каталитическую активность в результате белок-белковых взаимодействий. Например:
Активация ферментов в результате присоединения регуляторных белков. Этот тип регуляции можно рассмотреть на примере активации фермента аденилатциклазы, локализованной в плазматической мембране клетки.
Активный центр аденилатциклазы локализован на цитоплазматической стороне плазматической мембраны. Активированная аденилатциклаза катализирует реакцию образования из АТФ циклического в АМФ (цАМФ) - вторичного, внутриклеточного посредника действия гормонов.
3) В биологических системах часто встречается механизм регуляции активности ферментов с помощью ковалентной модификации аминокислотных остатков. Быстрый и широко распространённый способ химической модификации ферментов - фосфорилирование/дефосфорилирование. Модификации подвергаются ОН-группы фермента. Фосфорилирование осуществляется ферментами протеинкиназами, а дефосфорилирование – фосфопротеинфосфатазами.
Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными.
Изменение активности фермента, вызванное фосфорилированием, обратимо. Отщепление остатка фосфорной кислоты осуществляется ферментами фосфопротеинфосфатазами. Активность протеинкиназ и фосфопротеинфосфатаз регулируется гормонами. Антагонистичные по функции гормоны противоположным образом влияют на фосфо-рилирование/дефосфорилирование ферментов.
4) Некоторые ферменты, функционирующие вне клеток (в ЖКТ или в плазме крови), синтезируются в виде неактивных предшественников и активируются только в результате гидролиза одной или нескольких определённых пептидных связей, что приводит к отщеплению части белковой молекулы предшественника. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента.
Рассмотрим механизм частичного протеолиза на примере активации протеолитического фермента трипсина. Трипсиноген при пищеварении по протокам поджелудочной железы поступает в двенадцатиперстную кишку, где и активируется путём частичного протеолиза под действием фермента кишечника энтеропептидазы. В результате отщепления гексапептида с N-конца формируется активный центр в оставшейся части молекулы.
Проферменты - неактивный предшественник фермента.
12. Пировиноградная кислота (формула С3Н4O3) — α-кетопропионовая кислота. В ходе гликолиза фруктозо-1,6-бифосфат превращается в пируват - ключевое соединение в энергетическом обмене клетки: одна молекула глюкозы превращается в две молекулы пирувата , а энергия оказывается запасенной в виде четырех молекул: 2 АТФ и 2 NADH2. Одна из основных ролей Пирувата в организме – участие в цикле Кребса (цикл энергии взаимодействий химикатов и ферментов, в результате которых образуется АТФ или ее непосредственные предшественники). В цикл Кребса вовлечены многие вещества, но начинается он с Пирувата, который активирует распад жира, улучшает поступление глюкозы из крови в мышечные ткани. Это вещество помогает сжигать жир и стимулирует окислительные процессы в митохондриях. Участвуя в цикле Кребса, Пируват полностью окисляется, высвобождая огромное количество энергии в энергетическом обмене. В организме Пируват практически полностью расходуется в различных биохимических процессах и не накапливается. Окисление пирувата до ацетил-КоА происходит при участии целого ряда ферментов и коферментов, объединенных в мультиферментный пируватдегидрогеназный комплекс. Процесс окислительного декарбоксилирования пирувата происходит в матриксе митохондрий. В нем принимают участие (в составе сложного мультиферментного комплекса) 3 фермента (пируватдегидрогеназа, ди-гидролипоилацетилтрансфераза, дигидролипоилдегидрогеназа) и 5 кофер-ментов (ТПФ, амид липоевой кислоты, коэнзим А, ФАД и НАД), из которых три относительно прочно связаны с ферментами (ТПФ-E1, ли-поамид-Е2 и ФАД-Е3), а два – легко диссоциируют (HS-KoA и НАД).Все эти ферменты, имеющие субъединичное строение, вместе с коферментами организованы в единый комплекс.
Показано, что составляющие комплекс полипептидные цепи субъединиц дигидролипоилацетилтрансферазы являются ядром комплекса, вокруг которого расположены пируватдегидрогеназа и дигидролипоилдегидрогеназа. Нативный ферментный комплекс образуется путем самосборки.
Суммарную реакцию, катализируемую пируватдегидрогеназным комплексом, можно представить следующим образом:
Пируват + НАД+ + HS-KoA –> Ацетил-КоА + НАДН + Н+ + СO2.
Реакция сопровождается значительным уменьшением стандартной свободной энергии и практически необратима.Образовавшийся в процессе окислительного декарбоксилирования ацетил-КоА подвергается дальнейшему окислению с образованием СО2 и Н2О. Полное окисление ацетил-КоА происходит в цикле Кребса.Этот процесс происходит в митохондриях клеток.
16. Переваривание углеводов начинается уже в ротовой полости: в слюне имеются ферменты амилаза и мальтаза, способные расщепить крахмал до глюкозы. В желудке углеводы не перевариваются, так как кислое содержимое желудка прекращает действие амилазы. А вот двенадцатиперстная кишка - основное место их расщепления: амилаза поджелудочной железы превращает крахмал и гликоген в маленькие осколки-дисахариды (мальтозу и изомальтозу). Амилаза нуждается в щелочной среде. Защелачивание осуществляется бикарбонатами, вырабатываемыми самой поджелудочной железой. Они и нейтрализуют желудочный сок, создавая оптимальные условия для действия переваривающих ферментов. Затем наступает очередь пристеночного пищеварения, осуществляемого ферментами ворсинчатого эпителия тонкой кишки. Здесь расщепляются сахароза, молочный сахар и мальтоза до мономеров - глюкозы, фруктозы, галактозы. Однако в кровь всасывается преимущественно глюкоза, так как в клетках кишечника большая часть галактозы и фруктозы превращается в глюкозу. Из кровеносных сосудов кишечника глюкоза попадает в печень. Часть её там задерживается и депонируется в виде гликогена или используется в многочисленных реакциях обмена, а часть глюкозы поступает в общий кровоток. В ответ на увеличение концентрации глюкозы в крови из поджелудочной железы выбрасывается в кровяное русло гормон инсулин. Он необходим для проникновения глюкозы в клетки мышц и жировой ткани (поступление глюкозы в мозг зависит от её концентрации в крови) и для усвоения глюкозы тканями организма.
Лактоза под действием лактазы в присутствии воды расщипляется до глюкозы и галактозы,а сахараза под действием сахаразы до глюкозы и фруктозы. Метаболизм фруктозы и галактозы включает пути использования их для синтеза других веществ (гетерополисахаридов, лактозы и др.) и участие в энергообеспечении организма. В последнем случае фруктоза и галактоза превращаются в печени либо в глюкозу, либо в промежуточные продукты её метаболизма. Таким образом, в результате фруктоза и галактоза наряду с глюкозой могут быть окислены до СО2 и Н2О или использованы на синтез гликогена и триацилглицеролов. Гала́ктоземи́я — наследственное заболевание, в основе которого лежит нарушение обмена веществ на пути преобразования галактозы в глюкозу (мутация структурного гена, ответственного за синтез фермента галактозо-1-фосфатуридилтрансферазы). Мальабсорбция сахарозы-изомальтозы (непереносимость сахарозы) – врожденное заболевание, характеризующееся неперевариванием сахарозы. Причина - врожденное отсутствие сахаразы – фермента поджелудочной железы, расщепляющего сахарозу в кишечнике. Непереносимость лактозы (или гиполактазия) — термин для описания патологических состояний, вызванных снижением уровня лактазы — фермента, необходимого для правильного переваривания лактозы.
30. Кроме пищевых жиров источником жирных кислот в организме служит их синтез из глюкозы. Непосредственным предшественником жирных кислот при их синтезе в организме является ацетил-КоА. Ацетил-КоА для синтеза жирных кислот образуется путем окислительного декарбоксилирования пирувата. Кроме того, окисление и синтез жирных кислот разделены в пространстве: окисление происходит в митохондриях, а синтез — в цитозоле.Перенос ацетильных остатков из митохондрий в цитозоль. Пируватдегидрогеназный комплекс локализован на внутренней поверхности внутренней мембраны митохондрий, и ацетил-КоА освобождается в матрикс митохондрий. Для синтеза жирных кислот ацетил-КоА должен быть перенесен в цитозоль. Мембрана митохондрий непроницаема для ацетил-КоА, и перенос ацетильного остатка в цитозоль происходит при участии челночного механизма. Пируват, образующийся из глюкозы в цитозоле, поступает в митохондрии, где частью превращается в ацетил-КоА (окислительное декарбоксилирование), частью — в оксалоацетат (при действии пи-руваткарбоксилазы). Затем из этих веществ образуется цитрат, для которого, как и для пирувата, есть белок-переносчик в мембране митохондрий. Образование малонил-КоА. Преобладающая часть ацетил-КоА, используемого для синтеза жирных кислот, вначале превращается в малонил-КоА при действии ацетил-КоА-карбоксилазы. Синтез пальмитиновой кислоты. Пальмитилсинтаза обладает каталитической активностью, в результате которой ацетильный и малонильный остатки переносятся на SH-группу пантотеновой кислоты (ацилтрансферазная активность) (реакции 1 и 2). Далее в реакции 3 ацетильный остаток переносится на место карбоксильной группы малонильного остатка; карбоксильная группа при этом отщепляется в виде С02 (реакция конденсации двух ацетильных остатков). Затем последовательно происходят восстановление р-карбонильной группы (реакция 4), отщепление воды с образованием двойной связи между а- и р-углеродны-ми атомами (реакция 5), восстановление (гидрирование) двойной связи (реакция 6). В результате получается остаток четырехуглеродной жирной кислоты, соединенный с ферментом (бутирил-Е). Все эти реакции катализируются разными активными центрами одного белка: как мы уже отмечали, пальмитилсинтаза — многофункциональный фермент. Субъединица пальмитилсинтазы представляет собой доменный белок, каждый домен которого катализирует одну из шести указанных реакций. Промежуточные продукты остаются постоянно связанными с ферментом через пантотеновую кислоту, перемещаясь на этой «привязи» из одного активного центра в другой. Окисление жирных кислот локализовано в митохондриях, тогда как синтез жирных кислот происходит в цитоплазматическом матриксе. Компартментализация делает возможным одновременное, но раздельное регулирование анаболических путей. Гормональная регуляция
Синтез и окисление триацилглицеролов и жирных кислот зависит от соотношения инсулин/глюкагон.Изменение количества ферментов комплекса пальмитатсинтазы и ацетил-SКоА-карбоксилазы, индуктором биосинтеза этих ферментов является инсулин.
Ковалентная модификация ферментов ацетил-SКоА-карбоксилазы и ТАГ-липазы путем фосфорилирования-дефосфорилирования.
Метаболическая регуляция. В регуляции синтеза и окисления жирных кислот играют роль три участка: 1. Активность ацетил-SКоА-карбоксилазы регулируется: цитратом и ацил-SКоА. 2. Транспорт цитрата из митохондрии в цитозоль подавляется избытком ацил-SКоА, это снижает синтез жирных кислот. 3. Карнитин-ацилтрансфераза ингибируется при образовании малонил-SКоА, что останавливает поступление ацил-SКоА внутрь митохондрий и снижает β-окисление.
33. Печень - это основное место синтеза холестерина и желчных кислот . На образование холестерина влияют многие регуляторные факторы. Большинство из них действуют на ГМГ-КоА-редуктазу - фермент, катализирующий лимитирующую реакцию синтеза холестерина. В крови содержатся как свободный холестерин, так и его эфиры с жирными кислотами. Обе формы обычно связаны с ЛПНП . Этерификация холестерина катализируется лецитинхолестерин-ацилтрансферазой , содержащейся в плазме и печени.
Свободный холестерин обменивается между различными тканями, поэтому его сывороточная концентрация отражает общее содержание холестерина в организме. При поражении печени этерификация холестерина может нарушиться, и тогда снижается сывороточная концентрация его эфиров. При тяжелом поражении печени часто наблюдается понижение общей сывороточной концентрации холестерина, включая свободную и этерифицированную фракции. Это может быть вызвано снижением синтеза холестерина и его эфиров, уменьшением образования апопротеинов или обоими факторами.
Общий холестерин значительно повышается при внутри- и внепеченочном холестазе . Холестаз обычно сопровождается заметными нарушениями метаболизма липопротеидов . При первичном билиарном циррозе печени в сыворотке резко повышаются свободный холестерин и ЛПНП , а ЛПВП понижаются и при большой продолжительности болезни могут практически исчезнуть. Подобные изменения липидного обмена возникают и при других холестатических заболеваниях.
При холестазе повышение свободного холестерина и фосфолипидов с одновременным снижением этерифицированного холестерина может быть связано с уменьшением образования в печени лецитинхолестерин-ацилтрансферазы . Понижение активности этого фермента ведет к образованию аномального ЛПНП - липопротеида X . Он отличается высоким содержанием свободного холестерина и триглицеридов. Он появляется при любых холестатических заболеваниях . Любое повреждение эпителия желчных капилляров и холангиол может повлиять на синтез и расщепление липидов. Нарушение обмена холестерина и других липидов может вызвать изменения в структуре мембраны эритроцитов и привести к появлению эхиноцитов и шпоровидных эритроцитов . Такие эритроциты указывают на далеко зашедшее поражение печени.
34. Перекисное окисление липидов (ПОЛ) в биомембранах. Субстраты и факторы, способствующие его инициации. Роль ПОЛ в норме и патологии. Арахидоновая кислота как предшественник биологически активных соеденений. Биологическая роль витамина Е.
Биологическая роль витамина Е. Витамин Е защищает клеточные структуры от разрушения свободными радикалами, улучшает процессы тканевого дыхания, активирует синтез белка, иммуноглобулинов и факторов неспецифической защиты. Также требуется для воспроизводства клеток иммунной системы, которым необходимо быстро "размножаться" при встрече с источником возможного заболевания. Витамин Е отдаёт атом водорода свободному радикалу пероксида липида, восстанавливая его до гидропероксида и таким образом останавливает развитие ПОЛ.
Перекисное окисление липидов (ПОЛ) — окислительная деградация липидов, происходящая, в основном, под действием свободных радикалов.
Перекисное окисление липидов является свободнорадикальным процессом, инициация которого происходит под действием активных форм кислорода. К ним относятся супероксид-ион О2-, пероксид-ион О22- (из Н2О2), гидроксильный радикал НО*, гидропероксидный радикал НОO* .Они образуются в результате процессов окисления протекающих в клетке при участии железо-содержащих ферментов (цитохромов).
Активные формы кислорода, образуемые в процессе ПОЛ, обеспечивают цитотаксическое действие фагоцитов, являются механизмом регуляции процесса деления клеток, обеспечивают модуляцию апоптоза, ротацию липидного и белкового компонентов биомембран. Действие внешних прооксидантов ( радиация, УФ-свет, гипероксия ) и активация эндогенных механизмов генерации активированных кислородных метаболитов (О2- , Н2О2, ОНЈ, RO2) приводят к напряжению механизмов антиоксидантной защиты (АОЗ) и развитию окислительного стресса, который может проявляться на клеточном, тканевом и организменном уровнях. Возникновение окислительного стресса - важный фактор развития воспалительных процессов, сердечно-сосудистых заболеваний.
Арахидоновая кислота является предшественником биологически активных соединений — эйкозаноидов: диеновых простаноидов (простагландинов; простациклинов, тромбоксанов), тетраеновых лейкотриенов, тетраеновых липотриенов, липоксинов, гидроперокси- и гидроксиэйкозаполиеновых кислот.
35. Переваривание белков. Протеиназы. Механизм активации протеиназ желудочно-кишечного тракта. Специфичность (избирательность) гидролиза пептидных связей. Гниение белков (аминокислот) в толстом кишечнике.
Переваривание белков.Переваривание вначале идет в желудке, затем в просвете тонкого кишечника (полостное пищеварение) и затем пристеночное пищеварение - в пристеночном слое кишечного эпителия. В основном белки перевариваются в кишечнике под действием пептидгидролаз поджелудочной железы (трипсин, химотрипсин, эластаза, карбоксипептидаза) и кишечника (аминопептидаза, дипептидаза, трипептидаза).
Протеиназы - ферменты из класса гидролаз, которые расщепляют пептидную связь между аминокислотами в белках.
Механизм активации протеиназ желудочно-кишечного тракта. Специфичность (избирательность) гидролиза пептидных связей.
Для полного расщепления белков до свободных аминокислот необходимо несколько ферментов с различной специфичностью. Протеиназы и пептидазы имеются не только в желудочно-кишечном тракте, но и в клетках. По месту атаки молекулы субстрата протеолитические ферменты делятся на эндопептидазы и экзопептидазы. Эндопептидазы, или протеиназы, расщепляютпептидную связь внутри пептидной цепи. Они «узнают» и связывают короткие пептидные последовательности субстратов и относительно специфично гидролизуют связи между определенными аминокислотными остатками. Протеиназы классифицируются по механизму реакции.
Гниение белков (аминокислот) в толстом кишечнике.
Разрушение аминокислот при гниении может идти 2 путями:1) декарбоксилирование; 2) окисление боковой цепи.При декарбоксилировании аминокислот образуются соответствующие амины. В толстом кишечнике обычно декарбоксилируются диаминомонокарбоновые аминокислоты, например, при декарбоксилировании орнитина образуется путресцин, при декарбоксилировании лизина образуется кадаверин.Второй путь гниения – окисление боковой цепи аминокислот. По этому пути гниют в основном циклические аминокислоты – тирозин и триптофан. Так, при окислении боковой цепи тирозина образуются крезол и фенол, при окислении боковой цепи триптофана образуются индол и скатол. Эти соединения называют кишечными ядами. Они поступают в воротную вену и в печени подвергаются обезвреживанию путем конъюгации с серной или глюкуроновой кислотами. Индол и скатол предварительно окисляются в печени с образованием индоксила и скатоксила. При этом образуются парные эфиросерные и эфироглюкуроновые кислоты, которые выводятся с мочой.
36. Декарбоксилирование аминокислот. - Процесс отщепления карбоксильной группы аминокислот в виде CO2.Образование биогенных аминов – гистамина, серотонина, ГАМК и их роль в регуляции метаболизма и функций. 1. Гистамин образуется путем декарбоксилирования гистидина в тучных клетках соединительной ткани. Гистамин образует комплекс с белками и сохраняется в секреторных гранулах тучных клеток. Секретируется в кровь при повреждении ткани (удар, ожог, воздействие эндо- и экзогенных веществ), развитии иммунных и аллергических реакций. Гистамин выполняет в организме человека следующие функции: 1) стимулирует секрецию желудочного сока, слюны (т.е. играет роль пищеварительного гормона); 2) повышает проницаемость капилляров, вызывает отёки, снижает АД (но увеличивает внутричерепное давление, вызывает головную боль); 3) сокращает гладкую мускулатуру лёгких, вызывает удушье; 4) участвует в формировании воспалительной реакции - вызывает расширение сосудов, покраснение кожи, отёчность ткани; 5) вызывает аллергическую реакцию; 6) выполняет роль нейромедиатора; 7) является медиатором боли. 2. Серотонин образуется в надпочечниках и ЦНС из аминокислоты 5-гидрокситриптофана в результате действия декарбоксилазы ароматических аминокислот.
Серотонин может превращаться в гормон мелатонин, регулирующий суточные и сезонные изменения метаболизма организма и участвующий в регуляции репродуктивной функции.
Серотонин - биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, оказывает сосудосуживающий эффект, регулирует АД, температуру тела, дыхание, обладает антидепрессантным действием. По некоторым данным он может принимать участие в аллергических реакциях, поскольку в небольших количествах синтезируется в тучных клетках.
3. В нервных клетках декарбоксилирование глутамата (отщепление α-карбоксильной группы) приводит к образованию γ-аминомасляной кислоты (ГАМК), которая служит основным тормозным медиатором высших отделов мозга.
Содержание ГАМК в головном мозге в десятки раз выше других нейромедиаторов. Она увеличивает проницаемость постсинаптических мембран для ионов К+, что вызывает торможение нервного импульса; повышает дыхательную активность нервной ткани; улучшает кровоснабжение головного мозга.
ГАМК в виде препаратов гаммалон или аминалон применяют при сосудистых заболеваниях головного мозга (атеросклероз, гипертония), нарушениях мозгового кровообращения, умственной отсталости, эндогенных депрессиях и травмах головного мозга, а также заболеваниях ЦНС, связанных с резким возбуждением коры мозга (например, эпилепсии).
Распад биогенных аминов.
Накопление биогенных аминов может отрицательно сказываться на физиологическом статусе и вызывать ряд существенных нарушений функций в организме. Однако органы и ткани, как и целостный организм, располагают специальными механизмами обезвреживания биогенных аминов, которые в общем виде сводятся к окислительному дезаминированию этихаминов с образованием соответствующих альдегидов и освобождением аммиака.
Первая, анаэробная, стадия характеризуется образованием альдегида, аммиака и восстановленного фермента. Последний в аэробной фазе окисляется молекулярным кислородом. Образовавшаяся перекись водорода далее распадается на воду и кислород. Моноаминоксидаза (МАО), ФАД-содержащий фермент, преимущественно локализуется в митохондриях, играет исключительно важную роль в организме, регулируя скорость биосинтеза и распада биогенных аминов.
45. Нуклеоти́ды — фосфорные эфиры нуклеозидов. Свободные нуклеотиды, в частности АТФ, цАМФ, АДФ, играют важную роль в энергетических и информационных внутриклеточных процессах, а также являются составляющими частями нуклеиновых кислот и многих коферментов. Нуклеотиды являются сложными эфирами нуклеозидов и фосфорных кислот. Нуклеозиды, в свою очередь, являются N-гликозидами, содержащими гетероциклический фрагмент, связанный через атом азота с C-1 атомом остатка сахара.
В природе наиболее распространены нуклеотиды, являющиеся β-N-гликозидами пуринов или пиримидинов и пентоз. В зависимости от структуры пентозы различают рибонуклеотиды и дезоксирибонуклеотиды, которые являются мономерами молекул сложных биологических полимеров —РНК или ДНК. Фосфатный остаток в нуклеотидах обычно образует сложноэфирную связь с 2'-, 3'- или 5'-гидроксильными группами рибонуклеозидов, в случае 2'-дезоксинуклеозидов этерифицируются 3'- или 5'-гидроксильные группы.Большинство нуклеотидов являются моноэфирами ортофосфорной кислоты, однако известны и диэфиры нуклеотидов, в которых этерифицированы два гидроксильных остатка (цАМФ и цГМФ). Наряду с нуклеотидами — эфирами ортофосфорной кислоты в природе также распространены и моно- и диэфиры пирофосфорной кислоты (аденозиндифосфат) и моноэфиры триполифосфорной кислоты (аденозинтрифосфат).
50. Клетка регулирует образования белков, поскольку синтез белка требует затраты большого количества энергии. Манипулирование способностью РНК-полимеразы связываться с молекулой ДНК является важным регулирующим механизмом, контролирующим образование белков. Инициация транскрипции может происходить несколькими путями. Часто это зависит от присоединения к ДНК особых молекул (активаторов транскрипции), в результате чего конформация ДНК изменяется и позволяет РНК-полимеразе присоединиться к молекуле ДНК. Иногда это может зависеть от удаления особого типа соединений, обычно белков (репрессоров), которые блокируют участок связывания РНК-полимеразы. Например, клетки печени способны превращать глюкозу в форму, подходящую для хранения, гликоген. Ферменты, которые ответственны за это превращение, «учитываются» с ДНК только при высоком уровне глюкозы. Повышенный уровень глюкозы вызывает изменение конформации ДНК. Эти изменения приводят к удалению блока на промотерном участке, в результате чего РНК-полимераза присоединяется к ДНК. Оперон (Operon) - группа тесно связанных между собой генов, которые регулируют образование ферментов в организме.
51. Взаимосвязь обмена аминокислот, жиров и углеводов. Схема превращения глюкозы и аминокислот в жиры. Схема синтеза глюкозы из аминокислот. Схема образования углеродного скелета аминокислот из углеводов и глицерина.
Взаимосвязь обмена аминокислот, жиров и углеводов.
Взаимосвязь обмена углеводов, жиров, белков проявляется в двух аспектах: а) в наличии единых промежуточных продуктов обмена и б) во взаимопревращениях углеродов, жиров, белков.
В обмене этих веществ можно выделить три основные стадии: 1) подготовительную, 2) стадию универсализации, 3) стадию окисления в цикле трикарбоновых кислот.
В первой стадии представлены реакции гидролиза. Ди- и полисахариды преобразуются до моносахаридов или их эфиров с фосфорной кислотой, жиры расщепляются на глицерин и жирные кислоты, белки - на аминокислоты.
На стадии универсализации из углеводов, глицерина, жирных кислот, некоторых аминокислот образуется один и тот же продукт - КоА.
Превращения других аминокислот смыкаются с превращениями жиров, белков, углеводов на третьей стадии, стадии окисления ацетил КоА в цикле трикарбоновых кислот.
Таким образом, процессы распада жиров, белков, углеводов сходятся (в большинстве своем на стадии образования ацетил КоА), образуя в дальнейшем единый метаболический цикл (цикл трикарбоновых кислот), завершающий их превращения.
Схема превращения глюкозы и аминокислот в жиры, Схема синтеза глюкозы из аминокислот и схема образования углеродного скелета аминокислот из углеводов и глицерина.
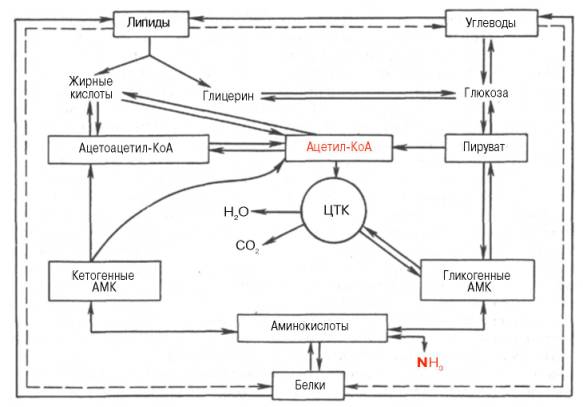
52. РЕГУЛЯЦИИ МЕТАБОЛИЗМА. Эту взаимосвязь осуществляют 4 основные системы регуляции.Центральная и периферическая нервные системы через нервные импульсы и нейромедиаторы; Эндокринная система через эндокринные железы и гормоны, которые секретируются в кровь и влияют на метаболизм различных клеток-мишеней;
Паракринная и аутокринная системы посредством различных соединений, которые секретируются в межклеточное пространство и взаимодействуют с рецепторами либо близлежащих клеток, либо той же клетки (простагландины, гормоны ЖКТ, гистамин и др.);
Иммунная система через специфические белки (цитокины, антитела).
Иерархия регуляторных систем
Первый уровень - ЦНС. Нервные клетки получают сигналы, преобразуют их в форму нервного импульса и передают через синапсы, используя химические сигналы - медиаторы. Медиаторы вызывают изменения метаболизма в эффекторных клетках.
Второй уровень - эндокринная система. Включает гипоталамус, гипофиз, периферические эндокринные железы, синтезирующие гормоны и высвобождающие их в кровь.
Третий уровень - внутриклеточный. Его составляют изменения метаболизма в пределах клетки или отдельного метаболического пути, происходящие в результате: изменения активности ферментов путём активации или ингибирования; изменения количества ферментов по механизму индукции или репрессии синтеза белков или изменения скорости их разрушения; изменения скорости транспорта веществ через мембраны клеток.
В гипоталамусе стимулируется синтез пептидных либеринов и статинов, которые, соответственно, стимулируют или ингибируют синтез и секрецию гормонов передней доли гипофиза. Гормоны передней доли гипофиза, называемые тройными гормонами, стимулируют образование и секрецию гормонов периферических эндокринных желёз, которые поступают в общий кровоток и взаимодействуют с клетками-мишенями.
Поддержание уровня гормонов в организме обеспечивает механизм отрицательной обратной связи. Изменение концентрации метаболитов в клетках-мишенях по механизму отрицательной обратной связи подавляет синтез гормонов, действуя либо на эндокринные железы, либо на гипоталамус. Синтез и секреция тропных гормонов подавляется гормонами эндокринных периферических желёз.
Не все эндокринные железы регулируются подобным образом. Гормоны задней доли гипофиза (вазопрессин и окситоцин) синтезируются в гипоталамусе в виде предшественников и хранятся в гранулах терминальных аксонов нейрогипофиза.
53. Механизм действия дистантных гормонов. Роль мембраносвязанных ферментов в передаче внешнего сигнала в клетку.
гормоны дистантного действия: белковые и пептидные гормоны, катехоламины, а также ряд биогенных аминов. Эти гормоны связываются на поверхности клетки-мишени с соответствующим рецептором и управляет обменными процессами с поверхности клетки, что обусловливает ряд биохимических изменений, приводящих к образованию вторичного посредника. Обычно это выражается в активации аде- нилатциклазной системы и накоплении циклического аденозинмонофос- фата (цАМФ). Последний в свою очередь запускает следующую цепь процессов, важнейшими звеньями которой являются активация протеин- киназ и фосфорилирование белковых субстратов. По такому механизму, в частности, катехоламины регулируют интенсивность гликогенолиза. Специфичность ответа клетки на тот или иной гормон определяется специфичностью рецептора, который связывается только со своим гормоном, а также природой специфических для клетки протеинкиназ и белковых субстратов.
Механизм действия дистантных гормонов. - свойство гормонов, заключающееся в их выработке на значительном удалении от органов-мишеней.
Роль мембраносвязанных ферментов в передаче внешнего сигнала в клетку.
Многие клеточные процессы катализируются мембраносвязан-ными ферментами. Мембраносвязанные интегральные ферменты обладают амфипатической структурой и состоят из гидрофильного и гидрофобного доменов (частей). Таким образом, установлена важная роль гидрофобного домена в формировании каталитических свойств мембраносвязанных ферментов. Такая функция наряду с якорной является принципиальной характеристикой этой части фермента. Их внеклеточные домены ответственны за выработку вторичных посредников, которые и оказывают влияние на обмен вещ-в
54. АМФ циклический является универсальным посредником передачи внутриклеточного сигнала с внешней стороны клеточной мембраны к эффекторным системам клетки, действие которых вызывает генерализованную реакцию клетки на воздействие внешнего биологически-активного вещества, например гормона. цАМФ синтезируется из АТФ при посредстве фермента аденилатциклазы .
цАМФ - основной вторичный посредник . цАМФ является вторичным месенджером для всех гидрофильных гормонов. Связывание этих гормонов с рецептором увеличивает содержание цАМФ в клетке в результате активации фермента аденилатциклазы , превращающего АТФ цАМФ. цАМФ затем стимулирует второй фермент, протеинкиназу , которая фосфорилирует ряд других белков. Последние обычно являются ферментами, которые существуют в активной и неактивной формах, в зависимости от того, подверглись они фосфорилированию или нет. Таким образом, гормоны, которые действуют через цАМФ, осуществляют свою биологическую функцию путем фосфорилирования специфических ферментов и посредством этого изменяют их активность. Удаление цАМФ осуществляется вездесущим ферментом, фосфодиэстеразой , которая превращает цАМФ в неактивный метаболит АМФ.
В ряде случаев внеклеточные лиганды после взаимодействия с рецепторами индуцируют образование вторичных мессенджеров через участие GTP-связывающих и GTP-гидролизующих гетеродимерных белков, названных G-белками.
В этих системах имеет место последовательность реакций. Внеклеточный лиганд специфически распознается трансмембранным рецептором, который, в свою очередь, активирует соответствующий G-белок, локализованный на цитоплазматической поверхности мембраны. Активированный G-белок изменяет активность эффектора, который повышает внутриклеточную концентрацию вторичного мессенджера. Каждый вид рецептора взаимодействует только с определенным представителем семейства G-белков, а каждый G-белок - со специфическим классом эффекторных молекул. Таким образом, гормон или нейромедиатор, реагируя со своим рецептором, вызывает активацию GS-белка, стимулирующего аденилатциклазу. Этот фермент превращает внутриклеточный ATP в cAMP. Внутриклеточный уровень cAMP может специфически понижаться под действием фосфодиэстеразы, которая превращает cAMP в 5'-AMP.
cAMP активирует множество cAMP-зависимых протеинкиназ, каждая из которых фосфорилирует определенные белки-субстраты. В большинстве клеток животных присутствуют две cAMP-зависимые протеинкиназы, фосфорилирующие белки-мишени по остаткам Сер и Три. Специфичность регуляторных воздействий cAMP обеспечивается наличием в клетках определенных типов только им присущих тканеспецифических белков, являющихся субстратами для A-киназ. При понижении концентрации гормонов во внеклеточной среде внутриклеточное содержание сАМР быстро уменьшается, так как фосфодиэстераза превращает сАМР в 5'-AMP. Одновременно происходит дефосфорилирование белков-мишеней A-киназ под действием фосфатаз . Активность некоторых фосфатаз также регулируется по cAMP- зависимому механизму. Кроме того, большинство клеток синтезирует белок, названный ингибитором протеинкиназы (PKI), который блокирует активность C-субъединиц A-киназы. Это сопровождается инактивацией соответствующих факторов транскрипции и подавлением экспрессии регулируемых ими генов.
55. В передней доле гипофиза (аденогипофизе) синтезируются так называемые тропные гормоны, стимулирующие синтез и секрецию гормонов других эндокринных желёз или оказывающие влияние на метаболические реакции в других тканях-мишенях. Синтез и секреция гормонов передней доли гипофиза регулируются гормонами гипоталамуса, которые поступают в гипофиз через портальную систему кровеносных сосудов, связывающих гипоталамус и переднюю долю гипофиза. Кроме того, секреция гормонов гипоталамуса и гипофиза регулируется по механизму обратной связи гормонами, продукцию которых они стимулируют в органах-мишенях. В передней доле гипофиза синтезируются гормоны, которые по химическому строению являются пептидами и гликопротеинами.
1. Гормон роста, пролактин
Гормон роста синтезируется в соматотроф-ных клетках, наиболее многочисленных в передней доле гипофиза. Гормон роста у всех видов млекопитающих представляет собой одноцепочечный пептид, состоящий из 191 аминокислотного остатка и имеющий 2 внутримолекулярные дисульфидные связи. Гормон роста образуется из прогормона. Секреция гормона роста носит пульсирующий характер. Один из самых больших пиков отмечается вскоре после засыпания. Под влиянием различных стимулов даже у нерастущих взрослых людей уровень гормона роста в крови может возрастать. Основной стимулирующий эффект оказывает соматолиберин, основной тормозящий - гипоталамический соматостатин. вязывание рецептора с гормоном роста вызывает димеризацию 2 рецепторов, что приводит к активации связанных с рецептором Янус-киназ и фосфорилированию Янус-киназ и рецептора по остаткам тирозина. Активация рецептора гормона роста сопровождается повышением активности тирозинкиназ и фосфолипазы С с последующим повышением уровня ДАГ и ИФ3 и активацией протеинкиназы С. В жировой ткани усиливается потребление глюкозы и липогенез, вследствие чего происходит снижение концентрации глюкозы в крови. В дальнейшем: усиливается липолиз в жировой ткани, увеличивается концентрация жирных кислот в крови, а в случае недостаточности инсулина увеличивается содержание кетоновых тел в крови. Основное действие гормона роста направлено на регуляцию обмена белков и процессов, связанных с ростом и развитием организма.
Пролактин синтезируется лактотрофными клетками передней доли гипофиза в виде прогормона. Число этих клеток резко возрастает при беременности под влиянием эстрогенов. Он состоит из 199 аминокислотных остатков, образующих одну полипептидную цепь с тремя дисульфидными связями. Оба гормона имеют общие антигенные детерминанты, сходное строение рецепторов и пути трансдукции сигналов в клетки. Основная физиологическая функция пролактина - стимуляция лактации. Пролактин индуцирует синтез α-лактальбумина и казеина, активирует синтез фосфолипидов и ТАГ. На процессы роста Пролактин влияет в значительно меньшей степени, чем гормон роста. Пролактин также повышает гуморальный и клеточный иммунитет. Синтез и секрецию пролактина стимулируют тиреолиберин, серотонин, окситоцин, ацетил-холин, ингибирующий эффект оказывает дофамин.
Плацента продуцирует гормон (плацентарный лактоген) , гомологичный по аминокислотному составу гормону роста и пролактину. Все 3 гормона имеют общие антигенные детерминанты и обладают рост-стимулирующей и лакто-генной активностью. 2. Тиреотропин, лютеинизирующий гормон и фолликулостимулирующий гормон
Тиреотропин, ЛГ и ФСГ - гликопротеины. Тиреотропин (TIT) синтезируется в тиреотрофных клетках передней доли гипофиза. Стимуляция секреции тиреотропина происходит под влиянием тиреолиберина, а основное ингибирующее действие оказывает повышение уровня тиреоидных гормонов. Основная биологическая функция тиреотропина - стимуляция синтеза и секреции йод-тиронинов (Т3 и Т4) в щитовидной железе.Для проявления биологического действия необходимо связывание тиреотропина с двумя доменами рецептора. Одни включают стимуляцию всех стадий синтеза и секреции йодтиронинов ,другой стимуляцию синтеза белков, фосфолипидов, нуклеиновых кислот, увеличение размеров и количества тиреоидных клеток.
Некоторые иммуноглобулины класса G, взаимодействуя с рецепторами тиреотропина, имитируют эффекты гормона. В группу гормонов, относящихся к гликопротеинам, входят также гонадотропные гормоны гипофиза ЛГ и ФСГ и хорионический гонадотропин (ХГ).
