
- •10/1. Основные разделы и методы. Содержание и задачи курса. Общенаучное и практическое значение науки о поверхностных явлениях и дисперсных системах. Исторические этапы развития науки.
- •10/2.Мицеллообразование. Понятие о ккм. Строение мицелл. Мицеллы пав в водных растворах. Моющее действие мыл.
- •10/3.Для коагуляции 10 -3 золя гидроксида алюминия требуется 10 мл раствора сульфата алюминия с концентрацией 0,01 кмоль/м3. Определите порог коагуляции золя.
- •12/1. Основные классификации: по дисперсности, агрегатному состоянию вещества, структуре, межфазному взаимодействию. Получение дисперсных систем.
- •13/2. Молекулярные коллоиды. Строение и свойства. Взаимодействие с растворителем.
- •14/1. Лиофобные дисперсные системы. Факторы устойчивости лиофобных систем. Быстрая и медленная коагуляция. Кинетика коагуляции по Смолуховскому, уравнение Смолуховского.
- •14/2.Приведите и охарактеризуйте основные физико-химические свойства растворов белков.
- •15/1. Аэрозоли. Способы получения и свойства аэрозолей. Факторы устойчивости аэрозолей.
- •15/2. Адсорбция и пов-тное натяжение. Связи адсорбции с параметрами системы. Изотерма адсорбции.
- •15/3. Классификация свободнодисперсных систем по размерам частиц. Лиофильные и лиофобные золи. Приведите примеры типичных мицелл, поясните их состав, в чем они одинаковы, чем различаются.
- •16/1. Метод избытков Гиббса. Фундаментальное адсорбционное уравнение Гиббса. Гиббсовская адсорбция. Частное выражение уравнения Гиббса.
- •16/2. Эмульсии. Приведите классификации эмульсий и методы их изучения. Опишите основные физ-хим. Св-ва. Что такое обращение фаз эмульсий?
- •17/1. Поверхностная активность.Адсорбция орг.Мол-л.Правило Траубе.Понятие о пав.
- •17/2.Приведите классификацию структурир. Систем.Опишите мех-мы образ-ия и разруш-ия структурир.Систем.Что такое тиксотропия, синерезис?
- •17/3.Общая хар-ка поверхн-ой энергии.Поверхн.Эн.В общем ур-ии I и II начал термодин-ки. Пов-тное натяжение как мера энергии Гиббса межфазной границы.
- •18/1.Структурир.Системы.Вязкость и упругопластические св-ва дисп.Систем.Ур-ие Ньютона.
- •18/2.Кинетика коагуляции.Ур-ие Смолуховского.
- •18/3.Задачи кол.Химии в решении экологич.Проблем.На примере решения проблем водо-газоочистки.
- •19/1Суспензии,их полидисперсность.Стабилизация суспензий в водных и орг.Средах. Технич-ие суспензии и пасты мин.И орг.В-в.
- •19/2.Кинетика коагуляции эл-тами.Теории коагуляции эл-тами;химическая,длфо.
- •19/3.Правило фаз Гиббса и дисперсность.
- •20/1.Получение дисп.Сис-м.Методы диспергирования. Адсорбционное ↓ прочности (эффект Ребиндера).
- •20/3.Классификация мех-мов адсорбции(физ.Адсорбция,хемосорбция и ионообменная). Особенности составляющих сил Ван-дер-Ваальса при адсорбции.
- •21/1.Факторы устойчивости.Коагуляция типично гидрофоб.Коллоидов.Опишите осн. Факторы коагуляции без исп.Электролитов.
- •21/2.Адсорбция газов и паров на однород.Пов-ти.З-н Генри.Ур-ие мономолек.Адсорбции Ленгмюра и его анализ.Опред-ие констант в ур-ии Ленгмюра.
- •2 1/3.Для коагуляции 10-3 м3 золя Al(oh)3 требуется 10 мл р-ра Al2(so4)3 с конц-цией 0,01 кмоль/м3.Определите порог коагуляции.
- •22/1.Теория полимолекулярной адсорбции бэт,ур-ие изотермы адсорбции,его анализ.
- •22/2.Электрокинетические явления. Электрофорез. Потенциал и ток течения. Эффект седиментации.
- •22/3. Что такое частичная концентрация? Какие методы ее определения вы знаете?
- •23/1 Пористые тела. Колич. Хар-ки пористых материалов. Классификация пористых тел по Дубинину.
- •23/2Теории д.Э.С Гуи-Чэмпэна, Штерна. Представления Грэма.Электрокинетический потенциал.
- •24/1Особенности адсорбции на микропористых материалах. Потенциальная теория Поляни. Адсорбционный потенциал. Характеристическая кривая адсорбции.
- •24/2 Что такое электрокинетический потенциал? Какие факторы определяют величину этого потенциала?
- •26/1 Возникновение объёмно-пористых стр-р. Структурообразование по теории длфо. Коагуляционно- тиксотропные и конденсационно- кристаллизационные стр-ры.
- •27/1.Ньютоновские и неньютоновские жидкости. Вязкость жидких агрегативно устойчивых дисперсных систем. Уравнение Бингама и Эйнштейна. Измерения вязкости с помощью вискозиметра.
- •27/2 Природные и синтетические вмс. Строение макромолекул и их св-ва. Набухание и растворение вмс. Степень и скрость набухания.
- •27/3 Расклинивающее давление и его составляющие
- •28/1Общие вопросы устойчивости дисперсных систем. Седиментационная и агрегативная устойчивость.
- •28/2 Адсорбция на границе раствор-газ. Поверхностное натяжение. Уравнение Гиббса и его анализ.
- •29/1 Классификация поверхностных явлений. Смачивание. Краевой угол смачивания. Уравнение Юнга.
- •29/2.Почему и в каких случаях лиофильные золи проявляют свойства растворов низкомолекулярных веществ и коллоидных систем?
- •29/3Адгезия, когезия, смачивание и растекание жидкости. Уравнение Дюпре для работы адгезии. Закон Юнга. Связь работы адгезии с краевым углом (уравнение Дюпре-Юнга).
- •30/1 Природные и синтетические вмс. Строение макромолекул и их свойства. Набухание и растворение вмс. Степень и скорость набухания.
- •30/3 Критическая концентрация мицеллобразования (ккм). Основные факторы, влияющие на ккм. Методы определения ккм.
- •1/1 Термодинамика растворения вмс. Влияние природы вмс и растворителя на состояние макромолекул в растворе. Ассоциаты молекул. Возможность микрогетерогенности в растворе вмс.
- •1/2 Капиллярные явления и их роль в природе и технологии. Уравнение капиллярной конденсации Кельвина.
- •2/1 Получение и важнейшие методы обнаружения дисперсных систем.
- •2/3 Факторы стабилизации в системах с твердой дисперсной средой. Высокопористые материалы, их классификация и специфические особенности.
- •3/1 Двойной электрический слой по теории Штерна, перезарядка поверхности. Строение мицеллы и дэс.
- •3/2Специфика свойств дисперсных систем. Классификация по дисперсности, агрегатному состоянию, структуре, межфазному взаимодействию.
- •3/3Броуновское движение и его молекулярно-кинетическая природа. Связь между средним сдвигом частиц и коэффициентом диффузии (закон Эйнштейна – Смолуховского).
- •4/1Особенности оптических свойств дисперсных систем. Уравнение Релея для светорассеяния и его анализ. Фиктивное поглощение света дисперсными системами и уравнение Ламберта-Бугера-Бера.
- •4/2Студни. Схема взаимосвязи процессов образования и распада структур в системе геля.
- •4/3Теории Поляни-Дубинина объемного заполнения микропор.
- •5/3Сравнительная характеристика физической и химической адсорбции. Уравнение Фрейндлиха. Изотерма адсорбции. Теплота адсорбции. Кинетика адсорбции.
- •6/1Растворы вмс. Получение и св-ва р-ров вмс. Изоэлектрическое состояние м-л вмс.
- •6/2Рассеяние света дисперсными системами. Анализ уравнения Рэлея.
- •6/3 Что такое структурная вязкость и как он меняется под нагрузкой.
- •7/1Модель двойного электрического слоя на пов-ти ч-цы золя (по Гельмгольцу-Гуи-Штерну). Поясните, как меняется потенциал в дэс. Электрокинетический потенциал.
- •8/1.Структурированные дисперсные системы. Классификация, методы получения и основные св-ва: тиксотропия, синерезис, релаксационные явления, гистерезис.
- •8/2. Диффузия. Законы Фика для диффузии. Коэффициент диффузии.
- •8/3. Напишите формулу мицеллы золя на основе агрегата PbO2 c отрицательным зарядом мицеллы. Поясните роль адсорбционных процессов в образовании мицеллы.
- •9/1 Белки. Физико-химические свойства растворов белков. Строение пленок белков на межфазной поверхности.
- •9/2.Механизмы возникновения заряда на частицах дисперсной фазы. Строение дэс по Штерну-Гельмгольцу-Гуи.
- •88. Ассоциирование органических молекул в растворах.
- •31/2. Гели. Получение и свойства. Механизм и кинетика набухания.
- •36.Седиментационно-диффузное равновесие в золях. Условие этого равновесия.
- •11/3Структурно – механические св-ва дисперсных систем. Понятие о деформациях, прочности, пластичности
1/2 Капиллярные явления и их роль в природе и технологии. Уравнение капиллярной конденсации Кельвина.
Капиллярные явления играют большую роль в природе и технике. Так, подъем питательного раствора по стеблю или стволу растения в значительной мере обусловлен явлением капиллярности: раствор поднимается по тонким капиллярным трубкам, образованным стенками растительных клеток. По капиллярам почвы поднимается вода из глубинных слоев в поверхностные слои. Уменьшая диаметр почвенных капилляров путем уплотнения почвы, можно усилить приток воды к поверхности почвы, т. е. к зоне испарения, и этим ускорить высушивание почвы. Наоборот, разрыхляя поверхность почвы и разрушая тем самым систему почвенных капилляров, можно задержать приток воды к зоне испарения и замедлить высушивание почвы. Именно на этом основаны известные агротехнические приемы регулирования водного режима почвы - прикатка и боронование. По капиллярным каналам в стенках зданий поднимается грунтовая вода (в отсутствие гидроизоляции); по капиллярам фитиля поднимаются смазочные вещества (фитильная смазка); на явлении капиллярности основано использование промокательной бумаги и т. д.
Упругость пара над мениском жидкости и радиус капилляра математически связаны уравнением Кельвина (Томсона), которое имеет вид:
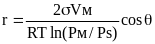 ,
где r-радиус
капилляра; σ-поверхностное натяжение;
,
где r-радиус
капилляра; σ-поверхностное натяжение;
Vм -мольный объем; Рм и Рs – упругость насыщенного пара над вогнутым мениском и плоской поверхностью чистой жидкости соответственно; Ө - угол смачивания.
Часто это уравнение представляют в экспоненциальной форме для случая полной смачиваемости жидкостью поверхности пор (при Ө=0):
Рм=Рs exp (+-2σVм/rRT).(1)
Из уравнения (1) следует, что между радиусом поры и давлением насыщенного пара над мениском существует обратная зависимость. Поэтому с уменьшением радиуса капилляра внутри него возрастает давление пара, что приводит к увеличению кривизны мениска жидкости.
2/1 Получение и важнейшие методы обнаружения дисперсных систем.
Методы получения микрочастиц разделяют на две большие группы. Методы первой группы предусматривают диспергирование твердых частиц, в методах второй группы вещество дисперсной фазы получается в результате химической или физической конденсации из систем с более высокой степенью дисперсности (растворов, газов, паров). Промежуточное место занимает метод, называемый пептизацией.
Условия для получения коллоидных систем:
Малая растворимость вещества дисперсной фазы в дисперсионной среде;
Наличие в дисперсионной среде веществ, которые могут стабилизировать образующиеся коллоидные частицы.
метод диспергирования
Диспергирование – раздробление и механическое истирание вещества на частицы заданных размеров. Для приготовления золей типа т-ж смешивают полученные порошки с жидкостью, выбранной в качестве дисперсной среды до получения однородной смеси.
химическая конденсация – в основе получения большинства мицелл лиофобных эолей. Механизм:
образование зародышей в пересыщенном растворе
рост зародышей до размеров коллоидных частиц
- транспорт (движущая сила – диффузия)
адсорбция стабилизатора и формирование слоя противоионов
3. Конденсация – конденсация молекул вещества, фазы или жидкости, дает макрогетерогенные системы
4. пептизация – диспергирование свежевыпавшего осадка какого-либо веществ
2/2Дисперсное состояние вещества. Понятие о мицеллах неорганических и органических золей. Каковы отличительные особенности коллоидного состояния вещества.
Дисперсная система – это гетерогенная многофазная система, одна из фаз которой представляет собой непрерывную дисперсионную среду, а другие фазы равномерно распределены в ней в виде мелких частиц.
Основными признаками дисперсного состояния являются гетерогенность, дисперсность и высокая поверхностная энергия у частиц дисперсной фазы.Гетерогенность указывает на наличие межфазной поверхности, характер которой в значительной степени определяет природу и свойства дисперсных систем. На межфазных поверхностях протекают реакции с участием дисперсных систем. Этот признак дисперсного состояния позволяет отличать дисперсные системы от истинных растворов.
Дисперсность (раздробленность): в первом случае она представляет собой меру раздробленности материи. Во втором случае с этим понятием связывают раздробленность до размеров частиц от 10-7 до 10-1. Ее характеристики: удельная поверхность Sуд и степень дисперсности D.
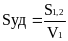 или
или
 .
.
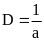 ;
;
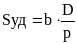 ,
где b
– коэффициент пропорциональности,
величина которого определяется формой
частиц дисперсной фазы.
,
где b
– коэффициент пропорциональности,
величина которого определяется формой
частиц дисперсной фазы.
Свободная поверхностная энергия сосредоточена на границе раздела фаз:
∆GS=σ∆S1,2.
Мицеллы – нейтральные частицы дисперсной фазы коллоидных размеров, равномерно распределенных в дисперсной среде. Строение мицеллы характеризуется некоторым образованием, окруженным ЭДС. Мицеллы состоят из ядра круглой или аморфной структуры и поверхностного слоя, включая сольватно связанные молекулы окружающей среды.
Коллоидное состояние вещества представляет собой качественно особую форму его существования.
Коллоидные системы – это свободнодисперсные склонные к тиксотропии системы с размерами (в поперечнике) частиц дисперсной фазы в пределах 10-7…10-5 см.
К типичным коллоидным системам относят многокомпонентные гетерогенные высокодисперсные системы, у которых можно четко выделить мельчайшие частички дисперсной фазы и непрерывную дисперсионную среду.
