
- •10/1. Основные разделы и методы. Содержание и задачи курса. Общенаучное и практическое значение науки о поверхностных явлениях и дисперсных системах. Исторические этапы развития науки.
- •10/2.Мицеллообразование. Понятие о ккм. Строение мицелл. Мицеллы пав в водных растворах. Моющее действие мыл.
- •10/3.Для коагуляции 10 -3 золя гидроксида алюминия требуется 10 мл раствора сульфата алюминия с концентрацией 0,01 кмоль/м3. Определите порог коагуляции золя.
- •12/1. Основные классификации: по дисперсности, агрегатному состоянию вещества, структуре, межфазному взаимодействию. Получение дисперсных систем.
- •13/2. Молекулярные коллоиды. Строение и свойства. Взаимодействие с растворителем.
- •14/1. Лиофобные дисперсные системы. Факторы устойчивости лиофобных систем. Быстрая и медленная коагуляция. Кинетика коагуляции по Смолуховскому, уравнение Смолуховского.
- •14/2.Приведите и охарактеризуйте основные физико-химические свойства растворов белков.
- •15/1. Аэрозоли. Способы получения и свойства аэрозолей. Факторы устойчивости аэрозолей.
- •15/2. Адсорбция и пов-тное натяжение. Связи адсорбции с параметрами системы. Изотерма адсорбции.
- •15/3. Классификация свободнодисперсных систем по размерам частиц. Лиофильные и лиофобные золи. Приведите примеры типичных мицелл, поясните их состав, в чем они одинаковы, чем различаются.
- •16/1. Метод избытков Гиббса. Фундаментальное адсорбционное уравнение Гиббса. Гиббсовская адсорбция. Частное выражение уравнения Гиббса.
- •16/2. Эмульсии. Приведите классификации эмульсий и методы их изучения. Опишите основные физ-хим. Св-ва. Что такое обращение фаз эмульсий?
- •17/1. Поверхностная активность.Адсорбция орг.Мол-л.Правило Траубе.Понятие о пав.
- •17/2.Приведите классификацию структурир. Систем.Опишите мех-мы образ-ия и разруш-ия структурир.Систем.Что такое тиксотропия, синерезис?
- •17/3.Общая хар-ка поверхн-ой энергии.Поверхн.Эн.В общем ур-ии I и II начал термодин-ки. Пов-тное натяжение как мера энергии Гиббса межфазной границы.
- •18/1.Структурир.Системы.Вязкость и упругопластические св-ва дисп.Систем.Ур-ие Ньютона.
- •18/2.Кинетика коагуляции.Ур-ие Смолуховского.
- •18/3.Задачи кол.Химии в решении экологич.Проблем.На примере решения проблем водо-газоочистки.
- •19/1Суспензии,их полидисперсность.Стабилизация суспензий в водных и орг.Средах. Технич-ие суспензии и пасты мин.И орг.В-в.
- •19/2.Кинетика коагуляции эл-тами.Теории коагуляции эл-тами;химическая,длфо.
- •19/3.Правило фаз Гиббса и дисперсность.
- •20/1.Получение дисп.Сис-м.Методы диспергирования. Адсорбционное ↓ прочности (эффект Ребиндера).
- •20/3.Классификация мех-мов адсорбции(физ.Адсорбция,хемосорбция и ионообменная). Особенности составляющих сил Ван-дер-Ваальса при адсорбции.
- •21/1.Факторы устойчивости.Коагуляция типично гидрофоб.Коллоидов.Опишите осн. Факторы коагуляции без исп.Электролитов.
- •21/2.Адсорбция газов и паров на однород.Пов-ти.З-н Генри.Ур-ие мономолек.Адсорбции Ленгмюра и его анализ.Опред-ие констант в ур-ии Ленгмюра.
- •2 1/3.Для коагуляции 10-3 м3 золя Al(oh)3 требуется 10 мл р-ра Al2(so4)3 с конц-цией 0,01 кмоль/м3.Определите порог коагуляции.
- •22/1.Теория полимолекулярной адсорбции бэт,ур-ие изотермы адсорбции,его анализ.
- •22/2.Электрокинетические явления. Электрофорез. Потенциал и ток течения. Эффект седиментации.
- •22/3. Что такое частичная концентрация? Какие методы ее определения вы знаете?
- •23/1 Пористые тела. Колич. Хар-ки пористых материалов. Классификация пористых тел по Дубинину.
- •23/2Теории д.Э.С Гуи-Чэмпэна, Штерна. Представления Грэма.Электрокинетический потенциал.
- •24/1Особенности адсорбции на микропористых материалах. Потенциальная теория Поляни. Адсорбционный потенциал. Характеристическая кривая адсорбции.
- •24/2 Что такое электрокинетический потенциал? Какие факторы определяют величину этого потенциала?
- •26/1 Возникновение объёмно-пористых стр-р. Структурообразование по теории длфо. Коагуляционно- тиксотропные и конденсационно- кристаллизационные стр-ры.
- •27/1.Ньютоновские и неньютоновские жидкости. Вязкость жидких агрегативно устойчивых дисперсных систем. Уравнение Бингама и Эйнштейна. Измерения вязкости с помощью вискозиметра.
- •27/2 Природные и синтетические вмс. Строение макромолекул и их св-ва. Набухание и растворение вмс. Степень и скрость набухания.
- •27/3 Расклинивающее давление и его составляющие
- •28/1Общие вопросы устойчивости дисперсных систем. Седиментационная и агрегативная устойчивость.
- •28/2 Адсорбция на границе раствор-газ. Поверхностное натяжение. Уравнение Гиббса и его анализ.
- •29/1 Классификация поверхностных явлений. Смачивание. Краевой угол смачивания. Уравнение Юнга.
- •29/2.Почему и в каких случаях лиофильные золи проявляют свойства растворов низкомолекулярных веществ и коллоидных систем?
- •29/3Адгезия, когезия, смачивание и растекание жидкости. Уравнение Дюпре для работы адгезии. Закон Юнга. Связь работы адгезии с краевым углом (уравнение Дюпре-Юнга).
- •30/1 Природные и синтетические вмс. Строение макромолекул и их свойства. Набухание и растворение вмс. Степень и скорость набухания.
- •30/3 Критическая концентрация мицеллобразования (ккм). Основные факторы, влияющие на ккм. Методы определения ккм.
- •1/1 Термодинамика растворения вмс. Влияние природы вмс и растворителя на состояние макромолекул в растворе. Ассоциаты молекул. Возможность микрогетерогенности в растворе вмс.
- •1/2 Капиллярные явления и их роль в природе и технологии. Уравнение капиллярной конденсации Кельвина.
- •2/1 Получение и важнейшие методы обнаружения дисперсных систем.
- •2/3 Факторы стабилизации в системах с твердой дисперсной средой. Высокопористые материалы, их классификация и специфические особенности.
- •3/1 Двойной электрический слой по теории Штерна, перезарядка поверхности. Строение мицеллы и дэс.
- •3/2Специфика свойств дисперсных систем. Классификация по дисперсности, агрегатному состоянию, структуре, межфазному взаимодействию.
- •3/3Броуновское движение и его молекулярно-кинетическая природа. Связь между средним сдвигом частиц и коэффициентом диффузии (закон Эйнштейна – Смолуховского).
- •4/1Особенности оптических свойств дисперсных систем. Уравнение Релея для светорассеяния и его анализ. Фиктивное поглощение света дисперсными системами и уравнение Ламберта-Бугера-Бера.
- •4/2Студни. Схема взаимосвязи процессов образования и распада структур в системе геля.
- •4/3Теории Поляни-Дубинина объемного заполнения микропор.
- •5/3Сравнительная характеристика физической и химической адсорбции. Уравнение Фрейндлиха. Изотерма адсорбции. Теплота адсорбции. Кинетика адсорбции.
- •6/1Растворы вмс. Получение и св-ва р-ров вмс. Изоэлектрическое состояние м-л вмс.
- •6/2Рассеяние света дисперсными системами. Анализ уравнения Рэлея.
- •6/3 Что такое структурная вязкость и как он меняется под нагрузкой.
- •7/1Модель двойного электрического слоя на пов-ти ч-цы золя (по Гельмгольцу-Гуи-Штерну). Поясните, как меняется потенциал в дэс. Электрокинетический потенциал.
- •8/1.Структурированные дисперсные системы. Классификация, методы получения и основные св-ва: тиксотропия, синерезис, релаксационные явления, гистерезис.
- •8/2. Диффузия. Законы Фика для диффузии. Коэффициент диффузии.
- •8/3. Напишите формулу мицеллы золя на основе агрегата PbO2 c отрицательным зарядом мицеллы. Поясните роль адсорбционных процессов в образовании мицеллы.
- •9/1 Белки. Физико-химические свойства растворов белков. Строение пленок белков на межфазной поверхности.
- •9/2.Механизмы возникновения заряда на частицах дисперсной фазы. Строение дэс по Штерну-Гельмгольцу-Гуи.
- •88. Ассоциирование органических молекул в растворах.
- •31/2. Гели. Получение и свойства. Механизм и кинетика набухания.
- •36.Седиментационно-диффузное равновесие в золях. Условие этого равновесия.
- •11/3Структурно – механические св-ва дисперсных систем. Понятие о деформациях, прочности, пластичности
13/2. Молекулярные коллоиды. Строение и свойства. Взаимодействие с растворителем.
Молекулярными коллоидами являются ВМС. Высокомолекулярные соединения - это природные и синтетические вещества, образованные из цепных макромолекул, масса которых составляет десятки и сотни тысяч единиц. Строение. Молекулы ВМС построены из звеньев атомов (мономеров), соединенных ковалентными связями. Внутри цепи отдельные звенья могут свободно вращаться вокруг оси одинарной связи С-С, образуя различные конформации молекул.
С учетом расположения в макромолекуле атомов и атомных групп различают: линейные, разветвленные и сетчатые молекулы ВМС. Молекулы ВМС легко взаимодействуют, новые макромолекулы образуются за счет различных по природе связей: кова-лентных, ионных, водородных и других типов связей между радикалами. Длинные цепи высокополимеров рассматривают как гибкие образования, способные под влиянием различных факторов существенно менять свою форму. Макромолекулы ВМС не являются жесткими образованиями. Отдельные части молекул способны под влиянием теплового движения менять свое положение. Это приводит к изменению конфигурации цепи, гибкости, эластичности5 и формы молекул ВМС. В массе полимера цепи макромолекул располагаются беспорядочно, образуя многочисленные переплетения. Только в некоторых случаях происходит упорядочивание отдельных участков полимера и образование неких «пачек», содержащих то или иное количество упорядоченных цепей. Поэтому ВМС относят к амфотерным веществам.
Важнейшими специфическими физико-химическими свойствами ВМС можно считать способность:1) к значительным обратимым, высокоэластичным деформациям; 2)к образованию высокопрочных анизотропных волокон и пленок; 3)к набуханию и образованию высоковязких растворов.В немалой степени свойства полимера зависят от взаимного расположения звеньев в молекуле, т.е. от ее конфигурации. Конфигурацией, в частности, определяется способность полимера к кристаллизации, его эластичные свойства. Взаимод. с раств-лем. Растворение ВМС идет самопроизвольно и по сути является неограниченным набуханием. Первая стадия набухания характеризуется самопроизвольным увеличением объема и массы растворяемого образца за счет поглощения низкомолекулярной жидкости. Причина набухания - односторонняя диффузия молекул растворителя внутрь образца ВМС. В основе диффузии лежит стремление системы минимизировать свободную энергию за счет выравнивания концентраций и химических потенциалов компонентов. Высокая скорость диффузии обеспечивается большой разницей размеров молекул растворяемого вещества и растворителя и неплотной упаковкой макромолекул ВМС.При набухании объем образца полимера всегда увеличивается, а объем всей системы уменьшается. Уменьшение объема системы (полимер + растворитель) при набухании называется контракция. Контракция объясняется ориентацией молекул низкомолекулярного растворителя внутри полимера.
13/3. Раствор 1г белка гемоглобина в 1л воды имеет осмотическое давление 36,5 Па при 25ºС. Определите молекулярную массу и массу частицы гемоглобина. Примите, что осмотическое давление обусловлено только частицами белка.
Дано:m=1г,V=1л,π=36.5, Т=25+273=298К. Решение: на основе формулы Вант-Гоффа: πV = nRT,
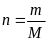 ,
,
 ,
тогда молекулярная масса :
,
тогда молекулярная масса :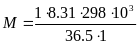 =67846
г/моль, количество частиц гемоглобина:
=67846
г/моль, количество частиц гемоглобина:
 ,
,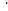
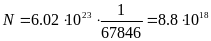 частиц,
и тогда масса одной частицы равна
частиц,
и тогда масса одной частицы равна
 г
г
Ответ: М=67846г/моль, mч=1.12 10-19г
