
1. Рецепторныи аппарат боли
Общепринятым является мнение, что воспринимают болевое воздействие на организм свободные нервные окончания, которых особенно много в коже. Однако многие исследователи полагают, что боль возникает также при раздражении любых рецепторов, в том числе холодовых, тепловых, тактильных и других, если действующий фактор достигает силы, способной вызвать повреждение тканей. Распределение болевых рецепторов неодинаково. Большое количество их и высокая болевая чувствительность обнаруживаются в коже, мозговых оболочках, плевре, брюшине, синовиальных оболочках, надкостнице, слизистой глаза, внутреннего уха, наружных половых органов. В коже на 1 см2 поверхности обнаруживается от 100 до 200 болевых точек. На кончике носа, поверхности уха, подошвах и ладонях их количество снижается, оно колеблется от 40 до 70. Причем количество болевых рецепторов значительно выше, чем рецепторов холода, тепла, прикосновения (Г Н Кассиль, 1969). Кости, ткани мозга не реагируют на повреждение — укол, разрез, размозжение, потому что болевых рецепторов в них нет.
Болевые рецепторы классифицируются по механизму, характеру их активации, локализации и по их роли в контроле целостности ткани. По характеру активации нейрофизиологи выделяют 3 класса болевых рецепторов (Ю. П. Лиманский, 1986):
1. Мономодальные механические ноцицепторы;
2. Бимодальные механические и термические ноцицепторы;
3. Полимодальные ноцицепторы.
Первая группа ноцицепторов активизируется только сильными механическими стимулами в 5—1000 раз большей интенсивности, чем необходимо для активации механорецепторов. Причем, в коже эти рецепторы связаны с А-дельта волокнами, а в подкожной клетчатке — с С-волокнами.
Вторая группа рецепторов — бимодальных — реагирует одновременно на механические (сжатие, укол, сдавление кожи) и температурные воздействия (повышение температуры свыше 40°С и ее снижение ниже 10°С). Механически и температурой раздражаемые рецепторы связаны с миелиновыми А-дельта волокнами. Рецепторы, связанные с С-волокнами, также возбуждаются механическими и холодовыми факторами. Полимодальные болевые рецепторы связаны преимущественно только с С-волокнами и возбуждаются механическими, температурными и химическими раздражителями. По механизму возбуждения болевые рецепторы разделяются на ме-хано- и хемонорецепторы (Л. В. Калюжный, 1984). Причем, основная масса механорецепторов связана с А-дельта волокнами и находится в коже и суставных сумках, мышцах; хемонорецепторы свя-
ю
заны только с С-волокнами Они в основном находятся в коже и мышцах и реагируют как на механические, так и термические факторы.
Все болевые рецепторы сигнализируют об опасности раздражи теля для организма и его силе, а не о характере (механический, термический, химический и др.) Поэтому некоторые авторы (Л. В. Калюжный, Е В Голанов, 1980) делят болевые рецепторы в зависимости от локализации рецепторов, сигнализирующих о повреждении отдельных частей тела, при этом выделяя:
1. Ноцицепторы, контролирующие покровы тела—кожу и сли-' |1стые;
2. Ноцицепторы, контролирующие целостность тканей, гомеоста-за; они расположены в органах, оболочках, в том числе кровенос ных сосудов, и реагируют на нарушение метаболизма, растяжение, дефицит кислорода.
Ноцицепторы обладают рядом важных свойств, таких как возбудимость, сенсибилизация, отсутствие адаптации. Как уже говорилось, болевые рецепторы относятся к высокопороговым образованиям, т. е их возбуждение возникает при действии раздражи телей большой силы, способной вызвать повреждение тканей и органов. Надо отметить, что порог возбуждения ноцицепторов, хотя и является высоким, все же достаточно изменчив, так как у человека зависит от наследственно обусловленных особенностей, в том числе свойств личности, эмоционального и соматического состояния, влияния погодных и климатических условий, действия предшествующих факторов и т д. Например, предварительное прогревание кожи повышает чувствительность ноцицепторов к тепловым воздействиям.
Особенно высокий порог возбуждения характерен для болевых рецепторов внутренних органов Вероятно, поэтому боль в них не возникает при уколе, разрезе, а появляется только при растяжении. Механизм возбуждения рецепторов сложен и заключается в том, что алгогенные факторы повышают проницаемость их мембран и вход натрия с развитием процесса деполяризации, следствием которого и является возникновение болевого импульса При определенных условиях происходит прогрессирующее понижение порога возбуждения ноцицепторов по мере действия болевого раздражите ля. Эта гиперчувствительность рецепторов получила название ги-пералгезии.
Гипералгезия может быть первичной, связанной с повышением чувствительности болевых рецепторов в поврежденном участке, или же вторичной, если облегчается чувствительная передача (Р. Рп-1Ьу1 Ка], 1986), например вследствие повреждения спинного мозга, таламуса или зоны, примыкающей к участку повреждения (рис 2)
Принято считать, что в раздражении рецепторов и моделиро-
2*
||
вании боли важная роль принадлежит ряду алгогенных веществ типа гистамина, серотонина, брадикинина, образующихся в участке повреждения Это подтверждается тем, что при введении в кожу
Рис 2 Первичная гипералгезия

перфузатов участков повреждения, содержащих указанные вещества, появляется боль, в то время как перфузаты неповрежденной кожи болевыми воздействиями не обладают Важнейшей особенностью болевых рецепторов является, как уже говорилось, практически отсутствие их адаптации к алгогенам.
2. Проводниковые и центральные болевые образования
В формировании болевой чувствительности принимают участие три нейрона Первый нейрон находится в спинно-мозговом узле, второй—в задних рогах спинного мозга и третий — в зрительном бугре. В целом в передаче болевых импульсов и формировании боли принимают участие нервные проводники, подкорковые образования и кора мозга Известно, что соматический нерв состоит из миелинизированных (их в 3—4 раза больше) и немиелинизированных волокон. Миелинцзированные (толстые) волокна относятся к группе А, а немиелинизированные — к груп-
12
пе С Волокна группы А подразделяются на альфа, бета, гамма, дельта, и основной их особенностью является быстрое проведение импульсов преимущественно тактильной и глубокой чувствительности, в то время как С-волокна являются медленнопроводящими.
По современным представлениям, болевые импульсы поступают только по тонким миелинизированным (А-дельта) и немиелинизиро-ванным С-волокнам к клеткам I—VI пластин дорзального рога (серое вещество спинного мозга) (рис. 3)
Рис 3 Структуры области дорзального рога, вовлекаемые в передачу боли Римскими циф рами обозначены пластины серо го вещества спинного мозга (М ВеЬЬепагн, 1986)

В них имеются клетки размером от 5 до 25 мкм. Доказательством участия А-дельта и С-волокон в проведении болевых импульсов является их возбуждение только в случае повреждения кожи (Р. Мельзак, 1981), хотя при более сильном повреждении в проведение импульса вовлекаются и другие волокна. Различается и скорость проведения импульсов Для А-дельта волокон она колеблется от 4 до 30 м/с, и потому они относятся к быстропроводящим, а для С-волокон — от 0,4 до 2 м/с, и они относятся к медленно проводящим нервным волокнам. Установлено, что импульсы, проходящие по А-дельта волокнам, осуществляют формирование первичной или острой локализованной боли, в то время как по С-волок-
13
нам проходят импульсы, способствующие формированию вторичной или плохо локализованной, ноющей, жгучей и длительной боли. Конечно, как мы увидим позже, характер боли определяется не только проведением импульсов нервными волокнами, но и, в первую очередь, центральными образованиями мозга. Исследованиями (М. ВепЬеНат. 1986) показано, что у больных при активации А-дельта волокон возникает ощущение боли. Если сила стимула возрастает и возбуждаются А-дельта и С-волокна, то также возникает ощущение боли. Если анестетиком блокировать передачу только по С-волокнам, тот же самый стимул вызовет ощущение прикосновения или пульсации. Если блокируются А-дельта волокна, то раздражение нервного пучка вызывает боль. Установлено, что основная масса афферентных импульсов поступает по задним корешкам спинного мозга и по чувствительным черепным нервам. Причем, в заднем корешке количество немиелинизированных афферен-тов в 2 раза больше, чем миелинизированных. Около 20—30% болевых волокон входят в спинной мозг через передний корешок и позже сливаются с другими афферентными системами. Большинство этих афферентов являются также немиелинизированными. Часть С-волокон проводят эффекторные симпатические импульсы, принимающие участие в вегетативных проявлениях боли (В. Н. Шток, 1988; V/. О. \УП115, 1985). В задних корешках и спинном мозге тонкие миелинизированные А-дельта и немиелинизированные С-волокна расположены латеральное волокон с большим диаметром. Тонкие миелинизированные волокна заканчиваются в I, III и нижней части II пластинки заднего рога, а С-волокна во II. частично в V пластинке (рис. 3, 4). Неболевые афференты входят более меди-ально, достигая III, IV пластин и ниже.
Химическая передача боли в заднем роге регулируется такими нейропептидами, как субстанция Р, соматостатин. Причем, истощение субстанции Р введением капсаицина уменьшает реакцию животных на болевые стимулы.
Врожденный или вследствие нейропатии дефицит вещества Р в задних рогах спинного мозга человека понижает его чувствительность к боли (К. Мас1е\у1сг, В. Запйгелу, 1985). Первичные болевые волокна, идущие от головы, заканчиваются в ядре мозгового пути тройничного нерва и в основании задних рогов серого вещества спинного мозга (В. Н. Шток, 1988).
Как уже говорилось, в спинном мозге выделяют 9 слоев или пластин (рис. 3, 4). Они включают I маргинальную пластину; II— III пластины составляют желатинозную субстанцию; IV—VI — собственное ядро; VII VIII—промежуточное ядро; IX—двигательную часть с моторными клетками переднего рога спинного мозга. Детальная характеристика строения и функций отдельных пластин спинного мозга дана в монографиях последнего времени
14
(Ю. П. Лиманский, 1986; В. Н. Шток, 1988; К. Мас{е\у1сг, В. Запй-ге\у, 1985; М. ВепЬепат, 1986). Миелинизированные А-дельта волокна заканчиваются в I—III пластинах, причем на уровне жела-тинозной субстанции имеются так называемые крадущиеся клетки, которые обеспечивают связь с нейронами всех пластин, и островко-вые клетки, которые направляют аксон к пресинаптическим образованиям первичных болевых афферентов; им придают большое значение в торможении передачи болевых импульсов.
Рис. 4. Распределение первичных афферентов на пластинках дор-зального рога. (К. Мас1е-\у1сг, В. 5ап(1ге\у, 1985)

Следует также отметить, что тактильные, низкопороговые миелинизированные волокна большого диаметра заканчиваются на уровне IV—V пластин дорзального рога и дают большее количество коллатералей желатинозной субстанции. Отсюда становится понятным эффект обезболивания при действии электрораздражения кожи, акупунктуре, механическом растирании. Эти импульсы, влияя на пре- и постсинаптические образования, тормозят выделение медиатора боли — субстанции Р и усиливают образование эндогенных опиатов, особенно энкефалинов. Это явление и положено в основу теории «воротного контроля» боли Р. Мельзака и П. Уолла, предложенной ими в 1965 г. Благодаря связи афферентов с нейронами IX пластины — моторными клетками переднего рога, на уровне спинного мозга (сегментарный уровень) возможно формирование двигательной реакции на первичную локализованную боль. Она заключается в непроизвольном одергивании или вздрагивании в результате фазического мышечного сокращения.
Далее при формировании вторичной нелокализованной боли воз-
15
никаег тоническое напряжение гладкой мускулатуры, ее спазм, а в месте повреждения образуются биологические вещества, в том числе обладающие алгогенными свойствами Поэтому при вторичной боли в месте повреждения кроме тонического напряжения по-перечно полосатой мускулатуры обнаруживается спазм сосудов, отек, повышение чувствительности болевых рецепторов
От спинно-мозгового ядра тройничного нерва и задних рогов спинного мозга берут начало неотригемино- и спинно таламиче-ские пуи На рис 5 представлены афферентные пути, передающие болевую информацию в головной мозг. Причем волокна второго нейрона в спинном мозге поднимаются по той же стороне на 1 2 сегмента и переходят на противоположную сторону, образуя спинно таламический путь, в составе бокового канатика белого вещества спинного мозга и в его передних отделах поднимаются до продолговатого и далее до ствола мозга
Ноцицептивная информация, поступившая в задние рога спинного мозга, попадает в мозг по восходящим ноцицептивным путям (спинно таламический тракт), которые проходят в антеролатераль-ном (переднебоковом) квадранте спинного мозга (рис 6)
В проведении боли важнейшее значение принадлежит спинно-таламическому тракту, который состоит из неоспинно- и палео спинно таламического путей Первый его нейрон находится в спинномозговом узле Его аксоны, соединенные со свободными нервными окончаниями, проходят в задние рога спинного мозга по задним спинно мозговым корешкам. В заднем роге серого вещества спинного мозга находится второй нейрон, аксоны которого начинаются от I V пластин заднего рога и многие переходят на противоположную сторону спинного мозга Передний (вентральный) канатик белого вещества спинного мозга, смещаясь более латерально восходящими волокнами этого пути, заканчивается в ядрах ствола и зрительного бугра
Считают, что более половины волокон спинно-таламического тракта не достигает таламуса Он частично заканчивается в кау-дальной части ствола мозга, в основном в области гигантоклеточ-ного ядра Сюда стекается информация от конечностей тела, световая, звуковая Эта область важна не столько для дискриминационной чувствительности, сколько для изменения чувствительности к ноцицепгивному раздражителю Повреждение гигантоклеточного ядра ослабляет реакцию животных на боль, а его стимуляция — усиливает Кроме того, спинно-таламический путь отдает волокна, которые заканчиваются в среднем мозге, особенно в клиновидном ядре и центральном сером околоводопроводном веществе Этот проводящий путь берет начало от I и V пластин заднего рога (К Мас1е\ук.7 В 5апаге\у, 1985)
Специальные исследования (метод антидромного тестирования,
(6
введение меченой лошадиной пероксидазы и др.) (\У ^ ШИНз, 1965), посвященные изучению распределения клеток, дающих в спинном мозге начало второму болевому нейрону, показали, что это зависит не только от вида животных, уровня спинного мозга, но и от зоны проекции в таламусе. Большинство клеток спинно-та-

Рис 5 Некоторые афферентные пути и системы, передающие болевую информацию в головной мозг
&1, §[|—соматосенсорная, МОТ—соматомоторная,
АС ассоциативные области коры, ЬР§,
УРь, М1Т, РОН — ядра таламуса, а
лемнисковая, б — спинно таламическая,
в — мультисинаптическая 1 — кора
большого мозга, 2 тала-мус, 3 — ретикулярная
формация, 4 продолговатый мозг, 5 —
латеральное шей ное ядро, 6 спинной
мозг, 7 — дорзолатеральный путь, 8
медиальный лемниск, 9 дорзальное шейное
ядро, 10 дорзальный столб, 11 палеоспинно
таламический путь, 12 — неоспинно
таламическич, 13 — мультдйдиввцийский,
14 спин но ретикулярный путь (Ю П
Лиманский, 1986) ^^^>V[Б^^'•. ^"•ч
—————————————
——————————————————————ж——у-<—г—'*•'-"
}1л \
^'———————
17

Рис 6 Схема поперечного среза спинного мозга
I IX — пластины серого вещест ва Слева передний или вентраль ныи (внизу) и задний или дорзальныи •(вверху) корешки 1 — вентральный, 2 дорзальный корешок, 3 — лате ральный, 4 — вентральный спинно таламический путь (Ю П Лиман ский, 1986)
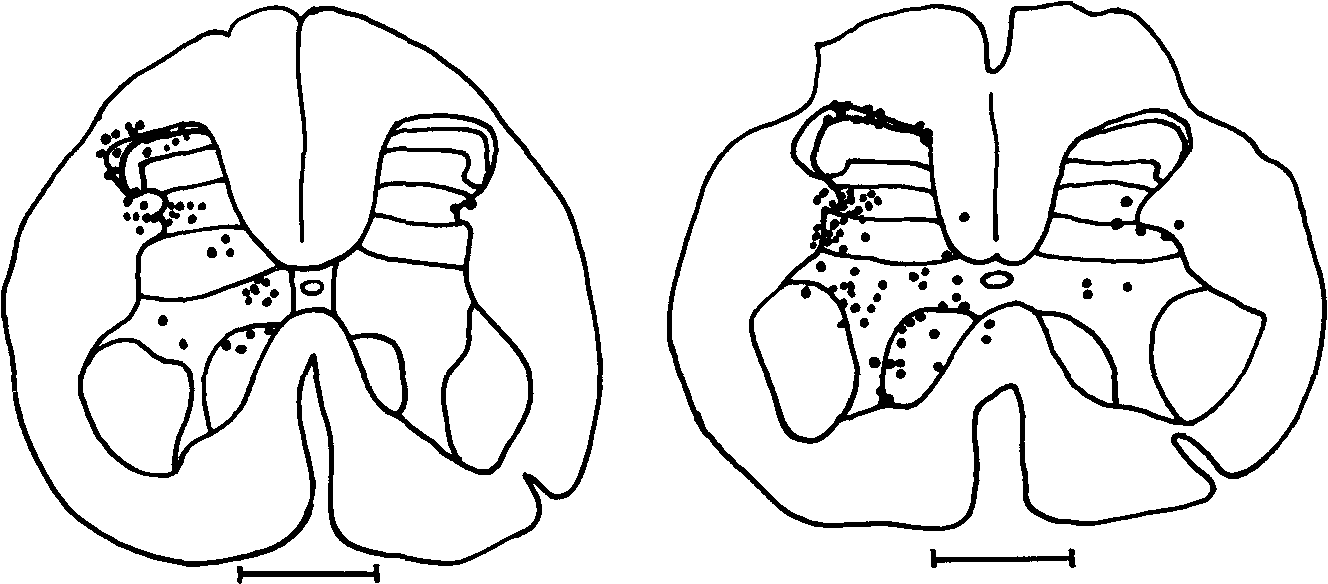
ламического пути проецируется в контрлатеральный таламус. Специальные концентрации ипсилатерально проецирующихся клеток спинно-таламического тракта найдены в верхних отделах шейных сегментов и в крестцовом отделе спинного мозга (рис. 7). Большинство нейронов спинно-ретикулярного тракта находится в VII и VIII пластинах заднего рога, в то время как спинно-таламиче ские и спинно-мезэнцефалические нейроны концентрируются в I и V пластинах, а спинно-цервикальный тракт в III, IV и V.
1мм
1ММ
Рис. 7 Локализация клеток спинно-таламического пути, меченных лошадиной пероксидазой, транспортируемой ретроградно из латерального таламуса (А) или медиального таламуса (В) к пояснично-крестцовым отделам у обезьян (\У О \У|11|5, 1985)
18
Спинно-таламический тракт заканчивается в трех областях таламуса — вентропостеролатеральном ядре, задней группе ядер и медиальных таламических ядрах, играющих различную функциональную роль в чувствительности. В вентропостеромедиальном ядре заканчиваются также нейроны от ядер тройничного нерва. В целом вентропостеролатеральные и вентропостеромедиальные ядра таламуса составляют так называемое вентробазальное ядро или вентробазальный комплекс, которому принадлежит важная роль в проведении болевых импульсов. Причем нейронное представительство туловища находится в вентропостеролатеральном, а лица — в вентропостеромедиальном ядре таламуса.
Спинно-таламические афференты разделяются на неоспинно-та-ламический и палеоспинно-таламический тракты. Неоспинно-тала-мический тракт является филогенетически молодым, лежит в латеральных отделах спинного мозга (рис. 8). Нервные волокна этого
.5. КОРА МОЗГА
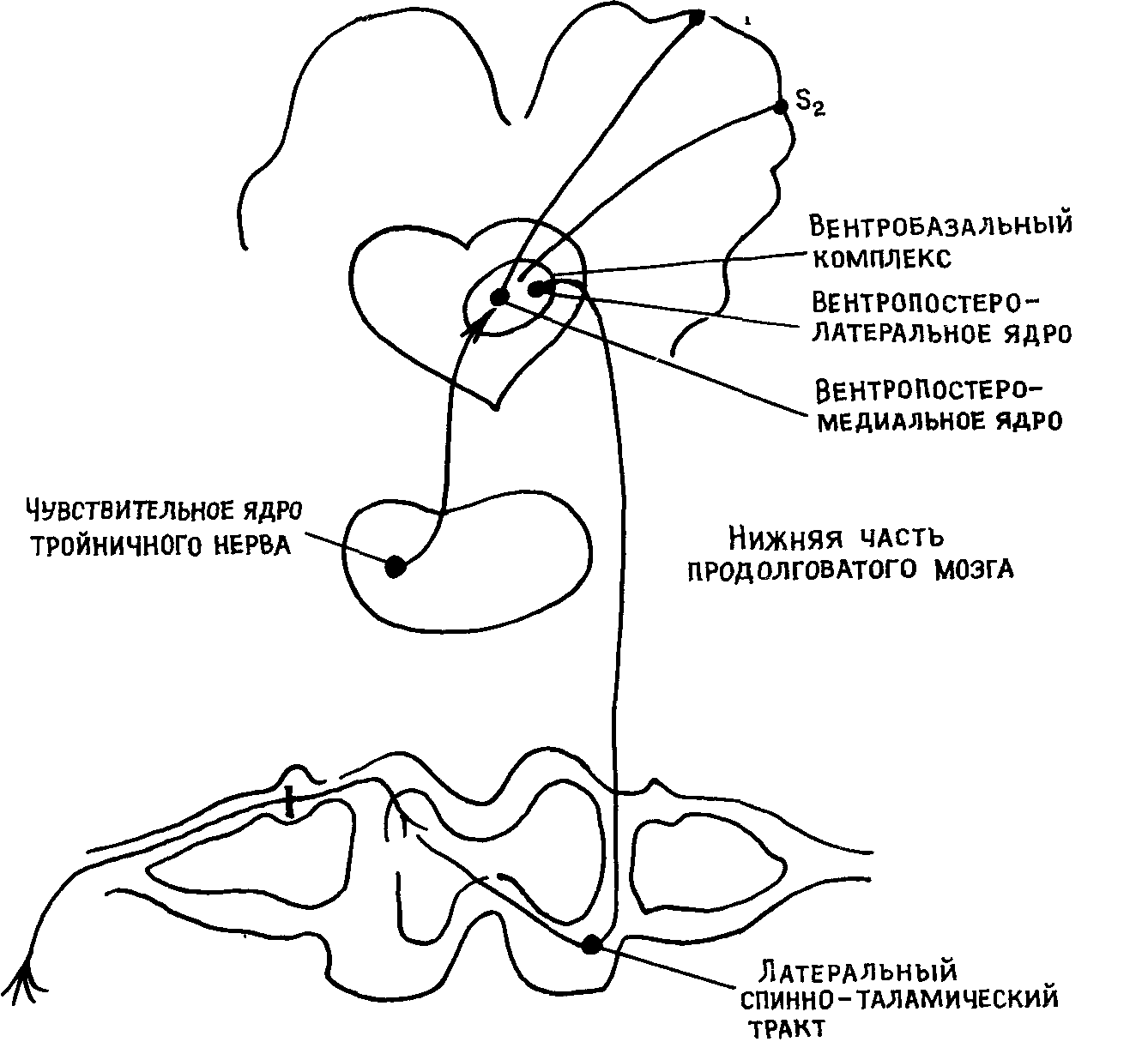
Рис. 8 Неоспинно таламический тракт
19
пути поступают в вентропостеролатеральное ядро таламуса, которое тесно связано с первой (б)) и второй (§а) соматосенсорными зонами коры. Спинно-таламические афференты перекрывают в вен-тропостеролатеральном ядре терминальное поле лемнисковой системы, с участием которой осуществляется передача основной массы импульсов тактильной и глубокой чувствительности Полагают, что благодаря слиянию в этой области таламуса болевой, тактильной, суставной и мышечной чувствительной афферентации в облас ти вентропостеролатерального ядра формируется дискриминационная болевая чувствительность, т е определяется локализация но цицептивного раздражителя Это подтверждается тем, что при по вреждении вентропостеролатерального ядра происходит нарушение дискриминационной чувствительности и одновременно наблюдается кратковременная аналгезия. Электрическая стимуляция этой зоны вызывает аналгезию и локальные парастезии
Палеоспинно-таламический путь (рис 9) более старый, лежит в медиальной части ствола, связан с нейронами центрального се рого околоводопроводного вещества таламуса и лимбическими образованиями ретикулярной формации, гипоталамусом, медиальными и интраламинарными группами таламуса (задняя группа ядер тала муса), а также через ретикулярную формацию различными зонами коры. Задняя группа ядер и ядра медиального таламуса также получают информацию по лемнисковым путям о тактильной и глубокой чувствительности, но в значительно меньшем объеме, чем вентропостеролатеральное ядро Причем, именно нейронам задней группы ядер таламуса и медиального таламуса принадлежит важная роль в генерализованной информации заднего участка мозга Этот путь принимает участие в передаче информации и формиро вании ощущения тупой локализованной боли с обязательным участием надсегментарной реакции со стороны эндокринной, сердечнососудистой системы, дыхания, мотиваций и защитной реакции Таким образом, спинно-таламический тракт, достигая вентробазаль-ных ядер таламуса, образует специфическую систему боли и интра ламинарных и задних ядер таламуса, образует неспецифическую ее систему.
Имеются сведения, что повреждение заднего таламуса у чело века и животных уменьшает болевую чувствительность, в то время как электрическая стимуляция его вызывает ощущение жгучей боли (К Мас1е\у1сг, В 5апаге\у, 1985)
В клинике повреждение таламуса сопровождается развитием нарастающих с наступлением сна центральных или таламических болей, крайне мучительных, с ощущением жжения в дистальных отделах руки, половине лица, ноге (В В Михеев, П В Мельни-чук, 1981). То, что эти боли нивелируются назначением седуксена, говорит о нарушении роли фильтра импульсов как в регикулярной
20

Рис 9 Палеоспинно таламический тракт
формации, так и в самом таламусе.
Важное значение в формировании боли принадлежит лимбиче-ским образованиям и переднему отделу коры. В настоящее время лимбическую систему мозга связывают с вегетативным обеспечением эмоциональных и поведенческих аспектов. Причем, по данным П. В Симонова (1989), гипоталамус является исполнительным центром в формировании эмоций, а такие лимбические образования, как перегородка, гиппокамп, миндалина, оказывают модулирующее влияние По мнению П. В. Симонова, в прогнозировании биологической значимости сигнала для организма основное значе-
21
ние принадлежит переднему отделу новой коры и гиппокампу. Полагают, что передняя кора ориентируется на сигналы высоковероят-ных событий, а гиппокамп — на сигналы маловероятных событий. В то же время миндалина не принимает участия в прогнозировании вероятности события и выполняет важнейшую мотивационную функцию При ее разрушении животное не может выбрать мотивацион-ный стимул: ни пища, ни болевой стимул не могут стать доминантными в его поведении (П. В. Симонов, 1989), здесь важная роль принадлежит состоянию дофаминергической системы.
Если учесть, что лимбическая кора связана с ассоциативными зонами коры большого мозга, то при психогенном стрессе это является причиной нарушения регуляции механизмов гомеостаза (И. П Чебаевская, В. А. Лебедев, 1987).
Лимбические образования переднего мозга ответственны за формирование эмоций, и ослабление или полное исключение боли должно привести к уменьшению или исключению эмоциональных аспектов боли (психического возбуждения, ярости, гнева, страха, агрессии).
По данным К. Мас1е\у1сг, В. §апс1ге\у (1985), в медиальном таламусе обнаружено обилие опиатных и энкефалиновых рецепторов, и поэтому морфин или его аналоги связываются с теми отделами, которые включают эмоциональные компоненты восприятия боли. На эту же систему действуют и антидепрессанты. При перерезке болевых путей, соединяющих таламус с лимбическими образованиями (лейкотомия), интенсивность боли не уменьшается, а изменяется отношение к ней больного вследствие исключения эмоциональных аспектов боли. Боль переносится сравнительно легко, ибо боль становится безразличной, как бы далекой. Имеется и ряд других путей передачи болевой информации, особенно слаболокализованной, тупой боли, в частности, мультисинаптическая афферентная система, основу которой составляют короткие нейронные связи.
Учитывая, что в спинном мозге имеется много межсегментар-ных и перекрестных волокон, полное исключение боли можно наблюдать только после полной его перерезки Третий нейрон идет от зрительного бугра через заднюю ножку внутренней капсулы к задней центральной извилине, где находится первая соматосенсорная зона (5|), и к верхней стенке боковой борозды, где локализована вторая соматосенсорная зона (5,,). Они имеют тесную связь с вентробазальным комплексом.
Экспериментальные исследования показывают, что удаление §, приводит к увеличению порога болевой чувствительности на противоположной стороне, а разрушение §ц снижает болевой порог на контрлатеральной стороне.
В. К. Решетняк, М. Л. Кукушкин (1986) полагают, что сомато-
22
сенсорная зона коры (§[) выполняет тонкий дискриминационный анализ соматической чувствительности и ответственна за восприятие и формирование ощущений, связанных с первичной эпикрити-ческой болью, область же Зц отвечает за первичный ситуационный анализ, определяет степень ответной реакции при ноцицептивном раздражении, оценивая при этом ее интенсивность и контролируя вход ноцицептивных сигналов путем модулирующего влияния на активность АНЦ. Согласно более ранним данным зарубежных ученых, зона §„ принимает участие в регуляции двигательного акта на боль, а §| — в восприятии боли.
Медиаторы боли
В первичных болевых афферентах обнаружены 11-й аминокислотный пептид (субстанция Р), холецистокинин, вазоактив-ный интестинальный полипептид.
Важнейшим медиатором боли является субстанция Р. Субстанция Р (от англ. Рат — боль) обнаружена в задних рогах спинного мозга, стволе, преоптической области гипоталамуса и в небольших количествах в коре головного мозга, т. е. на всех участках релейной передачи болевых импульсов. Обстоятельные исследования содержания субстанции Р в спинном мозге и ее изменения при патологии проведены Т. Ь. Уакзп а1 а11 (1984). Производя перерезки различного уровня, авторы наблюдали изменения содержания субстанции Р в различных структурах нервной системы (табл. 2, рис. 10)
Таблица 2
Уровни субстанции Р в спинном мозге, по сравнению с неповрежденной стороной при ризотомии и половинной перерезке мозга, в % (1984)
|
|
|
Количество |
Дорзаль-• ын рог |
Вентральный рог |
Задний спинномозговой |
|
|
|
|
|
|
ганглии |
Дорзальная |
ризотомия |
|
4 |
44* |
95 |
278* |
Вентральная |
ризотомия |
|
4 |
78* |
91 |
122 |
Половинная (Ш.) |
перерезка |
мозга |
4 |
б7* |
71* |
102 |
* Р 005
23

Рис 10 Поперечный срез спинного мозга участки повреждения и структуры, в которых исследовалась суб станция Р
1 — дорзальная ризото мия, 2 — вентральная ризо томия, 3 половинная пере резь I спинного мозга, 4 — задний рог, 5 — передний рог, 6 задний спинно мозговой ганглий
Из таблицы видно, что через 10—16 дней после дорзальной ри-зотомии резко уменьшается уровень субстанции Р в заднем роге и увеличивается в спинно-мозговом ганглии Авторы связывают это с блоком транспорта субстанции Р из ганглия в задний рог Причем, уменьшение отмечено главным образом в I, II и III пластинах В то же время ризотомия вентральная и половинная перерезка мозга, как видно из таблицы, дают менее выраженное уменьшение субстанции Р в заднем роге Это лишний раз, по мнению авторов, подтверждает зависимость уровня субстанции Р от афферентного притока В то же время уменьшение субстанции Р при половинной перерезке и вентральной ризотомии связано с тем, что часть немиелинизированных первичных афферентов (как мы уже говорили ранее) входит в передний рог, а при половинной перерезке мозга исключает нисходящие, стимулирующие образование субстанции Р преимущественно серотонинергические влияния.
Исследования показали, что субстанция Р содержится в си-наптосомальной фракции и везикулах и освобождается при деполяризации Более того, в эксперименте на кошках и крысах показано (Т Ь Уакзп а[ а11, 1984), что только интенсивное, а не тактильное раздражение способствует выделению субстанции Р Интересно, что введение пептида капсаицина, увеличивает выделение субстанции Р, таким образом истощая ее, и поэтому повышается болевой порог по отношению к термальным и химическим стимулам.
По данным \У О. ШШ15 (1985), Ь. Ьаза^па (1986), нейроны заднего рога возбуждают глютамат, субстанция Р, холецистокинин и нейротензин, тогда как тормозящий эффект оказывают ГАМК, серотонин, норадреналин, дофамин, энкефалин, соматостатин, холецистокинин и ацетилхолин
Считают также, что такие вещества, как гистамин, серотонин, ацетилхолин, простагландины, принимают участие в медиации боли, поскольку вызывают возбуждение ноцицепторов и формирование боли. Субстанция Р является возбуждающим передатчиком. Бло-
24
када ее образования, а следовательно, и передачи болевой информации происходит под действием энкефалина, морфина и морфинопо-добных веществ, эндогенных опиатов, что, вероятно, связано с влиянием на пресинаптическую мембрану Не исключено их постсинап тическое действие
В первичных афферентах (В. Н Шток, 1988) блокада проведения болевых импульсов осуществляется холецистокинином, нейро-тензином, ГАМК, глицином, а также норадреналином и серотони-ном. Причем, ГАМК и глицин оказывают ингибиторный трансмит-терный эффект в дорзальном роге за счет пре- и постсинаптиче-ского действия
Лнтиноцицептивная система. Эндогенные механизмы регуляции болевой чувствительности
Хорошо известно, что регуляция различных функций в организме осуществляется системами, обладающими противополож
ными эффектами, благодаря чему и возможно поддержание функции на определенном уровне Так, регуляция уровня сахара обеспечивается взаимодействием между эффектами инсулина и контрин-сулярными гормонами, уровень кальция и фосфора — влиянием кальцитонина и паратгормона, поддержание крови в жидком состоянии — свертывающей и противосвертывающей системами и т д
До недавнего времени, говоря о боли, мы рассматривали ее в рамках функционирования сложной системы боли Только недавно было сформулировано учение об антиноцицептивной (противоболевой) системе (АНЦ) организма. Обращая внимание на исключительно большую ее роль в формировании болевого ощущения, можно сделать заключение, что до тех пор, пока антиноцицептивная система функционирует в достаточной мере, боль может не развиваться, даже при наличии повреждения. Появилось даже мнение, что возникновение боли обусловлено недостаточностью антиноцицептивной системы (Г. Н Крыжановский, 1973, 1974, 1979, Л В Ка-люжный, Е В Голанов, 1980, Р Зюи^агх. 1982. В Н Шток, 1988).
По мнению Л В Калюжного и Е В Голанова (1980), возникновение боли или, наоборот, включение антиноцицептивной системы определяется не характером действующего на организм раздражителя, а его биологической значимостью Следовательно, если АНЦ находится в состоянии постоянной активации, боль у чело века и животного на неопасное воздействие факторов внешней и внутренней среды не возникает В процессе эволюции животного
4 ).«к № 411
25
мира для выживания организма сформировались механизмы, обес печивающие возникновение боли только на опасный (т е биологически значимый для организма) раздражитель
Эти же авторы, анадшируя последовательность формирования антиноцицептивной системы, приходят к выводу, что в онтогенезе контроль болевой чувствительности начал осуществляться прежде всего гуморальными факторами, особенно опиатами, нервные же ме ханизмы регуляции боли появились на поздних этапах эволюции «Система околоводопроводное центральное серое вещество — ядро шва потребовала создания на уровне бульбарно мезэнцефаличе-ского отдела самостоятельного механизма контроля болевой чувствительности с помощью серотонина и катехоламинов, а с развитием эмоций появился гипоталамический уровень контроля болевой чувствительности» (Л В Калюжный, Е В Голанов, 1980) Развитие коры головного мозга способствовало формированию коркового уровня контроля болевой чувствительности, необходимого для условно-рефлекторной и поведенческой деятельности человека
Антиноцицептивная система имеет свое морфологическое строение, физиологические и биохимические механизмы Для нормального ее функционирования необходим постоянный приток афферент ной информации, при ее дефиците функция антиноцицептивной системы ослабляется Антиноцицептивная система формируется на различных уровнях ЦНС и представлена сегментарным и центральным уровнями контроля, а также гуморальными механизмами — опиоидной, моноаминергической (норадреналин, дофамин, серотонин), холин-ГАМК-ергическими системами
Учитывая, что в ходе изложения нам придется пользоваться такими терминами, как медиатор, нейротрансмиттер, модулятор, считаем необходимым дать их определение
Медиатор — это вещество естественного происхождения, обеспечивающее развитие процесса.
Нейротрансмиттер — это вещество, находящееся в пресинапти-ческой части, выделяющееся в синаптическую щель, взаимодействующее с синаптической мембраной и вызывающее возбуждение или торможение синапса
Нейромодулятор, как правило, пептидной природы также локализуется в пресинаптической части, выделяется в синаптическую щель, но через специфические рецепторы влияет на выделение и эффекты нейротрансмиттера Например, считают, что серотонин и дофамин для одних структур мозга выполняют нейротрансмиттер-ную, а для других нейромодуляторную роль (Е О Брагин, 1985)
Согласно современным данным, химические вещества участвуют в модуляции боли на уровне рецепторов, проведения импульсов в центральную нервную систему и нисходящего контроля интенсивности боли
26
1. Опиатные механизмы обезболивания
Впервые в 1973 г было установлено избирательное накопление веществ, выделенных из опия, например морфина или его аналогов, в определенных структурах мозга Эти образования получили название опиатных рецепторов Наибольшее их количество находится в отделах мозга, передающих ноцицептивную информацию В частности, наибольшее количество опиатных рецепторов сосредоточено в таких местах передачи болевой информации, как желатинозная субстанция задних рогов спинного мозга, ретикулярная формация, центральное серое околоводопроводное вещество, гипоталамус, лимбические структуры и кора мозга
Опиатные рецепторы обнаружены у живых существ, начиная от рыб и кончая человеком Показано, что опиатные рецепторы связываются с веществами типа морфина или его синтетическими аналогами, а также с аналогичными веществами, образующимися в самом организме
В настоящее время известна гетерогенность ряда рецепторов химических веществ—адренергических (а\, 02, (Зь ^2), дофами-нергических (Д| и Да), холинергических (М и Н), гистаминерги-ческих (Н| и 1-Ь)
В последние годы доказана неоднородность и опиатных рецепторов Уже сейчас выделили Мю , дельта-, каппа- сигма-опиат-ные рецепторы Причем, морфиноподобные опиаты соединяются с Мю-рецепторами, опиоидные пептиды — с дельта-рецепторами, анальгетики, производные бензоморфанов,— с каппа-рецепторами, фенилциклидин и 5КЕ 1047—с сигма-рецепторами (Ю Д. Игнатов, 1984, Т § 1еп§еп, 1986)
Ю Д Игнатовым установлено, что Мю-рецепторы (они подразделяются на Мю) и Мюг) локализованы в желатинозной субстанции спинного мозга, ядрах ствола мозга, гипоталамусе, тала-мусе, в IV слое соматосенсорной зоны коры
Дельта-рецепторов много в лимбических структурах, перего родке, гипоталамусе Здесь же, как правило, локализованы мет-и лей-энкефалины Каппа-рецепторы также являются гетерогенными, т к обнаружены уже К) и Кг изорецепторы Они содержатся в желатинозной субстанции спинного мозга, центральном сером околоводопроводном веществе, гипоталамусе, коре мозга
Анализируя |юль опиатных пептидов в регуляции гемодинами-ки, Ю Д Игнатов с соавт (1988) считают, что усиление симпатической активности и ноцицептивных вазомоторных рефлексов реализуется через дельта опиатные рецепторы разных уровней мозга Угнетение гипертензивных реакций опосредуется через Мю-опиат-ные рецепторы мозга Учитывая это, авторы предлагают осуществлять коррекцию сердечно-сосудистых реакций созданием и введе-
4*
27
нием антагонистов с избирательным Мю рецепторным действием или селективных антагонистов дельта-, каппа-опиатных рецепторов
Сигма-рецепторы обнаружены в гипоталамусе и коре мозга В различных структурах мозга количество опиатных рецепторов различается в 40 раз Очень много их содержится в миндалевидном теле, центральном сером околоводопроводном веществе, гипоталамусе, медиальном таламусе, стволе мозга (ядро солитарного тракта и тройнично-сенсорные ядра), I и III пластине задних рогов (Ю П Лиманский, 1986) По данным Е О Брагина (1985), для мозга характерна гетерогенность распределения опиатных рецепторов от минимальных концентраций в области первичных анализаторов (5, и 5ц — соматосенсорная зона коры, височная, затылочная) до максимальных во фронтальных и лимбических струк турах
Установлено (Л В Калюжный, 1984), что морфин по сравнению с энкефалинами в 100 раз лучше соединяется с Мю рецепторами, чем с сигма-рецепторами, в то время как соединение энке-фалинов с сигма-рецепторами происходит в 5—10 раз интенсивнее
Также выяснено, что в крови и спинно-мозговой жидкости человека и животных имеются вещества, обладающие способностью соединяться с опиатными рецепторами Они выделены из мозга животных, имеют структуру олигопептидов и получили название энке-фалинов (мет- и лей энкефалин) Из гипоталамуса и гипофиза были получены вещества с еще большей молекулярной массой, имеющие в своем составе молекулы энкефалина и названные большими эндорфинами Эти соединения образуются при расщеплении бета-липотропина, а учитывая, что он является гормоном гипофиза, можно объяснить гормональное происхождение эндогенных опиои-дов Бета-эндорфин в 18—33 раза активнее морфина, и при постоянном введении его крысам у них, как и у человека, возникает привыкание Энкефалины и эндорфины, образующиеся в организме, по лучили название эндогенных опиатов
Схематически процесс образования эндорфинов и энкефалинов представлен на рис 11 (А А Панин, А А Карелин, 1984)
Из других тканей получены вещества с опиатными свойствами и иной химической структурой — это лей-бета-эндорфин, киторфин, бета-козоморфин, динорфин, анодинин (Е О Брагин, 1985)
Эндогенные опиаты типа энкефалина и больших эндорфинов в наибольших концентрациях обнаружены в местах локализации опиатных рецепторов Обеспечение аналгезии является самым важным их свойством, и это подтверждается экспериментальным путем при введении их в мозг животных
По данным Е О Брагина (1985), энкефалины и большие эндорфины обнаружены в задних рогах спинного мозга, ядрах ретикулярной формации, центральном сером околоводопроводном вещест-
28

Рис 11 Образование энкефалинов и эндорфинов из бетта липотропина
ве, гипоталамусе, миндалине, стриопаллидарной системе Если говорить только о больших эндорфинах, то они содержатся в гипоталамусе, меньше их в перегородке, центральном околоводопроводном веществе мозга Экспериментальные исследования показывают, что при стрессе и болевом воздействии в мозге увеличивается количество эндогенных опиатов, а в крови — бета-эндорфина. Анализ распределения эндогенных опиатов свидетельствует о том, что энкефалины сосредоточены в основном в ЦНС, причем метионин-энкефалина здесь содержится в 5—10 раз больше, чем лейцин-энкефалина Наибольшая концентрация метионин-энкефалина обна руживается в бледном шаре, с постепенным уменьшением его в черной субстанции, гипоталамусе, скорлупе, центральном сером околоводопроводном веществе, хвостатом ядре (Л В. Калюжный, 1984) Различные области ЦНС имеют неодинаковую чувствительность к эндорфинам и энкефалинам Клетки головного мозга более чувствительны к энкефалинам, в то время как гипофиз в 40 раз чувствительнее к эндорфинам Обнаруженные в настоящее время суточные колебания опиоидных пептидов обусловливают, вероятно, суточные изменения порога болевой чувствительности человека. Опиатные рецепторы обратимо соединяются с наркотическими анал-гетиками, и последние могут быть вытеснены их антагонистами с восстановлением болевой чувствительности
Исследования показали, что кроме экзо- и эндогенных опиатов в регуляции болевой чувствительности важное значение принадлежит антагонисту опиатов — налаксону Искусственное введение налаксона на фоне обезболивания аналгезином не только восстанавливает болевую чувствительность, но и усиливает ее, т. к. этот препарат в дозе 0,1 мг/кг полностью блокирует Мю-опиатные
29
рецепторы Обнаружено преимущесгвенное сродство налаксона к Мю-рецепторам, оно в 10 раз меньше к сигма и в 30 раз к каппа-рецепторам По данным А. А Панина с соавт (1984), при применении общих анестетиков типа закиси азота, энфморана, циклопро-пана обнаружен частичный эффект налаксона по восстановлению болевой чувствительности, полному блокированию действия таких аналгетиков, как фенобарбитал, диазепам, пропанидид Анестезия, вызванная стрессом, не ус1раняется налаксоном даже при введении очень высоких доз (20 мг/кг)
Исследования последнего времени позволили выделить в зависимости от эффектов налаксона две разновидности аналгезии: на-лаксон-чувствительную, которая может быть получена в условиях длительных ноцицептивных раздражении, и налаксон-нечувстви-тельную, которая возникает при острых болевых воздействиях Различие эффектов налаксона объясняется включением разных меха низмов антиноцицепции, т. к. при длительных и перемежающихся ноцицептивных воздействиях включаются в первую очередь опиоид-ный и меньше адренергический механизмы При острых же болях первостепенное значение принадлежит адренергическому механизму, нежели опиоидному Кроме налаксона антагонистами опиоидов являются производные тропана, тропина, тропинона Они также ослабляют аналгетический эффект опиатов (В. В Закусов, В. М. Бу-лаев, 1980). Схематический механизм действия экзо- и эндогенных опиатов и их антагониста налаксона представлен на рис 12
Опиаты соединяются с рецепторами (А) и, так как имеют большие размеры, препятствуют соединению с ними нейротрансмитте-ра (субстанция Р). Налаксон (Б2) соединяется с рецепторами не полностью, что дает возможность соединиться нейротрансмит-теру с постсинаптической мембраной, и поэтому введение налаксона на фоне аналгезии восстанавливает болевую чувствительность.
Известно, что эндогенные опиаты обладают и пресинаптиче-ским действием. В результате этого уменьшается выделение дофа-мина, ацетилхолина и даже основного медиатора боли — субстанции Р, а также простагландинов
По мнению Ю. П. Лиманского (1986), опиаты вызывают угнетение в клетке функции аденилатциклазы, уменьшение образования цАМФ и, как следствие, торможение выделения медиаторов в синаптическую щель Этот процесс, по его мнению, может компен-саторно увеличивать активность ферментов, повышающих образование цАМФ, и таким образом способствовать появлению зависимости к опиатам
30
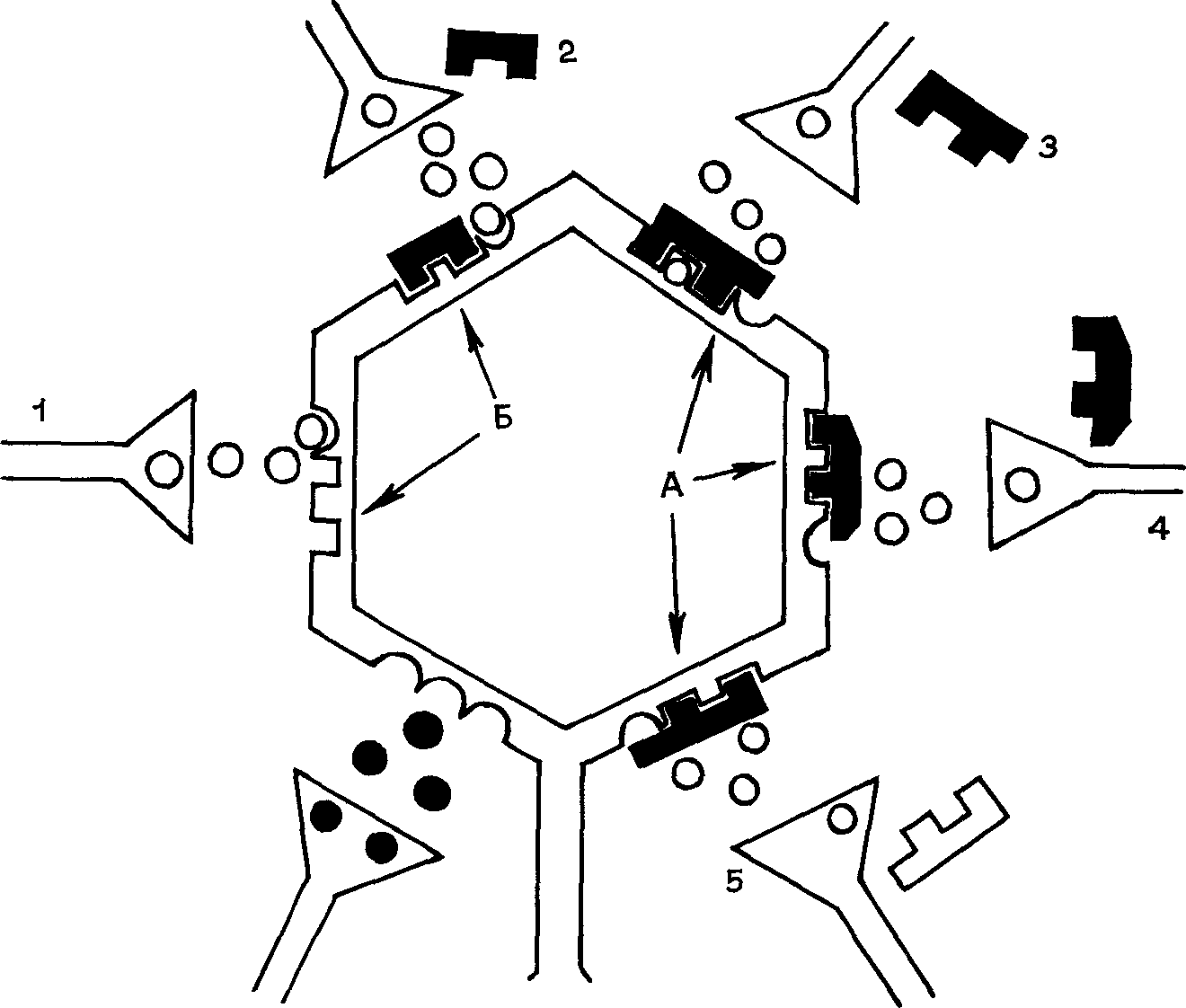
Рис 12 Схема действия опиата и его антагониста на нейрон в афферентной системе боли
1 — нейротрансмиттер, 2 — налаксон, 3 — энкефалин, 4 — морфин, 5 — эндор-фин
2. Лдренергические механизмы обезболивания
Известно, что норадреналин тормозит проведение ноцицептивных импульсов как на сегментарном (спинной мозг), так и стволовом уровнях. Этот эффект связывают с взаимодействием его с а-адренорецепторами, т. к. он не обнаруживается при предварительном введении альфа-адреноблокаторов, например фентоламина (Т. Ь. Уакап а1 а11, 1984), Причем альфа) и альфаа—адренорецепторы—существуют как постсинаптиче-ские образования. Опиатные и адренергические рецепторы в спинном мозге опосредуют реакции животных на сильные стимулы, т. е только определенные типы соматической стимуляции будут увеличивать выделение моноаминов и опиатных веществ из спин-
31
ного мозга В то же время на уровне ствола мозга обнаружена активация норадреналином тормозных нейронов, особенно гиган-токлеточного ядра, ядра большого шва, голубого пятна и мезэнце-фалической ретикулярной формации. При введении пропранолола (5 мг/к1) за счет его взаимодействия с бета-адренергическими рецепторами подавляются антиноцицептивные эффекты.
Норадренергические структуры мозга сосредоточены в латеральном отделе ствола и промежуточном мозге, особенно ими богата ретикулярная формация мозга. Часть их аксонов идет к коре мозга, а другая — к образованиям переднего мозга. Если активировать центральные адренергические структуры, формируется анал-гезия с подавлением эмоционально-поведенческих и гемодинамиче-ских проявлений боли Причем, адренергические механизмы супра-сегментарного уровня регулируют гемодинамические реакции с участием па-рецепторов, а сегментарного поведенческие проявления, реализуемые через сц-адренорецепторы. В регуляции гемодинами-ческих сдвигов при боли основное значение принадлежит не опио-идергическим структурам мозга, а адренергическим. По мнению А. А Зайцева (1986), сохранение на фоне опиатов реакции системы кровообращения на боль говорит о том, что резкие гемодинамические сдвиги при боли (в том числе и увеличение АД) включают болеутоляющие механизмы за счет прямого и барарецептор-ного влияния
При сильном болевом воздействии активируются отрицательные эмоциогенные зоны гипоталамуса и возбуждается адренерги-ческий механизм, от чего и происходит блокада болевой импульса-ции с последующим вовлечением и опиатного механизма. Е. О. Бра-гин (1985) считает, что периферическая катехоламиновая система подавляет, а центральная активирует механизм антиноцицепции. Наблюдения и экспериментальные исследования других авторов свидетельствуют о том, что активация центральных адренергиче-ских механизмов эфедрином вызывает аналгезию у оперированных и неоперированных крыс, снижая их ориентировочные и двигательные реакции на боль (А К Ярош, 1987).
Истощение моноаминергических соединений введением резерпина, тетрабензамина блокирует аналгезию, а восстановление уровня катехоламинов ее нормализует (Л. В Калюжный, Е. В. Гола-нов, 1980). Дофаминовая система также принимает участие в регуляции боли. Уменьшение аналгезии при стрессе, аурикулярной элект-роакупунктуре дает блокада дофаминовых рецепторов галоперидо-лом или связывание дофамина. Активация дофаминергической системы усиливает морфиновую анестезию, а снижение уровня дофамина уменьшает аналгезирующий эффект (Ю. Н. Васильев, 1982). Выяснено, что при болевом воздействии и стрессе резко активируется симпатоадреналовая система, мобилизуются тропные гормо-
32
ны, бета-липотропин и бета-эндорфин как мощные аналгетические полипептиды гипофиза, энкефалины. Попадая в спинно-мозговую жидкость, они влияют на нейроны таламуса, центрального серого вещества мозга, задние рога спинного мозга, тормозя образование медиатора боли — субстанции Р и обеспечивая таким образом глубокую аналгезию. Одновременно с этим усиливается, вероятно, образование серотонина в большом ядре шва, который также тормозит реализацию эффектов субстанции Р. Эти же механизмы обезболивания включаются при акупунктурной стимуляции неболевых нервных волокон.
Среди других гормональных продуктов, оказывающих аналге-тический эффект без активации опиатной системы, называют вазо-прессин, ангиотензин, окситоцин, соматостатин, нейротензин. Причем, аналгетический эффект последнего в 100—1000 раз сильнее энкефалинов, и боль не восстанавливается налаксоном (Л. В. Калюжный, 1984).
