
- •1. Движение. Виды движений. Описание движения. Система отсчета.
- •2. Траектория движения. Пройденный путь. Кинематический закон движения.
- •3. Скорость. Средняя скорость. Проекции скорости.
- •4. Ускорение. Понятие нормального и тангенциального ускорения.
- •5. Вращательное движение. Угловая скорость и угловое ускорение.
- •6. Центростремительное ускорение.
- •7. Инерциальные системы отсчета. Первый закон ньютона.
- •8. Сила. Второй закон Ньютона.
- •9. Третий закон Ньютона.
- •10. Виды взаимодействий. Частицы переносчики взаимодействий.
- •11. Полевая концепция взаимодействий.
- •12. Гравитационные силы. Сила тяжести. Вес тела.
- •13. Силы трения и упругие силы.
- •14. Центр масс системы материальных точек.
- •15. Закон сохранения импульса.
- •16. Момент силы относительно точки и оси.
- •17. Момент инерции твердого тела. Теорема Штейнера.
- •18. Основное уравнение динамики вращательного движения.
- •19. Момент импульса. Закон сохранения момента импульса.
- •20. Работа. Вычисление работы. Работа упругих сил.
- •21. Мощность. Вычисление мощности.
- •22. Потенциальное поле сил. Силы консервативные и неконсервативные.
- •23. Работа консервативных сил.
- •24. Энергия. Виды энергии.
- •25. Кинетическая энергия.
- •26. Потенциальная энергия тела.
- •27. Полная механическая энергия системы тел.
- •28. Связь между потенциальной энергией и силой.
- •29. Условия равновесия механической системы.
- •30. Соударение тел. Виды соударений.
- •31. Законы сохранения для различных видов соударений.
- •32. Линии и трубки тока. Неразрывность струи.
- •33. Уравнение Бернулли.
- •34. Силы внутреннего трения. Вязкость.
- •35. Колебательное движение. Виды колебаний.
- •36. Гармонические колебания. Определение. Уравнения. Примеры.
- •37. Автоколебания. Определение. Примеры.
- •38. Вынужденные колебания. Определение. Примеры. Резонанс.
- •39. Внутренняя энергия системы.
- •40. Первое начало термодинамики. Работа, совершаемая телом при изменении объема.
- •41. Температура. Уравнение состояния идеального газа.
- •42. Внутренняя энергия и теплоемкость идеального газа.
- •43. Уравнение адиабаты идеального газа.
- •44.Политропические процессы.
- •46. Давление газа на стенку сосуда. Средняя энергия молекул.
- •47. Распределение Максвелла.
- •48. Распределение Больцмана.
39. Внутренняя энергия системы.
Внутренняя энергия какого-либо тела это энергия этого тела за вычетом кинетической энергии как целого и потенциальной энергии тела во внешнем поле силы.
Понятие внутренней энергии включает понятие кинетической энергии хаотического движения молекул, потенциальной энергией взаимодействия между молекулами и внутримолекулярную энергию.
Внутренней энергией является функцией состояния системы, это означает что всякий раз, когда система оказывается в данном состоянии, ее внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы.
Следовательно, изменение внутренней энергии системы при переходе системы из одного состояния в другое будет равно разности значений внутренней энергии в этих состояниях, независимо от пути, по которому совершился переход.
40. Первое начало термодинамики. Работа, совершаемая телом при изменении объема.
Первый закон
термодинамики:
Количество
теплоты Q,
сообщенное термодинамической системе,
расходуется на изменение внутренней
энергии
![]() системы и на совершение системой
механической работы А.
системы и на совершение системой
механической работы А.
![]()
Работа в термодинамике:
находящийся в сосуде газ оказывает на
поршень площадью S
давление p=F/S,
под действием которого поршень
перемещается на расстояние l,
изменяя объём газа на
![]() и совершая работу
и совершая работу
![]() или
или
![]()
-Изотермический процесс (T=const). Изотермический процесс описывается законом Бойля - Мариотта: PV=const.
Диаграмма этого процесса (изотерма) в координатах р, V представляет собой гиперболу, расположенную на диаграмме тем выше, чем выше температура, при которой происходил процесс.
Работа изотермического
расширения газа:
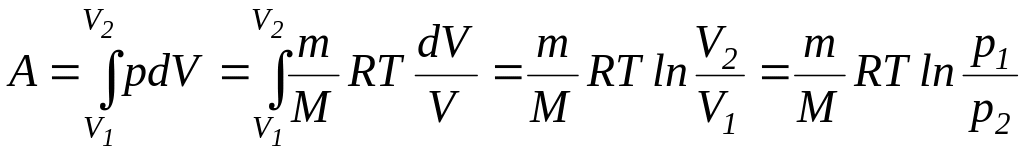 .
.
-Изобарный
процесс (p=const).
Диаграмма этого процесса (изобара) в
координатах р, V изображается прямой,
параллельной оси V. При изобарном процессе
работа газа при расширении объема от
V1
до V2
равна
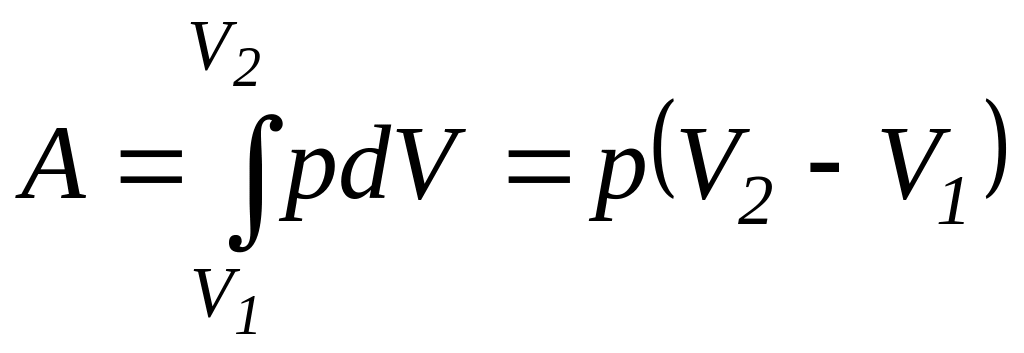 .
.
- Изохорный процесс
(V=const).
Диаграмма этого процесса (изохора) в
координатах р, V изображается прямой,
параллельной оси ординат. При изохорном
процессе газ не совершает работы над
внешними телами, т.е
![]() .
.
41. Температура. Уравнение состояния идеального газа.
Если несколько соприкасающихся тел находятся в тепловом равновесии, то этим телам приписывают одинаковую температуру.
Если при установлении теплового контакта между телами, одно тело передает другому энергию посредством энергопередачи, то первому телу приписывают большую температуру чем второму.
Ряд свойств тел зависит от температуры, соответственно любое из этих свойств может быть выбрано для полного определения температуры.
Идеальный газ - потенциальная энергия взаимодействия, между молекулами которого равна нулю.
Уравнение
состояния идеального газа:
![]() ,
p,V,T
– три параметра, которые используют
для описания идеального газа. М
- молярная
масса, р -
давление, V
- объем, Т
– абсолютная температура.
,
p,V,T
– три параметра, которые используют
для описания идеального газа. М
- молярная
масса, р -
давление, V
- объем, Т
– абсолютная температура.
42. Внутренняя энергия и теплоемкость идеального газа.
Идеальный газ - потенциальная энергия взаимодействия, между молекулами которого равна нулю.
Опыты
показывают, что внутренняя
энергия
идеального газа зависит только от
температуры.
![]()
Отсутствие зависимости внутренней энергии идеального газа от V указывает на то, что молекулы идеального газа большую часть времени не взаимодействуют друг с другом, т.е. подавляющую часть времени молекулы находятся в свободном полете.
Теплоемкостью
какого-либо тела называется величина
равная количеству тепла, которое нужно
сообщить телу, чтобы повысить его
температуру на 1К.
![]() Теплоемкость бывает 2-х видов:
Теплоемкость бывает 2-х видов:
1.
Удельная теплоемкость (величина, равная
количеству тепла, которое нужно сообщить
телу, чтобы нагреть 1 кг на 1 К).
![]()
2.
Молярная теплоемкость (количество
тепла, которое необходимо для нагревания
1 моля вещества на 1 К).
![]()
Все теплоемкости зависят от условий, при которых происходит нагревание тела.
