
- •Рабочая программа дисциплины Физико-химические основы процессов микро- и нанотехнологии
- •210100 – Электроника и наноэлектроника
- •222900 – Нанотехнологии и микросистемная техника
- •Предмет и методы физической химии, ее основные разделы
- •Становление и развитие физической химии как самостоятельной научной дисциплины, основные этапы ее развития
- •Химическая связь, строение молекул, теория валентных связей
- •8. Химическая связь, строение молекул, теория молекулярных орбиталей
- •9. Химическая связь в координационных соединениях
- •10. Типы химической связи
- •11. Понятие кристалл. Описание атомно-кристаллической структуры.
- •16. Квазикристаллы
- •18. Двойникование кристаллов
- •20. Термодинамические процессы
- •21. Начала термодинамики. Нулевое (общее) начало термодинамики
- •22. Первое начало термодинамики
- •24. Применение первого начала к химическим процессам
- •25. Второе начало термодинамики
- •26. Термодинамическое определение энтропии, ее свойства
- •27. Энергия Гиббса и энергия Гельмгольца
- •28. Вероятностная (статистическая) трактовка понятия энтропии
- •29. Третий закон термодинамики
- •Учебно-методические материалы по дисциплине
- •Задачи по квантовой механике, строению атома
- •Волны де-Бройля
- •Соотношение неопределенностей Гайзенберга
- •1.3. Атом водорода
- •Атомы щелочных металлов
- •Многоэлектронные атомы
- •1.5.Х. Пример np2- конфигурации в схеме ls- связи.
- •1.5.Х. Пример np2- конфигурации в схеме jj- связи
- •Момент импульса
- •Правила Хунда
- •Рентгеновские спектры
- •Магнитные свойства атомов
- •1.9.X. Рассчитать энергию отдачи r атома (ядра) при испускании им кванта энергией e. Найти отношение ширины линии г кванта к энергии отдачи r.
- •Строение молекул
- •2.1. Химическая связь
- •Задачи по термодинамике
- •1.24. Теплоемкость идеального газа, степени свободы
- •1.25. Кпд цикла Карно
- •Фундаментальные физические постоянные
Многоэлектронные атомы
Терм в заданной конфигурации – это совокупность состояний с заданными значениями L и S . Для обозначения состояния многоэлектронного атома принято следующее обозначение 2S + 1LJ.
Легко видеть, что число состояний в терме есть min[(2S +1),(2L +1)]. В случае L ≥ S их 2S +1, то есть мультиплетность указывает число компонент мультиплета, например, термы 3P и 3D действительно состоят из трех компонент. В противоположном случае L ≤ S число компонент терма равно 2L +1 и не совпадает с мультиплетностью. Например, терм 3S , хотя и называется триплетным, но состоит всего из одной компоненты. Что касается синглетных термов, то они всегда состоят из единственной компоненты, то есть для них понятия терма и состояния совпадают.

Для определения основного состояния в терме используют правило Ланде (его иногда включают в правила Хунда), согласно которому если атомная подоболочка заполнена менее чем наполовину, наименьшую энергию имеет состояние с минимальным значением J (нормальный мультиплет), если же атомная подоболочка заполнена более чем наполовину, то наименьшую энергию имеет состояние с максимальным J (обращенный мультиплет).
В заключение заметим, что в приближении LS связи цепочка понятий «электронная конфигурация – терм – состояние» фактически отражает иерархию взаимодействий в многоэлектронном атоме «взаимодействие электронов с ядром – электростатическое взаимодействие электронов – спин - орбитальное взаимодействие». В случае jj - связи последовательность интенсивности взаимодействий другая: «взаимодействие электронов с ядром – спин - орбитальное взаимодействие - электростатическое взаимодействие электронов».
Следует отметить, что электронные конфигурации с числом электронов n и (m - n), где m максимально возможное число электронов на подуровне, имеют одинаковый набор термов.
1.5.х. Атом углерода, конфигурация 1s22s22p2. Мы уже рассматривали эту задачу, однако сейчас определим терм непосредственно по правилам Хунда. Имеем два электрона, поэтому максимально возможный спин S = 1, т.е. основной терм будет триплетом. Теперь мы должны выбрать максимально возможное значение L у двух эквивалентных p - электронов. При этом мы должны не нарушить принцип Паули. Рассмотрим возможные значения квантовых чисел, описывающих состояния электронов
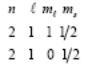
Мы выбирали эти числа так, что сначала получить максимально возможное значение проекции орбитального момента. Имеем max(ML) = 1, Поэтому L = max(ML) = 1, то есть основной терм есть 3P . Терм состоит из трех состояний 3P0,1,2. Основным является 3P0.
1.5.х. Атом азота, конфигурация 1s2 2s2 2p3 . Направим спины всех трех электронов в одну сторону. Поэтому S = max(MS) = 3/2, т.е. мы имеем квартетный терм. Составим теперь таблицу из квантовых чисел электронов

Для того, чтобы направить все три спина в одну сторону, мы вынуждены использовать все три значения квантового числа ml. В результате L = max(ML)=0, т.е. основной терм есть 4S, основное состояние 4S3/2.
1.5.x. Атом кислорода, конфигурация 1s2 2s2 2p4. Теперь мы уже не можем направить все спины в одну сторону (см. таблицу)

Теперь мы имеем два нескомпенсированных спина, т.е. основной терм будет триплетным. Кроме того суммарный орбитальный момент равен орбитальному моменту последнего четвертого электрона, т.е. L = 1. В результате имеем основной терм 3P. В данном случае p -подоболочка заполнена больше чем наполовину. Поэтому по правилу Ланде основным будет состояние 3P 2.
1.5.х. Атом фтора, конфигурация 1s2 2s2 2p5. Здесь удобно рассуждать следующим образом. Следующий за фтором атом неона имеет полностью заполненную p - подоболочку, и, следовательно, нулевые значения орбитального и спинового моментов. Значит, 2p5 представляет собой «дырочную» конфигурацию, где момент всей конфигурации равен моменту недостающего электрона – «дырки». Поэтому аналогично конфигурации 2p1 (атом бора) имеем основной терм 2P . Мультиплет является обращенным, поэтому основное состояние есть 2P3/2.
1.5.х. Атома кислорода. Определить термы основного состояния атомов кислорода и хрома.
1.5.х. Электронная конфигурация атома кислорода 2p4, графическая формула имеет вид:
-
↑↓
↑
↑
m
1
0
-1
Отсюда L = 0 +1 = 1 - P-состояние. S = 1/2 + 1/2 = 1, мультиплетность 2S + 1 = 3 – триплетное состояние. Возможные значения J = 2, 1, 0. Так как оболочка атома кислорода заполнена более чем наполовину, то J = 2. Т.о. терм основного состояния атома кислорода имеет вид 3P2.
Для атома хрома электронная конфигурация имеет вид 3d54s1, графическая формула:
-
3d
4s
↑
↑
↑
↑
↑
↑
m
2
1
0
-1
-2
0
L = 2 + 1+ 0 + (-1) + (-2) + 0 = 0 S - состояние
S = 6·1/2 = 3
Мультиплетность 2S + 1 = 7. J имеет только одно значение 3. Тогда терм атома хрома запишется как 7S3.
1.5.х. На каком основании хлор и марганец не помещают в одной группе периодической системы элементов? Почему их помещают в разных подгруппах?
1.5.х. Электронные конфигурации атомов:
Сl: ls22s22p63s23p5; Mn: ls22s22p63s23p63d54s2
Валентные электроны хлора – 3s23p5, а марганца – 3d54s2. Таким образом, эти элементы не являются электронными аналогами и не должны размещаться в одной и той же подгруппе. Но на валентных орбиталях атомов этих элементов находится одинаковое число электронов - 7. На этом основании оба элемента помещают в одну и ту же группу периодической системы, но в разные подгруппы.
1.5.х. Определить термы двух неэквивалентных электронов в электронной конфигурации npn' p (здесь n ≠ n' ).
1.5.х. Для того, что определить термы этой конфигурации мы должны определить возможные значения полного орбитального и полного спинового момента совокупности электронов. В рассматриваемом случае по правилам сложения момента имеем: L = 0,1,2 и S = 0,1, т.е. реализуются следующие термы:
1S, 1P, 1D,
3S, 3P, 3D. (11.20)
Полученный результат можно записать короче: 1SPD, 3SPD, или так 1,3SPD . Итак, в рассматриваемой конфигурации существует шесть термов, характеризующихся различными значениями энергии.
Вспомним теперь о спин – орбитальном взаимодействии в атоме. Это взаимодействие приводит к появлению тонкой структуры терма: терм расщепляется на группу состояний - мультиплет, число компонентов которого определяется числом возможных ориентаций векторов L и S в пространстве, то есть числом возможных значений квантового числа J , задающего величину механического момента всей электронной оболочки атома.
Таким образом, в конфигурации npn'p возможны следующие состояния:
1So, 1P1, 1D2, 3S1, 3P0,1,2, 3D1,2,3. (11.21)
Полное число состояний, принадлежащих конфигурации, оказалось равно десяти.
