
- •Рабочая программа дисциплины Физико-химические основы процессов микро- и нанотехнологии
- •210100 – Электроника и наноэлектроника
- •222900 – Нанотехнологии и микросистемная техника
- •Предмет и методы физической химии, ее основные разделы
- •Становление и развитие физической химии как самостоятельной научной дисциплины, основные этапы ее развития
- •Химическая связь, строение молекул, теория валентных связей
- •8. Химическая связь, строение молекул, теория молекулярных орбиталей
- •9. Химическая связь в координационных соединениях
- •10. Типы химической связи
- •11. Понятие кристалл. Описание атомно-кристаллической структуры.
- •16. Квазикристаллы
- •18. Двойникование кристаллов
- •20. Термодинамические процессы
- •21. Начала термодинамики. Нулевое (общее) начало термодинамики
- •22. Первое начало термодинамики
- •24. Применение первого начала к химическим процессам
- •25. Второе начало термодинамики
- •26. Термодинамическое определение энтропии, ее свойства
- •27. Энергия Гиббса и энергия Гельмгольца
- •28. Вероятностная (статистическая) трактовка понятия энтропии
- •29. Третий закон термодинамики
- •Учебно-методические материалы по дисциплине
- •Задачи по квантовой механике, строению атома
- •Волны де-Бройля
- •Соотношение неопределенностей Гайзенберга
- •1.3. Атом водорода
- •Атомы щелочных металлов
- •Многоэлектронные атомы
- •1.5.Х. Пример np2- конфигурации в схеме ls- связи.
- •1.5.Х. Пример np2- конфигурации в схеме jj- связи
- •Момент импульса
- •Правила Хунда
- •Рентгеновские спектры
- •Магнитные свойства атомов
- •1.9.X. Рассчитать энергию отдачи r атома (ядра) при испускании им кванта энергией e. Найти отношение ширины линии г кванта к энергии отдачи r.
- •Строение молекул
- •2.1. Химическая связь
- •Задачи по термодинамике
- •1.24. Теплоемкость идеального газа, степени свободы
- •1.25. Кпд цикла Карно
- •Фундаментальные физические постоянные
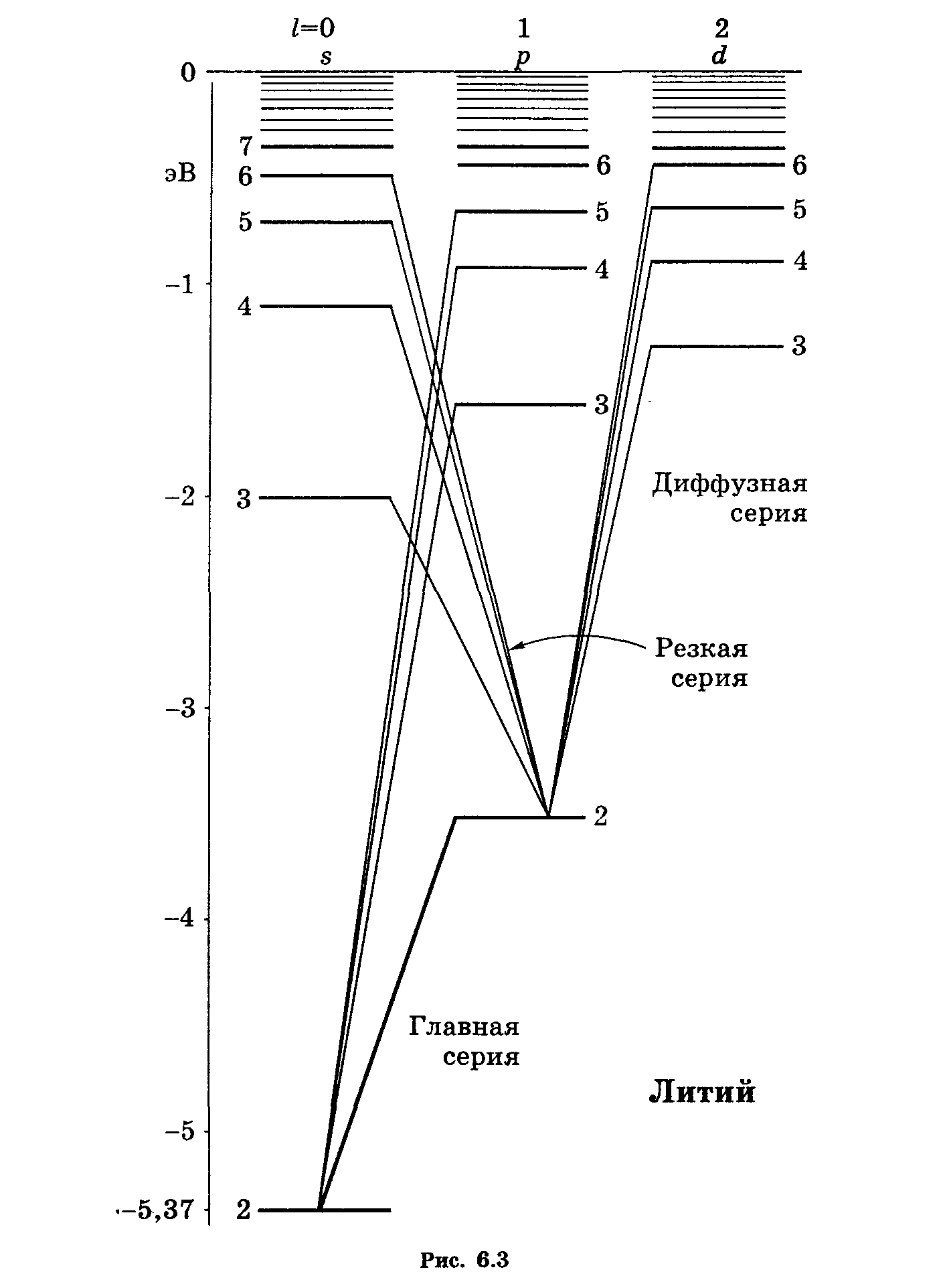
Атомы щелочных металлов
В некотором смысле атомы щелочных металлов являются водородоподобными, однако не полностью. Дело в том, что внешний электрон деформирует электронный остов и тем самым искажает поле, в котором движется. В первом приближении поле остова можно рассматривать как суперпозицию поля точечного заряда +е, и поля точечного диполя, расположенного в центре остова. При этом ось диполя направлена все время к внешнему электрону. Поэтому движение последнего происходит так, как если бы поле остова, несмотря на искажение, сохранялось сферически симметричным.
Это позволяет представить потенциальную энергию внешнего электрона в поле такого остова как:
U(r) = -e2/r – Ce2/r2, (6.18)
где С – некоторая постоянная.
Решение УШ для электрона с потенциальной энергией (6.18) приводит к тому, что теперь разрешенные состояния энергии Е в области E < 0 (для связных состояний внешнего электрона) будет зависеть не только от главного квантового числа n (как в случае атома водорода), но и от орбитального квантового числа l:
Enl = -ћR/(n + l)2, (6.19)
где l) – ридберговская поправка (или квантовый дефект), зависящая от l . Заметим, ц лития (см. рис. 6.3) основным состоянием является 2s , так как состояние с n = 1 уже занято двумя электронами, входящими в состав остова.
Энергетическому уровню (6.19) соответствует терм, имеющий согласно 2.30 вид:
Tnl = R/(n + l)2 (6.20).
Систематику энергетических уровней атома принято назвать системой термов. Терм T – это величина, определяемая согласно = R(1/no2 – 1/n2) (2.16) и En = -me4Z2/2ћ2n2 (2.25) как:
Tn = R/n2 = |En|/ћ,
где R – постоянная Ридберга. В отличие от энергии En, терм - величина положительная, и чем выше уровень, тем больше его значение. Терм имеет ту же размерность, что и частота , т.е. с-1. Соответствующая частота фотона, испущенного при переходе атома из состояния с квантовым числом n1 в состояние с квантовым числом n2, определяется формулой:
12 = T2 – T1 = R/n22 – R/n12. (2.31)
Все серии хххх представляются в виде обобщенной формулы Бальмера:
= R(1/no2 – 1/n2) (2.16).
Энергия En электрона на n-й стационарной орбите определяется формулой
En = -me4Z2/2ћ2n2 (2.25).
1.4.х. Найти ридберговскую поправку 3Р терма атома Na , первый потенциал возбуждения которого 1 = 2,10 В, а энергия связи валентного электрона в основном 3S- состоянии Ео = 5,14 эВ.
1.4.х. Используем формулу Enl = -ħR/(n + l)2 (6.19), которая содержит искомую поправку P. Согласно рис. 6.11. энергию 3Р – состояния можно представить как:
E3P
= -(Eo
– e1)
= -(5,14 – 2,19) эВ
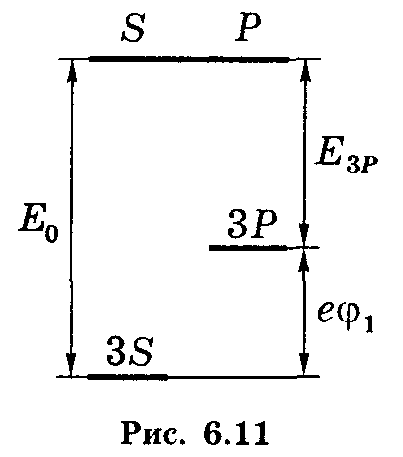 (имея
в виду, что энергия уровня равна с
обратным знаком энергии связи на этом
уровне). Таким образом, имеем:
(имея
в виду, что энергия уровня равна с
обратным знаком энергии связи на этом
уровне). Таким образом, имеем:
![]()
![]()
1.4.х. Найти энергию связи валентного электрона в основном состоянии атома лития, если известно, что длины волн головной линии резкой серии и ее коротковолновой границы равны соответственно 1 = 813 нм и K = 350 нм.
1.4.х. Согласно формуле Enl = -ħR/(n + l)2 энергия связи в 2s- состоянии равна:
![]()
Задача сводится к нахождению поправки s. Из рис. 6.3 и формулы 6.19 можно записать:
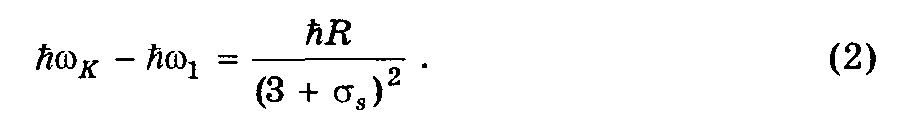
Т.к.
= 2c//
перепишем (2) как:
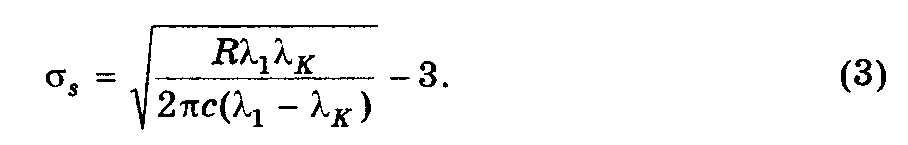
Подставив (3) в (1) получим: Eсв = ћR/[(R1K/2c)1/2 - 1]2 = 5,3 эВ, где = 1 –K.
