7. Модель атома Резерфорда.
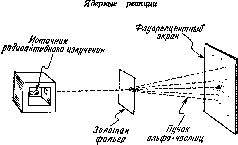
Резерфорд предпринял попытку исследовать структуру положит.заряженной материи внутри атома. Дл яэтого он брал источник α-частиц и исследовал угловое распределение α-частиц после рассеивания на тонкой фольге, которую изготовляли из разных металлов, таких как медь и золото. Фольга бралась достаточно тонкой, для того чтобы наблюдаемое отклонение α-частиц было результатом одного рассеивания. Число α-частиц, рассеиваемых атомами мишений на различные углы подсчитывалось с помощью спец.счётчиков.
 Как известно, α-частицы это ядра атома
гелия→ масса αчастицы >> чем масса
электрона, поэтому при прохождении
α-частицы через атом ,электроны должны
слабо влиять на характер движения
α-частиц. Поскольку масса атомов >>
массы электрона, то из этого следует,
что практически вся масса атомов
сосредоточена в положит.заряженной
части атома. Т.о. на характер движения
α-частиц в основном влияет положит.заряженная
часть атомов.
Как известно, α-частицы это ядра атома
гелия→ масса αчастицы >> чем масса
электрона, поэтому при прохождении
α-частицы через атом ,электроны должны
слабо влиять на характер движения
α-частиц. Поскольку масса атомов >>
массы электрона, то из этого следует,
что практически вся масса атомов
сосредоточена в положит.заряженной
части атома. Т.о. на характер движения
α-частиц в основном влияет положит.заряженная
часть атомов.
Результаты экспериментов, которые провел Резерфорд показали, что практически все α-частицы пролетают сквозь фольгу не отклоняясь и лишь небольшая их часть отлетает обратно. Из этих результатов следовало, что положит.заряд в атоме распределен не по всему атому, а сосредоточен в небольшой части. Это следует из следующих рассуждений: если бы положит.заряд был размазан по всему атому, то в этом случае, как можно легко показать, при уменьшении прицельного расстояния отклонение α-частицы от первоначальной траектории должно уменьшаться и отклонение α-частиц на углы, большие чем π/2 невозможно. Резерфорд же наблюдал в своих экспериментах, что некоторые α-частицы отклонялись на 180°.
Резерфорд произвел вычисление, которые показали, что положит.заряженная материя в атоме сосредоточена в очень небольшом объеме размера порядка 10-12 см.
Эта область атома была названа ядром. Т.о., экспериментальные исследования, проведенные Резерфордом привели к след.результатам:
«+» заряд атомов сосредоточен в области порядка 10-12 см.
Вокруг ядра движутся электроны, поскольку размеры атомов имеют порядок 10-8 см, то можно заключить, что расстояние электронов от ядра имеет тот же порядок.
Поскольку масса электронов очень мала по сравнению с массой атомов, то следует, что практически вся масса атомов сосредоточена в ядре.
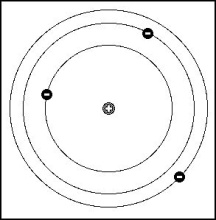
На основании этих данных Резерфорд построил планетарную модель атома. Согласно этой модели, в центре атома находится тяжелое положит.заряженное ядро, вокруг которого подобно планетам вращаются легкие «-»-заряженные электроны.
 Предложенная Резерфордом модель атомов
имеет ряд серьёзных недостатков:
Предложенная Резерфордом модель атомов
имеет ряд серьёзных недостатков:
Благодаря наличию центростремительного ускорения у движущихся вокруг ядра электронов, согласно классической механики, они должны непрерывно излучать эл/магнитные волны. В рез-те потери энергии на излучение радиус вращения электронов должен непрерывно уменьшаться и в конце концов электроны должны упасть на ядро, т.е. с точки зрения классической физики атом в виде планетарной модели вообще не может существовать.
С точки зрения классической физики частота излучения атомов должна совпадать с частотой обращения электронов и содержать также частоты, кратные этой основной частоте. Такой характер спектра излучения находится в полном противоречии с наблюдаемыми закономерностями атомов спектра.
С классической точки зрения электрон может описывать вокруг ядра всевозможные орбиты, обладая непрерывным спектром энергии. Из теории излучения абс.черного тела, теории теплоемкостей и опытом Франка-Герца следует, что электроны в атомах движутся по определенным орбитам. Такой характер движения электронов в атоме находится в противоречии с классич. планетарной моделью атома.
Т.о. из опытов Резерфорда следует, планетарная модель атома, с другой стороны исходя и планетарной модели атомов и пользуясь представлениями классической физики, оказалось невозможным объяснить целый ряд экспериментальных фактов. Поэтому необходимо было ввести в физику новые представления. Этот шаг был сделан Нильсом Бором.
8. Модель атома Бора. m2
Первую
модель атома, которая не противоречила
экспериментальным данным, удалось
построить в 1913 году датскому физику
Нильсу Бору, который предложил модель
для описания водородоподобных атомов,
т.е. атомов, вокруг ядер которых вращается
один электрон. При построении своей
модели Нильс Бор опирался на исследования,
полученные в области спектроскопии.
Рассмотрим основные закономерности,
которые были получены при изучении
атомных спектров и легли в основу модели
Бора. Детальные исследования атомных
спектров, проведенных в конце 19 столетия
показали, что длины волн линий, составляющих
атомный спектр, распределены закономерно
и эти распределения могут быть описаны
простыми соотношениями. Первым, кто
обнаружил закономерность в атомных
спектрах, был Бальмер, который в 1885 году
установил, что часть спектра излучение
атома водорода описывается след.
соотношением:
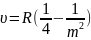 (1), m>2, R-постоянная
Ридгарда.
(1), m>2, R-постоянная
Ридгарда.
Эта часть
спектра атома водорода была названа
серией Бальмана. В дальнейшем а спектре
атома водорода удалось обнаружить также
другие серии, которые описываются след.
формулой: :
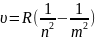 (2). Открытые серии получили свое
название в честь их первооткрывателей.
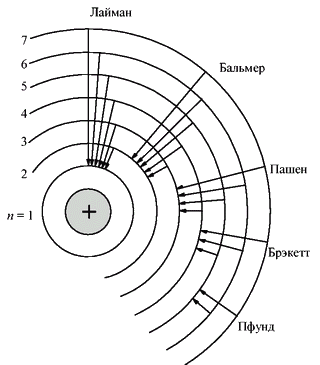
Серия при n=1 наблюдались
в ультрафиолетовой области спектра и
получила название серии Лаймана. Серия
с n=2 наблюдалась в видимой
области спектра и получила название
серии Бальмера. Серия с n=3
наблюдалась в инфракрасной области
спектра и получила название серии
Пашена. Серия с n=4 наблюдалась
в инфракрасной области спектра и получила
название серии Брекета. В рамках
классической физики дискретный характер
атомных спектров и закономерности в
этих спектрах объяснить не удалось.
Т.о. к 1913 году стало ясно, что как структура
атома, так и процесс взаимодействия
атома с излучением не могло найти
объяснения в рамках классической физики.
В такой ситуации Бор предложил, что
можно обосновать существование
планетарной модели атома и объяснить
данные атомной спектроскопии, если
отказаться от попыток использования
классической физики принять во внимание
квантовые св-ва излучения и предположить
наличие квантовых св-в у атома. В основу
своей модели атома Бор положил следующие
3 постулата:
(2). Открытые серии получили свое
название в честь их первооткрывателей.
Серия при n=1 наблюдались
в ультрафиолетовой области спектра и
получила название серии Лаймана. Серия
с n=2 наблюдалась в видимой
области спектра и получила название
серии Бальмера. Серия с n=3
наблюдалась в инфракрасной области
спектра и получила название серии
Пашена. Серия с n=4 наблюдалась
в инфракрасной области спектра и получила
название серии Брекета. В рамках
классической физики дискретный характер
атомных спектров и закономерности в
этих спектрах объяснить не удалось.
Т.о. к 1913 году стало ясно, что как структура
атома, так и процесс взаимодействия
атома с излучением не могло найти
объяснения в рамках классической физики.
В такой ситуации Бор предложил, что
можно обосновать существование
планетарной модели атома и объяснить
данные атомной спектроскопии, если
отказаться от попыток использования
классической физики принять во внимание
квантовые св-ва излучения и предположить
наличие квантовых св-в у атома. В основу
своей модели атома Бор положил следующие
3 постулата:
Атом может находиться лишь в определенных так называемых стационарных состояниях, характеризующихся дискретными значениями его энергии. Находясь в этих состояниях, атом не излучает.
Атом испускает или поглощает излучение лишь при переходах из одного стационарного положения в другое. Энергия кванта при этом описывается след.соотношением:
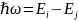 (3)
(3)
Электрон может находиться лишь на таких круговых орбитах, на которых момент импульса электрона имеет дискретные значения.
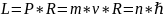 (4)
(4)
n=1,2,3,… , R- радиус орбиты
Последний постулат-правило квантования орбит электрона в атоме.
Опираясь на эти постулаты, Бор получил аналитическое выражение, описывающее спектр водородоподобного атома. Ему также удалось вычислить энергию связи электрона, находящегося в основном состоянии атома и постоянную Ридберга. Причем численные значения оказались в хорошем согласии с экспериментальными данными. Давайте, исходя из постулатов Бора для водородоподобного атома с зарядом ядра (z*e) найдем след.параметры: 1) Радиусы орбит электрона 2) Частоту волны, которая соответствует переходу электрона с одной орбиты на другую. 3) Постоянную Ридберга.
Согласно модели Бора, водородоподобный атом с зарядом ядра (z*e) представляет собой ядро, вокруг которого по круговым орбитам движется один электрон, который может переходить с одной орбиты на другую, излучая или поглощая квант энергии равный разности энергии электрона на этих орбитах. (2→1-излучает энергию, 1→2-поглощает энергию)
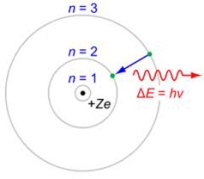 При
движении по орбите на данный электрон
действует со стороны ядра кулоновская
сила:
При
движении по орбите на данный электрон
действует со стороны ядра кулоновская
сила:
 ,
k-коэф.пропорциональности(
,
k-коэф.пропорциональности(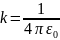 ,
где ε0-диэл.прониц-ть в вакууме).
Согласно II закону Ньютона:
ma=F (6),
F-равнодействующая всех
сил; F=Fk
.
,
где ε0-диэл.прониц-ть в вакууме).
Согласно II закону Ньютона:
ma=F (6),
F-равнодействующая всех
сил; F=Fk
.
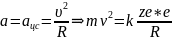 (8) (8) и(4) :
(8) (8) и(4) :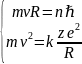 (9) R=
(9) R=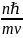
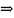
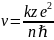 (11)
(11)
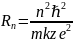 (10)
(10)
Подставим в (10) z=1; n=1
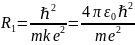 (12) (12)-боровский радиус.
(12) (12)-боровский радиус.
Давайте вычислим полную энергию электрона, кот. Находится на n-ой орбите. Данная энергия электрона складывается из кинетической и потенциальной. Eполн=Т+П (13)
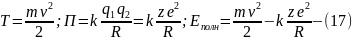
Давайте подставим
(10) и (11) в (17):
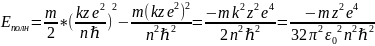 (18)
(18)
Запишем (3), учитывая
(18):
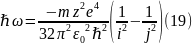 ;
;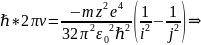
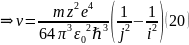 ;
;
Сравнивая (2) и (20):

Исходя из модели Бора можно дать интерпретацию серий Лаймана, Бальмера и др. Серии Лаймана соответствуют переходы на 1-ый уровень, а серии Бальмера соотв. переходы на 2-ой.