
7.5 Добування карбонільних сполук
Альдегіди і кетони за ступенем окиснення карбонільного Карбону займають проміжне положення між вуглеводнями і спиртами з одного боку, і карбоновими кислотами, з іншого. Тому для одержання оксосполук найчастіше використовують методи окиснення чи відновлення згаданих класів.
1 Оксинення спиртів проводять за допомогою сполук Мангану (ІV) , Мангану (VІІ) і найчастіше – сполуками Хрому (VІ) – дихроматом натрію Na2Cr2O7 чи калію K2Cr2O7, реактивом Джонса (CrO3 + H2SO4), реактивом Корі (комплексний хлорхромат піридинія [C5H5NH]+ClCrO3-), комплексом CrO3 з піридином C5H5N, який не окиснює кратні звязки, тому його застосовують при окисненні ненасичених спиртів, а також ароматичних гідроксиспиртів. Триоксид хрому (VI) не затрачує чуттєвого до окисників фенольного гідроксилу:
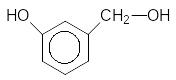
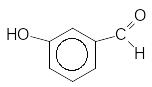
250C
3 + 2CrO3 --------------- 3 + Cr2O3 + 3H2O
піридин
3-Гідроксибензиловий спирт 3-Гідроксибензальдегід
При окисненні вторинних спиртів без ускладнень утворюються кетони. А окиснення первинних спиртів дає альдегіди, але може супроводжуватися подальшим утворенням карбонових кислот. Для запобігання цього альдегіди слід швидко виводити із реакційного середовища.
[O]
R-CH2-OH ------------- R-CH=O + H2O
Первинний спирт Альдегід
[O]
R-CH-R1 ------------- R-C-R1 + H2O
OH O
Вторинний спирт Кетон
У промисловості окиснення спиртів проводять через їх каталітичного дегідрування:
3500C
CH3-CH2-OH --------------- CH3-CH=O + H2
Cu, Zn
Етанол Етаналь
3500C
CH3-CH-СH3 --------------- CH3-C-СH3 + H2
Cu, Zn
ОН О
Пропанол-2 Пропанон
До речі, у звязку з таким способом одержання альдегідів утворилося їх класова назва (alcohole dehydrogenatus (спирт дегідрований).
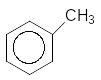
2 Оксосинтез (карбонілювання, гідроформілювання), який полягає у приєднанні до алкену оксиду Карбону (ІІ) і водню у присутності каталізатора октакарбонілдикобальту. При цьому може утворюватися суміш альдегідів залежно від того, до якого атома Карбону при подвійному звязку приєднується СО і Н2), однак нерозгалужений альдегід отримується у переважній кількості:
O
 --------------
CH3-CH2-CH2-C
--------------
CH3-CH2-CH2-C
1300C, 300 Атм Бутаналь H
СH3-CH=CH2 + CO + H2 ---------------------
Пропен Со2(СО)8 CH3
O
-------------- CH3-CH-C
H
2-Метилпропаналь
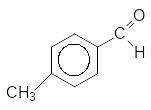 За
допомогою оксосинтезу одержують і
ароматичні альдегіди – гомологи
бензальдегіду, при цьому карбонільна
група входить у бензенове кільце і
пара-положення відносно алкільного
радикалу:
За
допомогою оксосинтезу одержують і
ароматичні альдегіди – гомологи
бензальдегіду, при цьому карбонільна
група входить у бензенове кільце і
пара-положення відносно алкільного
радикалу:
+ СО ----------------
AlCl3, CuCl
Толуол n-Метилбензальдегід
3 Декарбоксилювання карбонових кислот та їх солей.
Якщо декарбоксилюванню (тобто відщепленню карбоксильної групи) піддають одну кислоту, то утворюється симетричний кетон, якщо дві – то несиметричний кетон, а якщо декарбоксилюють будь-яку карбонову кислоту у суміші із мурашиною, то утворюється альдегід цієї кислоти:
3000C
2R-COOH ---------------------- R-C-R + CO2 + H2O
MnO2, ThO2
Карбонова кислота О
Симетричний кетон
3000C
R-COOH + R1-COOH ---------------------- R-C-R1 + CO2 + H2O
MnO2, ThO2
Суміш кислот О
Несиметричний кетон
3000C
R-COOH + НСООН ---------------------- R-CН=О + CO2 + H2O
Мурашина кислота MnO2, ThO2
 Дикарбонові
кислоти внаслідок декарбоксилювання
дають циклічні кетони, наприклад:
Дикарбонові
кислоти внаслідок декарбоксилювання
дають циклічні кетони, наприклад:
СН2-СН2-СООН 3000C
--------------------- ==O + CO2 + H2O
CH2-CH2-COOH MnO2, ThO2
Гександиова кислота Циклопентанон
(адіпінова)
Подібна закономірність зберігається і при декарбоксилюванні солей карбонових кислот, яку здійснюють методом сухої перегонки. Найчастіше використовують солі магнію, а також лужноземельних металів, наприклад:
О
 СН3-С
СН3-С
О t0
 Са
-----------------
CH3-C-CH3
+ CaVO3
Са
-----------------
CH3-C-CH3
+ CaVO3
O суха перегонка
СН3-С О
О
Ацетат кальцію Ацетон
t0 O
(CH3COO)2Ba + (HCOO)2Ba ----------------------- 2CH3-C + 2BaCO3
суха перегонка Н
Ацетат барію Форміат барію Ацетальдегід
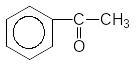
t0
(СН3СОО)2Mg + (C6H5COO)2Mg ----------------- + 2MgCO3
суха перегонка
Ацетат магнію Бензоат магнію Ацетофенон
Зрозуміло, коли декарбюоксилюють суміш солей, то одночасно з основним продуктом, утворюються і побічні. Так. Для останньої реакції побічними продуктами сухої перегонки є ацетон СН3-С(О)-СН3 і бензофенон С6Н5-С(О)-С6Н5.
4 Гідроліз геманальних дигалогенпохідних, при якому одержують як альдегіди, так і кетони:
СН3-CHCl2 + 2NaOH -------- CH3-CH=O + 2NaCl + 2H2O.
H2O
1,1-Дихлоретан Етаналь
СН3-CHCl2–СН3 + 2NaOH -------- CH3-C-СH3 + 2NaCl + 2H2O.
H2O
О
2,2-Дихлорпропан Ацетон
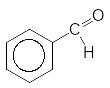 Такі
реакції лежать і основі промислового
одержання деяких карбонільних сполук,
наприклад:
Такі
реакції лежать і основі промислового
одержання деяких карбонільних сполук,
наприклад:
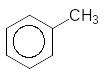
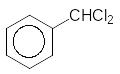
2Cl2, h +2H2O
------------ --------------
-2HCl -2HCl
Толуол Бунзиліденхлорид Бензальденід

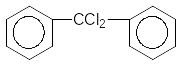

AlCl3 +2H2O
2 + CCl4 --------- ---------
-2HCl –2HCl
Бензол Дифенілдихлорметан Бензофенон
5 Гідратація алкінів за реакцією Кучерова, у результаті якої утворюються кетони, за винятком гідратації ацетилену, що приводить до альдегіда:
СНСН + Н2O -------- CH3-CH=O
Hg2+
Цетилен Ацетальденігд
СН3-ССН + Н2O -------- CH3-C-СH3
Hg2+
О
Пропін Ацетон
Останнім часом гідратацію ацетилену проводять не за способом Кучерова, використовуючи інші каталізатори:
t0
2CHCH + 2H2O ----------------- CH3-C-CH3 + H2 + CO2
MnO2, Fe2O3
Ацетилен О
Ацетон
6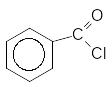
 Відновлення
функціональних похідних карбонових
кислот – галогенангідридів, сколадних
естерів, амідів. Як відновник використовують
комплексні гідриди металів (наприклад,
алюмогідрид літію LiAlH4)
і
алюмінійорганічні сполуки.
Відновлення
функціональних похідних карбонових
кислот – галогенангідридів, сколадних
естерів, амідів. Як відновник використовують
комплексні гідриди металів (наприклад,
алюмогідрид літію LiAlH4)
і
алюмінійорганічні сполуки.
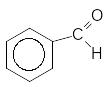
[H]
----------------- + HCl
LiAlH4
Бензоілхлорид Бензальдегід
Аміди відновлюють натрієм у рідкому амоніаку і присутності спирту:
O [H] O
CH3-C ------------------------------- CH3-C + NH3
NH2 Na, NH3(p), C2H5OH H
Ацетамід
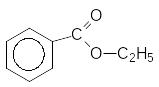
[H]
--------------------- + C2H5OH
LiAlH4
Етилбензоат Бензальдегід
