
CooMa NaOoc
Альдегід Реактив Фелінга (комплексний
тартарат міді (ІІ) із сегнетовою сіллю)
+ KOOC-CH(OH)-CH(OH)-COONa
Сегнетова сіль (тартарат калію-натрію)
При дії реактивом Фелінга на альдегіди утворюється червоний осад Cu2O – реакція “мідного дзеркала”.
Для спрощення запису схему реакції “мідного дзеркала” при взаємодії альдегідів з реактивом Фелінга записують так:
 O
O
O
O
R-C + 2Cu(OH)2 ------------------ R-C + Cu2O + 2H2O
Н винная кислота ОН
Фелінгова рідина подібно до реактива Толенса теж може окиснювати сполуки інших класів, але на відміну від нього не взаємодіє з ароматичними альдегідами.
Реактив Бенедикта – цитратний комплекс міді (ІІ), утворений гідроксидом міді (ІІ) з лимонною кислотою (НООС-СН2-СН(ОН)-СН2-СООН) – ще один різновид реакції “мідного дзеркала”:
O O
R-C + 2Cu(OH)2 -------------------- R-C + Cu2O + 2H2O
H лимонна кислота OH
V Диспропорціювання альдегідів
За певних умов окремі альдегіди можуть піддаватися реакції диспропорціювання, внаслідок якого половина молекул окиснюється до кислот, а інша – відновлюється до спиртів.
Реакція Канніцціро проходить у сильно лужному середовищі з альдегідами, які в -положенні не мають рухливого атома Гідрогену (С6Н5-СН=О, (СН3)3=О, НСН=О):
2C6H5-CH=O + KOH --- C6H5-CH2-OH + C6H5COOK
Бензальдегід (60%) бензиловий спирт Бензоат калію
2) Реакція Тіщенка каталізується алкоголятами алюмінію (наприклад, етаноляту (С2Н5О)3Al) в неводному середовищі. При цьому одна молекула альдегіда виступає як нуклеофіл, а інша – як електрофільний центр:
+ O – O

 CH3–C
:O=CH–CH3
–––––––––––––––> CH3–C
CH3–C
:O=CH–CH3
–––––––––––––––> CH3–C
H (C2H5O)Al O–CH2–CH3
Оцтовий альдегід Етилацетат
Реакція Тіщенка, яку іноді називають естерною конденсацією, використовується для промислового одержання окремих естерів.
VI Реакція вуглеводневого адикалу
Характер реакцій , що протікають у радикалі, залежить від природи хімічних звязків між атомами Карбону і будови вуглецевого скелету.
Насичені карбонові сполуки вступають у реакції радикального заміщення (SR) атомів Гідрогену при sp3-гібридизованому Карбоні, причому ці реакції найчастіше відбуваються в -положенні відносно карбонільної групи. Наприклад, галогенування:
h
СН3-СН2-СН=О + Cl2 -------- CH3-CHCl-CH=O + HCl
Пропаналь -Хлорпропіоновий
альдегід
h
СН3-СН2-С-СН2-СН3 + Cl2 -------- CH3-CHCl-C-СH2-СН3 + HCl
О О
Пентанон -Хлорпентанон-3
Бромування оксосполук каталізується червоним фосфором:
CH3-CH=O + Br2 ---------- CH2Br-CH=O + HBr
Ацетальдегід Рчерв. Бромацетальдегід
При надлишку галогену можуть заміщуватися усі атоми Н в -положенні:
CH3-CH=O + 3Br2 ---------- CHBr3-CH=O + 3HBr
Рчерв. Трибромацетальдегід
Ця здатність лежить в основі галоформної реакції, в яку вступає оцтовий альдегід і всі метилкетони. У лужному середовищі вони можуть повністю галогенуватися по метильній групі. Одержана сполука під дією лугу розкладається на сіль і галоформ (хлоро-, бромо- чи йодоформ СHHal3):
100C NaOH
CH3-CH=O + 3Br2 ----------- CBr3-CH=O ----------- CHBr3 + HCOONa
NaOH
100C NaOH
C6H5-C-CH3 + 3I2 ---------- C6H5-C-CI3 --------- C6H5-COONa + CHI3
NaOH
Галоформну реакцію застосовують для одержання карбонових кислот (через їх солі) та для кількісного визначення оцтового альдегіду і метилкетонів (а також етану СН3-СН2-ОН, який в умовах досліду окиснюється в ацетальдегід).
2) Ненасичені карбонільні сполуки за рахунок радикалу, що містить кратний звязок, виявляють всі властивості, зумовлені наявністю подвійного чи потрійного звязку, які було розглянуто у темах “Алкени” і “Алкіни”. Найхарактернішими для них вважаються реакції приєднання.
Окреме місце займають ,-ненасичені карбонільні сполуки, які поводять себе у реакціях приєднання дуже специфічно, оскільки карбонільна група С=О перебуває у спряженні з ,-подвійним звязком С=С. Їх взаємний вплив згідно з теорією резонансу зображують такими структурами:
+ - + -
>C=C-C=O >C=C-C-O >C-C=C-O
Таким розподіленням електронної густини пояснюється можливість конкурентного приєднання, що по аналогії з алкадієнами позначається символами 1,2- і 1,4:
Nu
1,2-приєднання
 ---------------------
>C==C-C-O-H
---------------------
>C==C-C-O-H
>C==C==O + NuH --------
H
1,4-приєднання
-------------------- -C-C=C-OH -C-C-C=O
Nu Nu
Кето-енольне перегрупування
Напрямок приєднання залежить як від будови карбонільної сполуки, так і від природи нуклеофілу: для альдегідів реакція частіше, але не виключно, проходить за 1.2-типом, а для кетонів – переважно за 1.4- топом. При прогнозуванні продуктів реакції необхідно завжди аналізувати особливості певної оксосполуки і кожного нуклеофілу, а також умови реакції. Наприклад взаємодія ,- ненасичених карбонільних сполук з магнійорганічними реагентами:
1,2 H2O
R-CH=CH-CH=O + R1-MgBr ------- R-CH=CH-CH-R1 ------------
Альдегід
OMgBr
-- R-CH=CH-CH-R1 + MgOHBr.
OH
1,4
R-CH=CH-C-R2 + R1-MgBr ------- R-CH-CH2-C-R2 + MgHBr
H2O
O R1 O
Кетон
Аміни приєднуються відповідно до 1,4:
1,4
R-CH=CH-CH=O + NH2-R1 -------- R-CH-CH2-CH=O
NH-R1
Альдегід
1,4
R-CH=CH-C-R2 + NH2-R1 -------- R-CH-CH2-C-R2
O NH-R1
Кетон
Приєднання до ,-подвійного звязку несиметричних молекул типа Н-Х проходить проти правила Марковникова, оскільки карбонільна група виявляє негативні електронні ефекти (-І, -М):
 +
-
-
+
-
-
CH2====CH CH====O + HBr --- CH2Br-CH2-CH=O
Акролеїн -Бромпропіоновий альдегід
CH2=CH-C-CH3 + HBr --- CH2Br-CH2-C-CH3
O O
Бутен-1-он-3 1-Бромбутанон-3
Ароматичні карбонільні сполуки, в яких оксогрупа виявляє негативний мезомерний ефект і знижує електронну густину на бензеновому кільці, важко вступають у реакції електрофільного заміщення, яке протікає тільки в жорстких умовах по мета-положенню
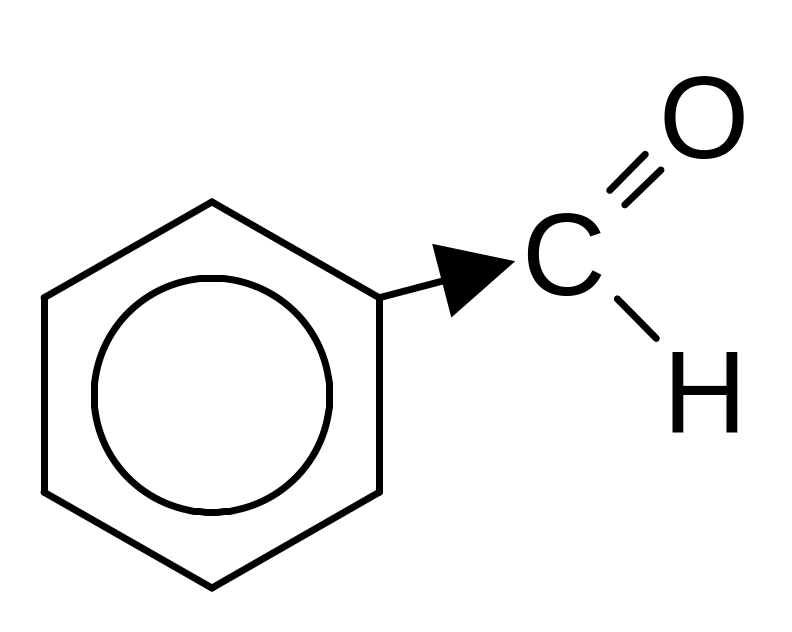


+HO-NO2 ----------- + H2O
H2SO4
Бензельдегід м-Нітробензальдегід
