
- •2.1 Гипотеза виртуальных электродов.
- •3. Эффективность электроимпульсной терапии.
- •3.1. Нарушение функции миокарда, обусловленное дефибриллирующим разрядом.
- •3.2. Значение формы волны дефибриллирующего импульса.
- •3.3. Трансторакальный импеданс.
- •4. Бифазная дефибрилляция.
- •5. Электроды для дефибрилляции.
- •6. Дефибрилляция у пациентов с имплантируемым кардиостимулятором-кардиовертером.
- •7. Концепция ранней дефибрилляции с использованием «общедоступного дефибриллятора-монитора».
- •8. Дефибрилляция в педиатрии.
- •9. Дефибрилляция в стационаре.
Основной целью дефибрилляционного шока является восстановление синхронизации сокращений сердечных волокон, нарушенной в результате желудочковой тахикардии или фибрилляции. Существует несколько теорий пытающихся объяснить механизм дефибрилляционного действия электрического шока.
Как уже упоминалось выше, самая первая теория дефибрилляции была предложена Жаном-Луи Прево (Jean-Louis Prevost) и Фредериком Бателли (Frederic Batelli), которые полагали, что аритмия прекращается благодаря временному параличу сердечной мышцы, то есть подавлению способности миоцитов генерировать потенциал действия и/или проводить возбуждение. Говоря о вызванном электрическим разрядом временном параличе сердечной мышцы, следует отметить, что, действительно, первоначальный опыт дефибрилляции в клинике и в экспериментальных моделях внезапной смерти на животных требовал прямого массажа сердечной мышцы после приложения электрического шока, поскольку механическая и электрическая активности были полностью подавлены. Позднее советские исследователи Гурвич и Юниев [9] впервые предположили, что дефибрилляцию можно осуществить применяя значительно более слабые электрические поля, вызывающие синхронную стимуляцию миокарда, а не его паралич. Последующие исследования частично подтвердили правомочность этой теории.
Основываясь на данных представлениях, Zipes D . P . с соавторами [19] создали в 1975 г. концепцию критической массы миокарда, необходимой для поддержания фибрилляции желудочков (гипотеза критической массы), которая предполагает, что успешная дефибрилляция прекращает фибрилляцию, поскольку она ликвидирует фронт активации внутри критической массы мышцы, поскольку деполяризует всю нерефрактерную ткань внутри критической массы. Итак, успешная дефибрилляция должна прерывать волновой фронт только в части миокарда.
В 1990 г. Witkovsky F . X . с соавторами [20] развили эту концепцию и сделали вывод, что продолжающаяся после разряда фибрилляция в массе менее критической может снова запустить общую фибрилляцию, и это зависит от возбудимости окружающих тканей. Поскольку все это указывает на то, что для прекращения фибрилляции нужно ликвидировать волновой фронт (хотя только этого недостаточно), роль гипотезы критической массы остается достаточно противоречивой.
Гипотеза верхнего порога уязвимости утверждает, что при дефибрилляции разряд должен не только прекращать волны фибрилляции путем удлинения рефрактерного периода миокарда, но и не должен создавать новых волновых фронтов на границе разряд-деполяризация, чтобы снова не запустить фибрилляцию желудочков. Также считается, что существует определенный предел силы разряда, выше которого разряд не индуцирует фибрилляцию желудочков в уязвимые периоды нормального ритма, и этот верхний порог уязвимости коррелирует с порогом дефибрилляции [21] . В соответствии с этой гипотезой, приложенный разряд может и не осуществить дефибрилляцию, поскольку он может активировать новый волновой фронт. По всей видимости, новый фронт re-entry и возникает там, где области слабого градиента напряжения попадают на зоны восстановленной возбудимости. Флуоресцентное оптическое картирование на изолированном сердце свиньи показало, что околопороговая дефибрилляция прекращала все волновые фронты активации фибрилляции желудочков, но не могла прекратить саму фибрилляцию, поскольку происходила повторная инициализация фибрилляции после периода электрического покоя (изоэлектрическое окно) [22] .
Гипотеза верхнего порога уязвимости очень тесно связана с гипотезой критической точки [23] , согласно которой центр re-entry возникает в точке пересечения линий критической реполяризации и критического градиента потенциала стимулирующего поля, которая, собственно, и названа критической точкой. Эта гипотеза предполагает, что электрический стимул вызывает деполяризацию мембраны, зависящую от градиента приложенного электрического поля [24] . Таким образом, дефибриллирующий разряд не должен создавать критической точки (или синхронности фаз), когда критически градиент вольтажа становится равен критической точке рефрактерности. Такие критические точки формируют re - entry , после чего снова начинается фибрилляция. Это может быть также причиной неудачной дефибрилляции. С другой стороны, при успешной дефибрилляции, удлиняется рефрактерный период миокарда, поэтому новые активирующие волновые фронты не создаются.
Jones J. L. и Tovar O. H. описали «удлинение рефрактерности», как основной механизм дефибрилляции [25, 26]. Вызванная разрядом деполяризация фибриллирующего миокарда удлиняет рефрактерный период к волновым фронтам, поэтому прекращается фибрилляция. Эта гипотеза позволяет объяснить, почему двухфазная дефибрилляция эффективнее, и об этом мы будем говорить ниже. Удлинение рефрактерного периода, вызванное разрядом, хорошо также согласовывается с гипотезой верхнего порога уязвимости , т.к. невозможность удлинения рефрактерного периода объясняет, почему после разряда снова начинается фибрилляция.
Dillon S. M. и Kwaku K. F. [27] разработали гипотезу, в которой они назвали дефибрилляцию «прогрессирующей деполяризацией». Эта гипотеза гласит, что сильный разряд деполяризует рефрактерный миокард, что предупреждает появление новых волновых фронтов после разряда [28, 29]. Такие разряды также удлиняют и синхронизируют последующую реполяризацию, что снижает вероятность развития повторной фибрилляции [30]. Таким образом, восстановление синхронизации сердечной деятельности происходит из-за индуцированного шоком удлинения рефрактерного периода и длительности потенциала действия. Dillon S. M. [30] предположил, что данная теория объединяет в себе концепции критической массы, верхнего порога уязвимости и удлинения рефрактерного периода в одну общую гипотезу.
Karagueuzian H.S. и Chen P-S. [31 - 33] предложили другую теорию, в которой они фактически описали ту же самую гипотезу верхнего порога уязвимости на клеточном уровне. Фундаментальным принципом их теории является то, что разряд вызывает ступенчатую реакцию, амплитуда и продолжительность которой может нарастать (прогрессирующая деполяризация) по мере увеличения силы стимула. Интенсивные стимулы удлиняют рефрактерный период таким образом, что односторонний блок превращается в двухсторонний. Эта гипотеза опять же позволяет объяснить большую эффективность бифазных дефибриллирующих разрядов, поскольку она основывается на превращении одностороннего блока в двусторонний. Усиление реполяризации в фазу гиперполяризации двухфазного разряда сменяется деполяризацией, в результате чего удлиняется время реполяризации и рефрактерный период, что предотвращает формирование волнового фронта и механизма re - entry .
Следует отметить, что все описанные выше гипотезы дефибрилляции были основаны на классической теории аритмогенеза. Эта теория не могла быть проверена прямыми измерениями до недавнего времени из-за того, что измерение электрической активности существовавшими электродными методами во время приложения шока невозможно из-за сильного артефакта вызванного этим шоком. Электрическая активность могла быть зарегистрирована лишь через десятки миллисекунд после шока [24]. Исследования с помощью флюоресцентных красителей, наконец, разрешили эту загадку и способствовали появлению «гипотезы виртуальных электродов». Эта гипотеза родилась совсем недавно и позволяет объяснить причины эффективности и неудач дефибрилляции. Поскольку она целиком основана на новой терминологии, мы решили подробно описать ее в следующей отдельной главе.
2.1 Гипотеза виртуальных электродов.
Как мы уже показали в первой главе, исследования фундаментальных механизмов электрокардиостимуляции и дефибрилляции имеют очень длинную историю, насчитывающую более трёх столетий. Однако, эти исследования были затруднены отсутствием адекватных теоретических и экспериментальных методов, позволявших предсказывать и измерять трансмембранный потенциал во время электрокардиостимуляции и дефибрилляции. Классические электродные методы, разработанные в XIX и XX столетиях, и остававшиеся единственным методом исследований в фундаментальных и клинических лабораториях, не позволяли вести измерения трансмембранного потенциала из-за артефактов возникающего во время нанесения на миокард электрических стимулов. Параллельно с экспериментальными сложностями, теоретические концепции электрокардиостимуляции и дефибрилляции также не могли объяснить многих эмпирически установленных фактов.
Необходимые адекватные экспериментальные и теоретические методики появились лишь в последние два десятилетия XX века. К таким экспериментальным методикам относится оптическое флюоресцентное картирование трансмембранного потенциала с помощью потенциал-чувствительных красителей [34] . Кроме того, в конце XX столетия в качестве основного подхода при теоретическом и численном исследовании макроскопических электрических явлений в сердечной ткани получила широкое распространение теоретическая методика, основанная на формализме бидоменных моделей . В русскоязычной литературе эта тема была исчерпывающе изложена в публикации И.Р.Ефимова, А.Т.Самбелашвили, В.Н.Никольского «Прогресс в изучении механизмов в электрической стимуляции сердца» (Вестник аритмологии, 2002 г., N 27-29) и других работах данной научной группы.
Теоретическая бидоменная модель миокарда основана на представлении сердечной мышцы в виде двух взаимосвязанных трехмерных пространств - внутриклеточного и внеклеточного, каждое из которых имеет различные коэффициенты проводимости вдоль и поперек направления волокон [35-39] .
Эти два пространства соединены между собой пассивным током через сопротивление мембраны и активными ионными токами, зависящими от трансмембранного потенциала и времени. В покое, между двумя пространствами существует разница потенциалов, известная как потенциал покоя, равная -80-90 мВ. Для возникновения и распространения волны возбуждения необходима начальная деполяризация сердечной мембраны в сравнительно небольшой группе клеток. Следует отметить, что точечные ионные механизмы деполяризации на клеточном уровне хорошо известны и достаточно детально описаны. Однако именно пространственные механизмы деполяризации до последнего времени оставались малоизученными. Бидоменная модель миокарда и оптическое флюоресцентное картирование позволили значительно продвинуть исследования именно пространственных механизмов электрокардиостимуляции и дефибрилляции.
В отличие от предыдущих теоретических подходов, бидоменный формализм не игнорирует внеклеточного пространства, которое обычно полагалось эквипотенциальным и заземлённым. Благодаря бидоменному подходу было выявлено, что причиной электрической активации сердечной мышцы могут быть как неоднородности внешнего электрического поля, так и неоднородности внутриклеточной проводимости сердечной мышцы.
Важно подчеркнуть, что до недавнего времени неоднородности в самой сердечной ткани не принимались во внимание, и возбуждение клеток связывалось в основном с градиентом внеклеточного потенциала, который рассматривался в качестве единственного параметра, способного предсказывать результат дефибрилляции. Так множество фундаментальных и клинических исследований полагали, что для успешной дефибрилляции достаточно обеспечить во всех областях сердца градиент внеклеточного потенциала больше 5 В/см [24] , что считалось достаточным для восстановления электрической функции всего сердца. Однако, как показывали недавние теоретические и экспериментальные исследования, неоднородность в самой сердечной ткани может играть очень важную роль [40] .
Не будет преувеличением сказать, что прогресс в биологии второй половины XX века в значительной части был обусловлен изобретением и широким применением флюоресцентных методов исследования на всех уровнях живой ткани: молекулярном, клеточном, тканевом, органа и всего организма. Флюоресцентные методы позволяют измерять различные параметры живой системы с беспрецедентной чувствительностью и специфичностью. Так, современные методы позволяют обнаруживать присутствие единичных молекул в сложных физиологических системах, измерять концентрацию ионов и электрические потенциалы внутри и на мембранах клеточных органелл во время сложных физиологических процессов.
Флюоресцентные методы измерения электрической активности сердца обладают несколькими решающими преимуществами, определившими этот успех:
оптические методы не чувствительны к электрическим артефактам, вызываемым стимулом в отличие от любых электродных методов записи электрической активности сердца
временное разрешение оптических измерений превышает временное разрешение электродных измерений, включая микроэлектродные [41]
оптические методы позволяют осуществлять записи трансмембранного потенциала без искажений со многих сотен и даже тысяч мест отведения с практически любым необходимым пространственным разрешением, определяемым оптикой и электроникой [42]
Флюоресцентные методы исследований электрической активности поистине революционизировали электрофизиологию сердца за последние десять лет. В англоязычной литературе существует множество прекрасных обзоров и книг по флюоресцентным методам. В частности среди наиболее свежих обзоров необходимо отметить несколько прекрасных сборников, составленных ведущими лабораториями мира в этой области [43- 45] . Отечественная литература по оптическим исследованиям в области электрофизиологии сердца, к сожалению, не столь обширна [46] .
Оптические измерения трансмембранного потенциала были задуманы американским исследователем проф. Larry Cohen. Идея была основана на свойствах специально синтезированных молекул-флюорофоров, которые, связавшись с клеточной мембраной, способны поглощать и излучать свет с эффективностью, зависящей от величины электрического поля, в котором находится эта молекула. Таким образом, осветив сердце, прокрашенное флюорофором, можно оптически измерить кинетику трансмембранного потенциала по изменениям интенсивности или длины волны флюоресценции. Более того, используя современные методы двухмерной регистрации света, можно составлять карты изменения трансмембранного потенциала на поверхности сердца [47, 48] .
Оптическая природа измерений позволяет изменять пространственное разрешение картирования сигналов путём простой замены оптического увеличения. В настоящее время картирование трансмембранного потенциала осуществляется в широком диапазоне пространственного масштаба: от единичной клетки [49] до целого сердца [48] .
В 1989 г. группой проф. John Wikswo [50] был выполнен ряд экспериментов с точечной электростимуляцией плоской двумерной модели сердечной ткани. Было показано, что после приложения точечного стимула вблизи стимулирующего электрода образуются характерная картина смежных областей деполяризации и гиперполяризации как результат неравной анизотропии вне- и внутриклеточного пространств (см. рис. 13AB).
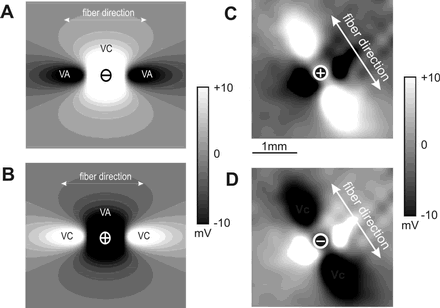
Рис. 13. Виртуальные электроды при точечной электростимуляции миокарда. А - центральный виртуальный катод (VC) и виртуальные аноды (VA) при электростимуляции катодным током в двумерной бидоменной модели; B - виртуальные электроды при электростимуляции анодным током в двумерной бидоменной модели; C - экспериментальная картина распределения трансмембранной поляризации на поверхности эпикарда при катодной ЭС; D - экспериментальная картина, соответствующая анодной электростимуляции. (Заимствовано из публикации И.Р.Ефимова, А.Т.Самбелашвили, В.Н.Никольского «Прогресс в изучении механизмов в электрической стимуляции сердца», Вестник аритмологии, 2002 г., N 27).
Этой характерной формы области поляризации в виде «собачьей кости» (dog-bone shape) не наблюдается в случае, если отношения проводимостей для этих внутри- и внеклеточного пространств одинаковое (случай равной анизотропии обоих пространств) - точка электростимуляции тогда просто окружена эллипсом равномерно спадающей деполяризации/гиперполяризации при катодном/анодном стимуле [51] .
Таким образом, неравная анизотропия двух пространств обусловливает образование смежных областей противоположной поляризации, получивших название виртуальных анодов (гиперполяризация) и виртуальных катодов (деполяризация). Это определение виртуальных электродов справедливо для стимуляции электрическими полями любой пространственной конфигурации, а не только при точечной электростимуляции. Положительная часть функции активации соответствует виртуальному катоду, так как она приводит к деполяризации, в то время как отрицательная часть функции активации соответствует виртуальному аноду, вызывающему гиперполяризацию.
Описанные результаты предложили убедительное объяснение феномену анодной электростимуляции, которую не могли объяснить в рамках классической теории, основанной на кабельном уравнении. Согласно этой теории, анодная электростимуляция гиперполяризует ткань непосредственно под электродом, что ставило в тупик многие поколения исследователей, не понимавших, как гиперполяризация может вызвать в конечном итоге потенциал действия, наблюдавшийся экспериментально. Бидоменная теория показала, что одновременно с виртуальными анодом (гиперполяризацией) возле электрода существуют виртуальные катоды на некотором расстоянии от него вдоль направления волокон (см. светлые области на рис. 13B). Именно в этих областях развивается деполяризация, и, при достаточной интенсивности стимула, возможно достижение порога возбуждения с последующей активацией сердечной мышцы.
Гипотеза виртуальных электродов получила блестящее подтверждение в экспериментах с использованием флюоресцентных красителей для картирования трансмембранного потенциала на поверхности эпикарда во время монополярной (см. рис. 13) и биполярной (см рис. 14) электростимуляции.
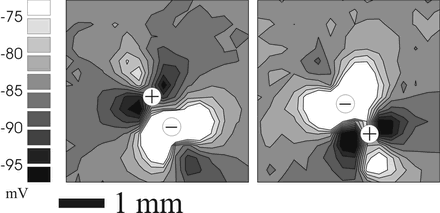 Рис.
14. Виртуальные электроды при биполярной
ЭС миокарда. Распределение трансмембранного
потенциала на поверхности сердца кролика
было записано с помощью флуоресцентного
красителя di-4-ANEPPS и системы оптического
картирования. Положение анода и катода
отмечено знаками + и - соответственно.
(Заимствовано из публикации И.Р.Ефимова,
А.Т.Самбелашвили, В.Н.Никольского
«Прогресс в изучении механизмов в
электрической стимуляции сердца»,
Вестник аритмологии, 2002 г., N 27).
Рис.
14. Виртуальные электроды при биполярной
ЭС миокарда. Распределение трансмембранного
потенциала на поверхности сердца кролика
было записано с помощью флуоресцентного
красителя di-4-ANEPPS и системы оптического
картирования. Положение анода и катода
отмечено знаками + и - соответственно.
(Заимствовано из публикации И.Р.Ефимова,
А.Т.Самбелашвили, В.Н.Никольского
«Прогресс в изучении механизмов в
электрической стимуляции сердца»,
Вестник аритмологии, 2002 г., N 27).
Этот совместный успех бидоменной модели и флюоресцентной техники дал толчок интенсивным исследованиям кардиоэлектростимуляции и дефибрилляции в рамках данной концепции. В частности, было показано теоретически, что для пассивной модели геометрия виртуальных электродов не зависит от силы тока, а определяется лишь значениями проводимостей, характеризующих среду [38].
Таким образом, гипотеза «виртуальных электродов», известная также под названием «гипотеза поляризации виртуального электрода», описывает комплексную глобальную поляризацию миокарда, характеризующуюся одновременным наличием областей положительного и отрицательного зарядов, которые прилежат друг к другу. В свете этой гипотезы становятся понятными причины неудачной дефибрилляции и возникновения новой аритмии по механизму re-entry, индуцированной приложенным разрядом. После дефибрилляционного шока в результате проявления эффекта виртуальных электродов длительность потенциала действия и рефрактерного периода действительно удлиняются в некоторых областях поверхности сердца, но одновременно укорачиваться в других. Эти области соответствуют зонам положительной и отрицательной поляризации во время действия стимула. Следовательно, виртуальные электроды порождают неоднородную реполяризацию, способную препятствовать успешной дефибрилляции путём индуцирования новой аритмии по механизму re-entry.
По сути дела «поляризация виртуального электрода» - это перераспределение заряда между соседними зонами миокарда [52] . Поэтому одиночные кардиомиоциты также могут иметь трансмембранную поляризацию (реполяризацию и деполяризацию), вызванную перераспределением общего заряда [53] . Гипотеза поляризации виртуального электрода описывает эти изменения в крупных зонах миокарда. Индуцированная дефибрилляцией аритмия (по типу механизма re-entry) может развиться вследствие близости зон положительного и отрицательного заряда, созданных разрядом. Возбуждение после разряда возрастает на границах между положительно и отрицательно заряженными зонами. Механизм этого явления называется «взрывным возбуждением». Это послеразрядное (прорывное или взрывное) возбуждение проходит через возбужденные зарядом зоны (послеразрядный всплеск), и, если соседние деполяризованные области восстановили возбудимость, формируется контур повторного входа [54, 55].
Однофазный дефибриллирующий разряд недостаточной интенсивности будет не способен создать необходимый градиент вольтажа, чтобы вызвать волну повторного возбуждения, которая ликвидирует поляризацию виртуальных электродов. Вследствие этого формируется контур повторного входа, обусловленный данным разрядом. Успешная однофазная дефибрилляция, при которой разряд превосходит верхний порог уязвимости, не вызовет таких волновых фронтов повторного входа. Следовательно, для того, чтобы гарантировать самопрекращение шок-индуцированного re-entry, необходимо повысить силу монофазного стимула. При этом восстановление возбудимости в областях отрицательной поляризации будет настолько полным, что их последующая активация произойдет очень быстро и фронт re-entry возбуждения угаснет, столкнувшись со все еще рефрактерной областью положительной поляризации, которая не успеет восстановиться за короткое время проведения фронта. Более щадящий метод - устранить нежелательную поляризацию после окончания стимула, приложив электрический стимул обратной полярности и меньшей интенсивности.
Преимуществом оптимального двухфазного разряда является то, что вторая фаза разряда способна асимметрично обращать положительный и отрицательный заряды, и для обращения отрицательного заряда требуется гораздо меньше энергии. Однофазные разряды гораздо чаще вызывают новые фибрилляции и поддерживают существующие аритмии, поскольку они создают критические точки (сингулярность фаз), тогда как оптимальный двухфазный разряд провоцирует такие отрицательные побочные эффекты дефибрилляции гораздо реже. Однофазные разряды чаще бывают неэффективными, поскольку они не только не обрывают фибрилляции, но и сами же создают волновые фронты повторного входа, и тем самым поддерживают фибрилляцию.
Большинство информации о явлении поляризации виртуального электрода было получено в исследованиях на изолированном сердце кролика и на двумерных тканевых моделях. Эта гипотеза требует дальнейшего подтверждения на изолированном сердце крупных млекопитающих до того, как ее можно будет уверенно экстраполировать на сердце человека. Впрочем, это относится ко всем гипотезам дефибрилляции.
Тем не менее, все данные, полученные в исследованиях по гипотезе поляризации виртуального электрода, позволяют понять, какие глобальные электрофизиологические сдвиги происходят в миокарде. Эти исследования открывают путь к более точному определению того, как происходит трехмерное распределение электрического заряда в миокарде, когда на сердце воздействует разряд, и помогают понять, почему же происходит дефибрилляция. Это безусловно должно привести к созданию более эффективных режимов дефибрилляции для клинического применения.
Cложность механизмов действия однофазной и двухфазной дефибрилляции и достаточно противоречивая их интерпретация обсуждались в редакционной статье Ideker с соавт. [56] . Авторы этой статьи обратили особое внимание на то, что большинство исследований и предложенных механизмов действия дефибрилляции частично могут быть правильными, но в то же самое время практически все они некорректны, поскольку их никак нельзя назвать полными. Многие из предложенных механизмов действия должны быть унифицированы и приведены к фибрилляции у человека, поскольку пока не проводились исследования именно в условиях хронической структурной патологии сердца человека. Только такие исследования смогут показать четкую картину фибрилляции у человека, и что происходит при однофазной и двухфазной дефибрилляции.
