
- •2.1 Гипотеза виртуальных электродов.
- •3. Эффективность электроимпульсной терапии.
- •3.1. Нарушение функции миокарда, обусловленное дефибриллирующим разрядом.
- •3.2. Значение формы волны дефибриллирующего импульса.
- •3.3. Трансторакальный импеданс.
- •4. Бифазная дефибрилляция.
- •5. Электроды для дефибрилляции.
- •6. Дефибрилляция у пациентов с имплантируемым кардиостимулятором-кардиовертером.
- •7. Концепция ранней дефибрилляции с использованием «общедоступного дефибриллятора-монитора».
- •8. Дефибрилляция в педиатрии.
- •9. Дефибрилляция в стационаре.
8. Дефибрилляция в педиатрии.
Фибрилляция желудочков и желудочковая тахикардия без пульса у детей встречаются крайне редко. Тем не менее, ребенку с такой патологией требуется немедленная кардиоверсия.
Выбор электродов или электродов-пластырей для детей основан на следующих принципах: электроды должны быть такого размера, чтобы они не соприкасались, но при этом покрывали достаточную площадь грудной стенки ребенка, чтобы снизить трансторакальный импеданс и потерю энергии заряда [109, 110] . При проведении дефибрилляции у маленьких детей необходимо внимательно следить за тем, чтобы гель не размазывался и не замыкал оба электрода, так как это значительно снижает эффективность дефибрилляции [111] . Специальные электроды для младенцев применяют в тех случаях, когда вес ребенка не превышает 10 кг. Во всех остальных случаях применяют стандартные электроды, если только они не соприкасаются друг с другом. Электроды можно располагать либо спереди (один справа под ключицей, второй – в области верхушки сердца), или один – слева от грудины, а второй – на спинке ребенка [112] .
Обычно величину необходимого разряда у детей определяют по массе тела – 2 Дж на кг массы тела при фибрилляции желудочков или желудочковой тахикардии с остановкой кровообращения [113-114] . Если этого недостаточно, то энергию разряда увеличивают до 4 Дж/кг и повторяют, таким же должен быть и третий разряд.
Поскольку стандартные автоматические дефибрилляторы не позволяют программировать разряд, то их не применяют у детей младше 8 лет, или с весом менее 25 кг. Данных о применении подобных дефибрилляторов у более старших детей тоже очень мало. Недавно FDA одобрила применение педиатрического автоматического дефибриллятора, который дает соответствующий разряд – меньший, чем для взрослых. У детей младше 8 лет двухфазная дефибрилляция пока не применялась, а вот у старших детей эта процедура признана показанной. Однако, в этой области требуются еще дальнейшие тщательные исследования.
9. Дефибрилляция в стационаре.
В больницах должно уделяться особенно пристальное внимание своевременному проведению дефибрилляции. К сожалению, все уверены в том, что при необходимости реанимации уж в больнице-то все всегда будет сделано вовремя. Увы, на самом деле оказывается, что во многих больницах до этого очень далеко, причем не всегда средний персонал способен выполнять дефибрилляцию до появления врача. Оказалось, что в таких местах, как казино и аэропорты, добровольцы были лучше обучены и действовали более эффективно, чем медперсонал в больницах. Вот почему в течение последних десятилетий смертность от остановки кровообращения в больницах оставалась стабильной. Специальные исследования [115-116] показали, что в больнице между диагностикой остановки кровообращения и процедурой дефибрилляции проходит 5-10 минут (то есть как раз именно столько времени, сколько примерно из отделения интенсивной терапии бежит реанимационная бригада). К сожалению, администрация многих больниц все еще уделяет внимание именно быстроте бега реаниматологов, а не времени оказания реальной помощи. На самом деле необходима ранняя дефибрилляция, и безразлично, кто это сделает [117] . Чтобы выиграть драгоценное время, необходимо специально обучать процедуре дефибрилляции сестер [118-119].
Итак, пользованию автоматическими дефибрилляторами следует обучать всех, кто теоретически может оказывать первую помощь – то есть, медсестер и другой персонал больницы, причем делать это надо повсеместно [120-121].
Руководство Американской кардиологической ассоциации [80] рекомендует проводить обучение всего персонала стационара и амбулаторных отделений оказанию первой помощи с использованием автоматических дефибрилляторов.
Эксперты на Международной конференции по руководствам в 2000 г. решили, что стандартом реанимации должно стать время проведения дефибрилляции – в течение 3 ± 1 минуты после регистрации остановки кровообращения [80].
Недавно организацией по аккредитации учреждений здравоохранения США были разработаны стандарты по реанимации в условиях стационара [122] . Согласно этим стандартам от больниц требуется следующее:
В больнице должно быть размещено соответствующее оборудование для реанимации и дефибрилляции, в основном там, где его применение наиболее вероятно.
Лечебное учреждение должно обеспечить обучение персонала приемам реанимации и пользованию дефибриллятором.
Список литературы.
1. J. Snow. On asphyxia and on the resuscitation of still-born children. Lond Med Gaz 29, 1841, pp. 222-227.
2. J. Snow. On Cholorform and Other Anaesthetics. London, John Churchill, 1858.
3. Roth N. First stammering of the heart: Ludwig's kymograph. Med Instrum 12:348, 1978.
4. McWilliam J.A. Cardiac failure and sudden death. BMJ 5 : 6-8, 1989.
5. Beck C.S. Prevost and Battelli. Ariz Med 22:691-694, 1965.
6. Hyman A.S. Resuscitation of the stopped heart by intracardial therapy. Arch Intern Med. 1932;50:283.
7. Beck C.S, Pritchard W.H, Feil S.A. Ventricular fibrillation of long duration abolished by electric shock. JAMA 1947; 135: 985-989.
8. Wiggers C.J., Wegria R. Ventricular fibrillation due to single localized induction in condenser shock supplied during the vulnerable phase of ventricular systole. Am J Physiol 1939; 128:500.
9. Gurvich N.L., Yuniev G.S. Restoration of regular rhythm in the mammalian fibrillating heart. Byulletin Eksper Biol & Med. 1939;8:55-58.
10. Bigelow W.G., Callaghan J.C., Hopps J.A. General hypothermia for experimental intracardiac surgery. Ann Surg 1950; 1132: 531-539.
11. Zoll P.M. Development of Electric Control of Cardiac Rhythm. Lasker Awards. JAMA 1973; 226:881-882.
12. Zoll P.M. Resuscitation of the Heart in Ventricular Standstill by External Electric Stimulation. New Eng J Med 1952; 247: 768-771.
13. Zoll P.M., Linenthal A.J., Norman L.R., Belgard A.H. Treatment of Stokes-Adams Disease by External Electric Stimulation of the Heart. Circulation 1954; 9:482-493.
14. Zoll P.M., Linethal A.J., Gibson W., et al. Termination of ventricular fibrillation in man by externally applied electric shock. N Engl J Med. 1956;254:727.
15. Lown B., Amarasingham R., Neuman J. New method for terminating cardiac arrhythmias. Use of synchronized capacitor discharge. JAMA 1962;182:548-55.
16. Jude J.R., Kouwenhoven W.B., Knickerbocker G.G. An experimental and clinical study of a portable external cardiac defibrillator. Surg Forum 1962;13:185-7.
17. Kouwenhoven W.B. The development of the defibrillator. Ann Intern Med 1969;71:449-57.
18. Edmark K.W., Thomas G.I., Jones T.W. DC pulse defibrillation. J Thorac Cardiovasc Surg 1966;51:326-33.
19. Zipes D.P., Fischer J., King R.M., et al. Termination of ventricular fibrillation in dogs by depolarizing a critical amount of myocardium. Am J Cardiol 1975;36:37-44.
20. Witkowski F.X., Penkoske P.A., Plonsey R. Mechanism of cardiac defibrillation in open-chest dogs with unipolar DC-coupled simultaneous activation and shock potential recordings. Circulation 1990;82:244-60.
21. Chen P-S., Shibata N., Dixon E.G., et al. Comparison of the defibrillation threshold and the upper limit of ventricular vulnerability. Circulation 1986;73:1022-8.
22. Wang N.C., Lee M.H., Ohara T., et al. Optical mapping of ventricular defibrillation in isolated swine right ventricles. Demonstration of a postshock isoelectric window after near-threshold defibrillation shocks. Circulation 2001;104:227-33.
23. Lindblom A.E., Roth B.J., Trayanova N.A. Role of virtual electrodes in arrhythmogenesis: pinwheel experiment revisited. J Cardiovasc Electrophysiol 2000;11:274-85.
24. Frazier D.W., Wolf P.D., Wharton J.M. et al. Stimulus-Induced Critical Point. Mechanism for Electrical Initiation of Reentry in Normal Canine Myocardium. J.Clin.Invest. 1989; 83 (3): 1039-52.
25. Jones J.L., Tovar O.H. The mechanism of defibrillation and cardioversion. Proc IEEE 1996;84:392-403.
26. Tovar O.H., Jones J.L. Relationship between "extension of refractoriness" and probability of successful defibrillation. Am J Physiol 1997;272:H1011-9.
27. Dillon S.M., Kwaku K.F. Progressive depolarization: a unified hypothesis for defibrillation and fibrillation induction by shocks. J Cardiovasc Electrophysiol 1998;9:529-52.
28. Dillon S.M. Optical recordings in the rabbit heart show that defibrillation strength shocks prolong the duration of depolarization and the refractory period. Circ Res 1991;69:842-56.
29. Kwaku K.F., Dillon S.M. Shock-induced depolarization of refractory myocardium prevents wave-front propagation in defibrillation. Circ Res 1996;79:957-73.
30. Dillon S.M. Synchronized repolarization after defibrillation shocks. A possible component of the defibrillation process demonstrated by optical recordings in rabbit heart. Circulation 1992;85:1865-78.
31. Karagueuzian H.S., Chen P-S. Cellular mechanism for reentry induced by a strong electrical stimulus: Implications for fibrillation and defibrillation. Cardiovasc Res 2001;50:251-62.
32. Karagueuzian H.S., Chen P-S. Fibrillation and defibrillation: the odd couple? J Cardiovasc Electrophysiol 2000;11:642-4.
33. Chen P-S, Swerdlow CD, Hwang C, et al. Current concepts of ventricular defibrillation. J Cardiovasc Electrophysiol 1998;9:553-62.
34. Davila H.V., Salzberg B.M., Cohen L.B., Waggoner A.S. A Large Change in Axon Fluorescence That Provides a Promising Method for Measuring Membrane Potential. Nat New Biol 1973; 241 (109): 159-60.
35. Muler A.L., Markin V.S. Electrical Properties of Anisotropic Neuromuscular Syncytia. II. Distribution of a Flat Front of Excitation. Biofizika 1977; 22 (3): 518-22.
36. Muler A.L., Markin V.S. Electrical Properties of Anisotropic Neuromuscular Syncytia. III. Steady State of the Front of Excitation. Biofizika 1977; 22 (4): 671-5.
37. Tung L. A bidomain model for describing ischemia myocardial DC potentials. Ph.D. dissertation. Massachusetts Institute of Technology; 1978.
38. Henriquez C.S. Simulating the Electrical Behavior of Cardiac Muscle Using the Bidomain Model. Crit Rev Biomed Eng 1993; 21: 1-77.
39. Noble D. The Initiation of the Heartbeat. Oxford: Clarendon Press; 1975.
40. Knisley S. B., Trayanova N., Aguel F. Roles of Electric Field and Fiber Structure in Cardiac Electric Stimulation. Biophys.J 1999; 77 (3): 1404-17.
41. Windisch H., Muller W., Tritthart H. A. Fluorescence Monitoring of Rapid Changes in Membrane Potential in Heart Muscle. Biophysical Journal 1985; 48(6): 877-84.
42. Rosenbaum D.S., Jalife J. Optical mapping of cardiac excitation and arrhythmias. Armonk, NY: Futura Publishing; 2002.
43. Optical mapping of cardiac excitation and arrhythmias. Armonk, NY: Futura Publishing; 2002.
44. Mason W.T. Fluorescent and Luminescent Probes for Biological Activity: A practical Guide to Technology for Quantitative Real-Time Analysis. 2nd ed. San Diego: Academic Press; 1999.
45. Mason W.T., Fluorescent and Luminescent Probes for Biological Activity: A practical Guide to Technology for Quantitative Real-Time Analysis. San Diego: Academic Press; 1993.
46. Efimov I.R., Sidorov V.Y. Optical Mapping of the Cardiac Electrical Activity. Kardiologiya 2000; 40 (8): 38-52.
47. Dillon S., Morad M.A New Laser Scanning System for Measuring Action Potential Propagation in the Heart. Science 1981; 214 (4519): 453-6.
48. Efimov I.R., Huang D.T., Rendt J.M., Salama G. Optical Mapping of Repolarization and Refractoriness From Intact Hearts. Circulation 1994; 90 (3): 1469-80.
49. Windisch H., Ahammer H., Schaffer P. et al. Optical Multisite Monitoring of Cell Excitation Phenomena in Isolated Cardiomyocytes. Pflugers Archiv - European Journal of Physiology 1995; 430 (4): 508-18.
50. Sepulveda N.G., Roth B.J., Wikswo J.P. Current Injection into a Two-Dimensional Anisotropic Bidomain. Biophysical Journal 1989; 55 (5): 987-99.
51. Latimer D.C. and Roth B.J. Effect of a Bath on the Epicardial Transmembrane Potential During Internal Defibrillation Shocks. IEEE Trans.Biomed.Eng. 1999; 46: 612-4.
52. Efimov IR, Aguel F, Cheng Y, et al. Virtual electrode polarization in the far field: implications for external defibrillation. Am J Physiol Heart Circ Physiol 2000;279:H1055-70.
53. Efimov IR, Cheng Y, Van Wagoner DR, et al. Virtual electrode-induced phase singularity. A basic mechanism of defibrillation failure. Circ Res 1998;82:918-25.
54. Efimov IR, Cheng Y, Yamanouchi Y, et al. Direct evidence of the role of virtual electrode-induced phase singularity in success and failure of defibrillation. J Cardiovasc Electrophysiol 2000;11:861-8.
55. Efimov I.R, Gray R.A, Roth B.J. Virtual electrodes and deexcitation: new insights into fibrillation induction and defibrillation. J Cardiovasc Electrophysiol 2000;11:339-53.
56. Ideker R.E., Chattipakorn N., Gray R.A. Defibrillation mechanisms: the parable of the blind men and the elephant. J Cardiovasc Electrophysiol 2000;11:1008-13.
57. Osswald S., Trouton T.G., O'Nunain S.S., et al. Relation between shock-related myocardial injury and defibrillation efficacy of monophasic and biphasic shocks in a canine model. Circulation. 1994;90:2501-2509.
58. Fast V.G., Cheek E.R. Optical mapping of arrhythmias induced by strong electrical shocks in myocyte cultures. Circ Res. 2002;90:664-670.
59. Kodama I., Shibata N., Sakuma I., et al. Aftereffects of high-intensity DC stimulation on the electromechanical performance of ventricular muscle. Am J Physiol. 1994;267:H248-H258.
60. Yabe S., Smith W.M., Daubert J.P., et al. Conduction disturbances caused by high current density electric fields. Circ Res. 1990;66:1190-1203.
61. Stickney R. E., Doherty A., Kudenchuk P. J., et al. Survival and Postshock ECG Rhythms for Out-of-Hospital Defibrillation. PACE 22(4-II), 740. 1999.
62. Jones J.L., Milne K.B. Dysfunction and safety factor strength-duration curves for biphasic defibrillator waveforms. Am J Physiol 1994;266:H263-71.
63. Jones J.L., Jones R.E., Balasky G. Microlesion formation in myocardial cells by high-intensity electric field stimulation. Am J Physiol 1987;253:H480-6.
64. Jones J.L., Lepeschkin E., Jones R.E., et al. Response of cultured myocardial cells to countershock-type electric field stimulation. Am J Physiol 1978;235:H214-22.
65. Jones J.L., Proskauer C.C., Paull W.K., et al. Ultrastructural injury to chick myocardial cells in vitro following "electric countershock". Circ Res 1980;46:387-94.
66. Tovar O., Tung L. Electroporation of cardiac cell membranes with monophasic or biphasic rectangular pulses. Pacing Clin Electrophysiol. 1991;14:Pt 2):1887-92.
67. Chizmadzhev Y.A., Kuzmin P.I., Kumenko D.A., et al. Dynamics of fusion pores connecting membranes of different tensions. Biophys J. 2000;78:2241-2256.
68. Tung L., Tovar O., Neunlist M., et al. Effects of strong electrical shock on cardiac muscle tissue. Ann N Y Acad Sci. 1994;720:160-75.
69. Gurvich N.L. The Main Principles of Cardiac Defibrillation. 1975. Medicine, Moscow.
70. Al-Khadra A.S., Nikolski V., Efimov I.R. The role of electroporation in defibrillation. Circ Res. 2000;87:797-804.
71. Walcott G.P., Knisley S.B., Zhou X., et al. On the mechanism of ventricular defibrillation. Pacing Clin Electrophysiol. 1997; 20: Pt 2: 422-31. 72. Chen P.S., Wolf P.D., Ideker R.E. Mechanism of cardiac defibrillation. A different point of view. Circulation. 1991;84:913-919.
73. Fabiato A., Coumel P., Gourgon R., Saumont R. The threshold of synchronous response of the myocardial fibers. Application to the experimental comparison of the efficacy of different forms of electroshock defibrillation. Arch Mal Coeur Vaiss. 1967;60:527-544.
74. Efimov I.R., Cheng Y., Van Wagoner D.R., et al. Virtual electrode-induced phase singularity: a basic mechanism of failure to defibrillate. Circ Res. 1998;82:918-925.
75. Cheng Y., Mowrey K.A., Van Wagoner D.R., et al. Virtual Electrode Induced Re-excitation: A Basic Mechanism of Defibrillation. Circ Res. 1999;85:1056-1066.
76. Dahl C., Ewy G., Warner E. Myocardial necrosis from direct current countershock. Circulation 50:956-957, 1974.
77. Kerber R.E., Martin J.B., Kienzle M.G., et al. Energy, current, and success in defibrillation and cardioversion: Clinical studies using an automated impedance-based method of energy adjustment. Circulation 77:1038-1046, 1988.
78. Weaver W.D., Cobb L.A., Coppas M.K., et al: Ventricular defibrillation: A comparative trial using 175J and 320J shocks. N Engl J Med 307:1101-1106, 1982.
79. Schneider T., Martens P.R., Paschen H., et al. Multicenter, randomized, controlled trial of 150-J biphasic shocks compared with 200- to 360-J monophasic shocks in the resuscitation of out-of-hospital cardiac arrest victims. Circulation 102:1780-1787, 2000. 80. American Heart Association Guidelines 2000 for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation 102:I-63, 2000.
81. Geddes L.A., Tacker W.A., Cabler P., et al. Decrease in transthoracic impedance during successive vertricular defibrillation trials. Med Instrum 9:179-180, 1975.
82. Kerber R.E., Grayzel J., Hoyt R., et al. Transthoracic resistance in human defibrillation: Influence of body weight, chest size, serial shocks, paddle size and paddle contact pressure. Circulation 63:676-682, 1981.
83. Ewy G.A., Hellman D.A., McClung S., et al. Influence of ventilation phase on transthoracic impedance and defibrillation effectiveness. Crit Care Med 8:164-166, 1980.
84. Sima S.J., Fergusen D.W., Charbonnier F., et al. Factors affecting transthoracic impedance during electrical cardioversion. Am J Cardiol. 62:1048-1052, 1988.
85. Sima S.J., Kieso R.A., Fox-Eastham K.J., et al. Mechanisms responsible for the decline in transthoracic impedance after DC shocks. Am J Physiol 257(pt 2):H1180-H1183, 1989.
86. Kerber R.E. Energy requirements for defibrillation. Circulation. - 1986. - Vol. 74. -Suppl. IV. - P. IV-117 - IV-120.
87. Cummins R.O., Hazinski M.F., Kerber R.E., et al. Low-energy biphasic waveform defibrillation: evidence-based review applied to emergency cardiovascular care guidelines. Circulation 1998; 97:1654-67.
88. Yamanouchi Y., Brewer J.E., Mowrey K.A., et al. Sawtooth first phase biphasic defibrillation waveform: a comparison with standard waveform in clinical devices. J Cardiovasc Electrophysiol 1997;8:517-28.
89. Mittal S., Ayati S., Stein K.M., et al. Comparison of a novel rectilinear biphasic waveform with a damped sine wave monophasic waveform for transthoracic ventricular defibrillation. J Am Coll Cardiol 1999;34:1595-601.
90. Mittal S., Ayati S., Stein K.M, et al. Transthoracic cardioversion of atrial fibrillation. Comparison of rectilinear biphasic versus damped sine wave monophasic shocks. Circulation 2000;101:1282-7.
91. Early out-of-hospital experience with an impedance-compensating low-energy biphasic waveform automatic external defibrillator. J Intervent Card Electrophysiol 1997;1:203-8.
92. Gliner B.E., Jorgenson D.B., Poole J.E., et al. Treatment of out-of-hospital cardiac arrest with a low-energy impedance-compensating biphasic waveform automatic external defibrillator. Biomed Instrum Technol 1998;32:631-44.
93. Poole J.E., White R.D., Kanz K-G, et al. Low-energy impedence-compensating biphasic waveforms terminate ventricular fibrillation at high rates in victims of out-of-hospital cardiac arrest. J Cardiovasc Electrophysiol 1997;8:1373-85.
94. Gliner B.E., White R.D. Electrocardiographic evaluation of defibrillation shocks delivered to out-of-hospital sudden cardiac arrest patients. Resuscitation 1999;41:133-44.
95. Martens P.R., Russell J.K., Wolcke B., et al. Optimal response to cardiac arrest study: defibrillation waveform effects. Resuscitation 2001;49:233-43.
96. Ewy G.A., Taren D. Relative impedance of gels to defibrillation discharge. Med Instrum 13:295-296, 1979.
97. Hummel R.S., Ornato J.P., Weinberg S.M., et al. Spark generating properties of electrode gels used during defibrillation: A fire hazard. JAMA 20:3021-3024, 1988.
98. Calle P.A., Buylaert W. When an AED meets an ICD … automated external defibrillator: Implantable cardioverter defibrillator. Resuscitation 38:177-183, 1998.
99. Valenzuela T.D., Roe D.J., Cretin S., et al. Estimating effectiveness of cardiac arrest interventions: A logistic regression survival model. Circulation 96:3308-3313, 1997.
100.Haskell W.L. Cardiovascular complications during exercise training of cardiac patients. Circulation 57;920-924, 1978.
101. Hossack K.F., Hartwig R. Cardiac arrest associated with supervised cardiac rehabilitation. J Cardiac Rehab 2:402-408, 1982.
102. Weaver W.D., Copass M.K., Buffi D., et al. Improved neurologic recovery and survival after early defibrillation. Circulation 69:943-948, 1984.
103. Cummins R.O., Eisenberg M., Bergner L., et al. Sensitivity, accuracy, and safety of an automatic external defibrillator. Lancet 2:318-320, 1984.
104. Cummins R.O., Eisenberg M.S., Litwin P.E., et al. Automatic external defibrillators used by emergency medical technicians: A controlled clinical trial. JAMA 257:1605-1610, 1987.
105. White R.D., Hankins D.G., Bugliosi T.F. Seven years experience with early defibrillation by police and paramedics in an emergency medical services system. Resuscitation 39:145-151, 1998.
106. Groh W.J., Newman M.M., Beal P.E., et al. Limited response to cardiac arrest by police equipped with automated external defibrillators: Lack of survival benefit in suburban and rural Indiana: The police as responder automated defibrillation evaluation (PARADE). Ann Emerg Med 8:324-330, 2001.
107. Caffrey S. Chicago airport terminal AED program. Emergency Cardiovascular Care Update. San Diego, CA, 2000.
108. Valenzuela T., Roe D.J., Nichol G., et al. Outcomes of rapid defibrillation by security officers after cardiac arrest in casinos. N Engl J Med 343:1206-1209, 2000.
109. Atkins D.L., Sirna S., Kieso R., et al. Pediatric defibrillation: importance of paddle size in determining transthoracic impedance. Pediatrics 82:914-918, 1988.
110. Atkins D.L., Kerber R.E. Pediatric defibrillation: current flow in improved by using "adult" electrode paddles. Pediatrics 94:90-93, 1994.
111. Caterine M.R., Yoerger D.M., Spencer K.T., et al. Effect of electrode position and gel-application technique on predicted transcardiac current during transthoracic defibrillation. Ann Emerg Med 29:588-595, 1997.
112. Garcia L.A., Kerber R.E. Transthoracic defibrillation: Does electrode adhesive pad position alter transthoracic impedance? Resuscitation 37:139-143, 1998.
113. Gutgesell H.P., Tacker W.A., Geddes L.A., et al. Energy doses for ventricular defibrillation in children. Pediatrics 58:898-901, 1976.
114. Chameides L., Brown G.E., Raye J.R., et al. Guidelines for defibrillation in infants and children: Report of the American Heart Association target activity group: Cardiopulmonary resuscitation in the young. Circulation 56:502A-503A, 1977.
115. Lazaam C., McCans J. Predictors of survival of in-hospital cardiac arrest. Can J Cardiol 7:113-116, 1991.
116. Dickey W., Adgey A. Mortality within hospital after resuscitation from ventricular fibrillation outside the hospital. Br Heart J 67:334-338, 1992.
117. Kaye W., Mancini M.E., Giuliano K.K., et al. Strengthening the in-hospital chain of survival with rapid defibrillation by first responders using automated external defibrillators: Training and retention issues. Ann Emerg Med 25:163-168, 1995.
118. Warwick J.P., Mackie K., Spenser I. Towards early defibrillation: A nurse training programme in the use of automated external defibrillators. Resus 30:231-235, 1995.
119. Kaye W. Strengthening the in-hospital chain of survival with rapid defibrillation by first responders using automated external defibrillators: Training and retention issues. Ann Emerg Med 25:163-68, 1992.
120. Nelson M.E, Zenas C.S. Loosing the race to resuscitate. Nurs Management 29:36D-36E, 36G, 1998.
121. Mancini M.E., Kaye W. AEDs: changing the way you respond to cardiac arrest. Am J Nurs 99:26-30, 1999.
122. Anonymous Joint Commission on Accreditation of Healthcare Organizations: In-hospital resuscitation requirements reinstated for hospitals. Joint Commission on Accreditationves 18:5, 1998.
Медицинское образование Пола Золла и начало его научной карьеры.
Пол Морис Золл (Paul Maurice Zoll, 1911-1999) родился в 1911 г. в Бостоне (штат Массачуcетс, США). Образование получил в лучших учебных заведениях своего родного города. Сначала Пол Золл окончил знаменитую Бостонскую латинскую школу, в которой еще в 1786-1793 гг. учился знаменитый американский хирург Джон Коллинз Уоррен (John Collins Warren, 1778-1856), выполнивший 16 октября 1846 г. первую в мире операцию под эфирным наркозом. После окончания школы Золл поступил в Гарвардский колледж. В колледже Пол Золл благодаря профессору Эдвину Г. Борингу (Edwin G. Boring) увлекся философией и психологией, но в 1936 г., получив степень бакалавра, он все-таки решил посвятить себя медицине. Пол Золл поступил в Гарвардскую медицинскую школу, «колыбель первых эфирных наркозов». Во время учебы он много внимания уделял исследовательской деятельности, активно участвуя в так называемой «студенческой науке». И даже в последние шесть месяцев обучения в Гарварде, несмотря на то, что его товарищи по учебе уже сосредоточились только на избранной специализации и оставили студенческие научные кружки, Золл под руководством профессора Сома Вэйса (Soma Weiss) выполнил исследование, посвященное взаимосвязи алкоголизма и заболеваний сердца. Откровенно говоря, его привлекала только исследовательская деятельность. Не будучи уверенным в своей способности к практической медицине и общению с пациентами, он долго колебался в выборе врачебной специальности. «Титаны-клиницисты эпохи внушают мне благоговейный страх» - говорил он, явно недооценивая себя.
Тем не менее он поступил в клиническую интернатуру в бостонскую клинику «Beth Israel Hospital», после окончания которой он проходил в течение года резидентуру в нью-йоркской клинике «Bellevue Hospital».
В 1939 г. Золл вернулся в «Beth Israel Hospital» в качестве стипендиата-исследователя Фонда Джошуа Мейси. Совместно с Х.Л. Блюмгартом (H.L. Blumgart) и М. Дж. Шлезингером (M.J. Schlesinger) он изучал патогенез ишемической болезни сердца.
Во время Второй мировой войны Золл был призван в армию и служил кардиологом в 160-ом американском госпитале в Великобритании. Здесь он случайно встретился со своим гарвардским однокурсником Дуайтом Харкеном (Dwight Harken). Харкен в это время занимался актуальной для военной медицины проблемой оперативного удаления инородных тел сердца (осколков, шрапнели, пуль и т. д.) и нуждался в хорошем кардиологе. Впоследствии они написали совместную публикацию по данной теме, продемонстрировав возможность сохранения жизни пациентов при этих вмешательствах, ранее выполнявшихся очень редко и только в виде исключительной и вынужденной меры, как «операции отчаяния». В этой публикации они привели 134 собственных случая оперативного извлечения инородных тел сердца и крупных сосудов без единого летального исхода [Harken D.E., Zoll P.M. Foreign bodies in and in relation to the thoracic blood vessels and heart. III Indications for the removal of intracardiac foreign bodies and the behavior of the heart during manipulation. Amer. Heart J. 1946; 32: 1-19.].
 Иллюстрация
из публикации, посвященной инородным
телам сердца
Иллюстрация
из публикации, посвященной инородным
телам сердца
Наблюдая за поведением сердца во время хирургических манипуляций, Золл был очень впечатлен возбудимостью этого органа. Позднее он писал: «Я заинтересовался электрической стимуляцией сердца вскоре после Второй мировой войны, после того как я наблюдал за первыми операциями по удалению инородных тел из сердца и окружающих его тканей, выполненными доктором Дуайтом Харкеном… Сердце действительно оказалось очень чувствительным органом, который быстро реагировал на стимулы желудочковыми сокращениями; следовательно, возбуждение сердечной деятельности при желудочковой асистолии не должно представлять сложности».
По возвращении в Бостон в 1945 г. Золл возобновил прерванную войной совместную с Х.Л. Блюмгартом и М. Дж. Шлезингером исследовательскую деятельность, сосредоточившись на вопросах патофизиологии стенокардии. Совместно с Монро Шлезингером было проведено патолого-анатомическое исследование, в котором в коронарные артерии умерших пациентов под давлением 150-200 мм ртутного столба вводились массы агара с добавками свинца с последующим рентгеновским контролем препаратов сердца. Они произвели 171 вскрытие пациентов, умерших от ишемической болезни сердца, и 671 вскрытие умерших из контрольной группы без сердечной патологии. Были подтверждены зависимость тяжести стенокардии от степени гипертрофии желудочков и значение коллатерального кровообращения в уменьшении ишемии [Zoll P.M., Wessler S., Blumgart H.L. Angina Pectoris. A Clinical and Pathological Correlation. Amer. J. Med. 1951; 9: 331-357].
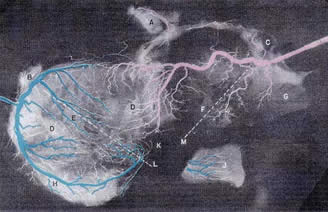 Рентгенограмма
препарата сердца из контрольной группы
Рентгенограмма
препарата сердца из контрольной группы
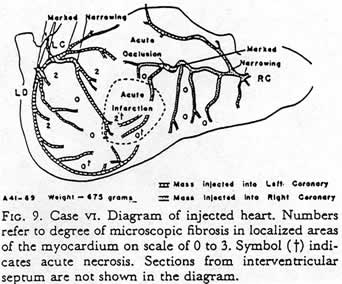 Диаграмма
сердца с патологией коронарных артерий
Диаграмма
сердца с патологией коронарных артерий
Конечно, учитывая огромный научный вклад Пола Золла в развитие кардиологии, нам, возможно, и не стоило бы так подробно останавливаться на одной из ранних работ ученого, но следует отметить, что на основании упомянутой методики Шлезингера впоследствии был разработан метод коронарной ангиографии.
Х.Л. Блюмгарт, соавтор Золла в этом исследовании и его научный руководитель, всячески поощрял и поддерживал интерес Золла к электрическим методам оживления сердца. И вскоре по воле случая Золл очень серьезно увлекся электрофизиологией сердца, ставшей делом и научным интересом всей его жизни. В конце 40-х годов в клинике «Beth Israel Hospital» лечилась 60-летняя женщина, страдавшая синдромом Морганьи-Адамса-Стокса. Эта пациентка запомнилась Золлу частыми приступами судорог и потери сознания, повторявшимися ежедневно на протяжении трех недель. Когда пациентка умерла, Золл был крайне расстроен: «Этого не должно было случиться с совершенно нормальным, за исключением блока проводимости, сердцем. Следует изыскать возможности для стимуляции сердца».
Это заявление Пола Золла было основано на его знании истории физиологии и знакомстве с работами исследователей, которые ранее уже успешно доказали, что сердце может сокращаться под действием электрической стимуляции.
К содержанию
![]()
Ранняя история электрических методов лечения аритмий и блокад сердца
Электрические методы лечения аритмий и блокад сердца (кардиостимуляция и дефибрилляция), относительно недавно вошедшие в широкую клиническую практику, тем не менее ведут свою историю уже со второй половины XVIII века.
По всей видимости, первый официально документированный случай применения электрических импульсов для оказания помощи при внезапной смерти относится к 16 июля 1774 г.
В этот день мистер Сквайерс (Squires), житель лондонского района Сохо, увидел, как из окна первого этажа здания, находящегося напротив его дома, выпала трехлетняя девочка Катарина София Гринхил (Catherine Sophia Greenhill). Осмотревший пострадавшую, «внешне умершую» девочку, аптекарь сказал убитым горем родителям, что сделать, к сожалению, уже ничего нельзя. После этого мистер Сквайерс с согласия родителей все-таки попытался помочь девочке, используя разряды электричества принесенных им из домашней лаборатории лейденских банок. Когда он начал наносить электрические разряды по различным участкам тела девочки, с момента ее падения уже прошло по крайней мере минут двадцать. Все его попытки оживить девочку были безуспешны. Однако после нескольких электрических разрядов в области грудной клетки мистер Сквайерс все-таки ощутил еле уловимую пульсацию у пострадавшей. Вскоре, хоть и с большим трудом, девочка начала дышать. Спустя десять минут ее вырвало. На протяжении последующих нескольких дней у девочки наблюдался ступор, но приблизительно через неделю она уже была абсолютно здорова.
Этот случай был описан аптекарями мистером Соудэном и мистером Хоузом (Sowdon, Hawes) в годовом отчете Лондонского гуманитарного общества, которое вскоре приобрело статус Королевского[Annual Report 1774: Humane Society, London. P. 31-32]. Член Лондонского Королевского гуманитарного общества, горячий сторонник и исследователь электрической стимуляции сердца, Чарльз Кайт (Charles Kite, 1768-1811) несколько позднее написал об этом случае в своем эссе: «Мистер Сквайерс представил вышеупомянутым джентльменам ошеломляющие сведения о данном случае выздоровления, в надежде, что в будущем, прежде чем отчаиваться, обязательно будут использованы все известные способы для спасения каждого человека» [Charles Kite, "An Essay on the Recovery of the Apparently Dead", 1788].
В 1775 г. ветеринарный врач, датчанин Peter Christian Abildgaard (1740-1801) описал свои эксперименты, в которых при помощи электрических разрядов он умерщвлял куриц, а самое главное – снова восстанавливал у них сердечную деятельность, нанося повторные электрические разряды в область грудной клетки. Он писал: «При электрическом разряде в область головы курицы она становилась бездыханной и возвращалась к жизни после нанесения второго разряда на область грудной клетки. Более того, если эксперимент повторялся несколько раз, то птица становилась как бы оглушенной, с трудом ходила и еще сутки не притрагивалась к корму. Однако в дальнейшем курицы чувствовали себя неплохо и даже несли яйца» [Abildgaard, Peter Christian. Tentamina electrica in animalibus. Inst. Soc. Med. Havn. 1775; 2: 157-161].
В 1788 г. уже упомянутый нами лондонский врач Чарльз Кайт (Charles Kite, 1768-1811) получил серебряную медаль Лондонского Королевского гуманитарного общества за эссе, посвященное применению электричества для оживления внезапно умерших людей. На работы Кайта очень часто ссылаются как на первый опыт дефибрилляции миокарда, хотя он сам описал в своем эссе более удачный случай оживления, проведенный мистером Сквайерсом в 1774 г. Методы оживления, использованные и рекомендованные Чарльзом Кайтом, существенно отличаются от того, что мы теперь вкладываем в понятие «реанимация». Так, например, согласно его описанию случая попытки оживления при утоплении, датированного 1785 г., на протяжении первого часа оказания помощи Кайт сначала делал искусственное дыхание, согревал и растирал потерпевшего, вводил пары лекарственных настоев в полость желудка, пытался раздражать дыхательные пути табаком и лишь только затем применил лейденские банки, посылая электрические разряды во всевозможных направлениях, что вызывало мышечные сокращения у умершего. Тогда же Кайт сделал вывод, что при помощи электричества можно успешно оживлять внезапно умерших людей [Annual Report 1788: Humane Society, London. P. 225-244. Kite C. An Essay on the Recovery of the Apparently Dead. 1788: C. Dilly, London].
Интересно, что в своем эссе при описании техники искусственного дыхания он дал рекомендации использовать прижатие гортани к позвоночнику, чтобы вызвать сдавление фарингеального конца пищевода и предотвратить тем самым попадание вдуваемого воздуха в желудок вместо легких. На первый взгляд, Кайт на целых двести лет опередил Брайана А. Селлика (Brian A. Sellick, 1918-1996), предложившего свой прием защиты дыхательных путей перед интубацией лишь только в 1962 г. Причем Кайтом этот маневр преподносился как часть уже общепринятой методики оживления внезапно умерших, о чем свидетельствует и обзор методов оживления Джеймса Карри (James Curry) из Нортхамптона, опубликованный в Англии в 1796 г. Однако существенная идеологическая разница между целью британских пионеров ресусцитации и целью Брайана Селлика заключалась в том, что первые пытались предотвратить искусственную вентиляцию желудка, а Селлик предложил профилактику регургитации желудочного содержимого в легкие.
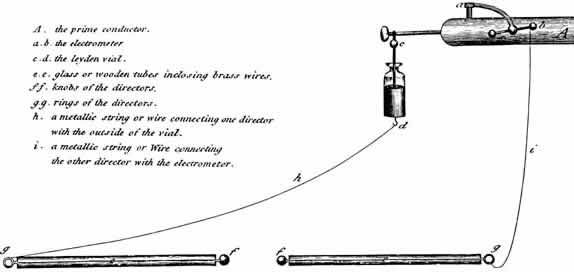 «Дефибриллятор»
Чарльза
Кайта.
Рисунок
из
эссе
Ч.Кайта
«An
Essay on the Recovery of the Apparently Dead» (London, 1788)
«Дефибриллятор»
Чарльза
Кайта.
Рисунок
из
эссе
Ч.Кайта
«An
Essay on the Recovery of the Apparently Dead» (London, 1788)
На протяжении последующих полутора веков процесс накопления наукой знаний в области электрофизиологии сердца, и в частности электрической кардиостимуляции, протекал довольно интенсивно.
Еще в 1771 г. итальянский физик и анатом, основоположник электрофизиологии Луиджи Гальвани (Luigi Galvani, 1737-1798) открыл в мышцах электрические токи, названные им «животным электричеством», а в 1791 г. обнаружил, что электрическая стимуляция сердца лягушки приводит к сокращению сердечной мышцы.
 Луиджи
Гальвани (Luigi Galvani, 1737-1798)
Луиджи
Гальвани (Luigi Galvani, 1737-1798)
В 1850 г. М.Хоффа (M.Hoffa) и К.Людвиг (Ludwig C.) наблюдали неестественные нерегулярные сокращения миокарда желудочков (в последующем появился термин «фибрилляция желудочков») у собак и кошек во время проведения через ткани сердца сильного электрического тока. Они же продемонстрировали, что можно индуцировать фибрилляцию желудочков сердца нанесением одиночного электрического импульса [Hoffa M., Ludwig C. 1850. Einige neue versuche uber herzbewegung. Zeitschrift Rationelle Medizin, 9: 107-144].
В 1872 г. пионер нейрофизиологии Гийом Бенжамен Аманд Дюшенн де Булонь (Guillaume Benjamin Amand Duchenne de Boulogne, 1806-1875) в третьем издании своего учебника по использованию электричества в медицине описал случай реанимации утонувшей девочки при помощи электрического тока. Иногда данный эпизод рассматривают как первое применение искусственного электрического стимулятора сердца, хотя, надо оговориться, что Булонь использовал электрический ток для стимуляции не миокарда, а диафрагмы [Duchenne G.B. De l'electrisation localisee et de son application a la pathologie et la therapeutique par courants induits at par courants galvaniques interrompus et continus. 3ed. Paris. J.B. Bailliere et fils; 1872].
 Гийом
Дюшенн демонстрирует «электрическую
улыбку» у своего пациента
Гийом
Дюшенн демонстрирует «электрическую
улыбку» у своего пациента
В 1899 г. в Женеве профессор биохимии Жан-Луи Прево (Jean-Louis Prevost) и профессор физиологии Фредерик Бателли (Frederic Batelli) обнаружили, что электрические разряды высокого напряжения, проходящие через сердце животного, способны оборвать фибрилляцию желудочков [Prevost J.L., Batelli F.: Sur quelques effets des descharges electriques sur le coeur des mammiferes. Acad. Sci. Paris, FR.: 1899; 129: 1267-1268].
Следуя первоначально протоколу вышеупомянутого исследования Хоффа и Людвига, которые вызывали остановку сердца, провоцируя фибрилляцию желудочков с помощью сравнительно слабых электрических стимулов, Прево и Бателли обнаружили, что относительно более сильная электрическая стимуляция вызывает временное прекращение всех видов сердечной активности, включая фибрилляцию. Фактически именно они и открыли метод дефибрилляции, но, к сожалению, это открытие не получило признания современников. В отличие от быстрого успеха электрокардиографии, изобретенной практически в это же самое время, дефибрилляции потребовалось почти полвека для успешного применения в клинике, за которым последовало всемирное признание.
Одной из причин такой задержки, возможно, был неубедительный стиль изложения своих результатов авторами открытия, который вызывал скептическое отношение к самой идее метода. Кроме того, как оказалось впоследствии, авторы использовали наименее эффективную конфигурацию электрического поля, в результате чего требовались слишком высокие напряжения, вызывавшие обширное повреждение тканей организма, поэтому нельзя было говорить о практической применимости данного метода в клинике.
Прево и Бателли были также и авторами первой теории дефибрилляции, объясняющей, что аритмия прекращается благодаря временному параличу сердечной мышцы, то есть подавлению способности кардиомиоцитов генерировать потенциал действия и/или проводить возбуждение. Действительно, первоначальный опыт дефибрилляции в клинике и экспериментальных моделях внезапной смерти на животных требовал прямого массажа сердечной мышцы после приложения электрического шока, поскольку механическая и электрическая активности были полностью подавлены. Позднее, в 1939 г., российские исследователи Гурвич Н.Л. и Юниев Г.С. впервые предположили, что дефибрилляцию можно осуществить, применяя значительно более слабые электрические поля, вызывающие синхронную стимуляцию миокарда, а не его паралич. Последующие исследования частично подтвердили правомочность этой теории. Согласно другой теории, господствовавшей во второй половине XX века, восстановление синхронизации сердечной деятельности происходит из-за индуцированного шоком удлинения рефрактерного периода и длительности потенциала действия.
К настоящему времени существует несколько теорий, пытающихся объяснить механизм дефибрилляционного действия электрического шока. Однако полная теория дефибрилляции, которая позволила бы объяснить фундаментальные механизмы этого феномена, до сих пор остается предметом дискуссий и исследований.
Начало клинической электрокардиостимуляции обычно связывают с именем американского доктора Альберта С. Хаймана (Albert Hyman). В 1930 г. он начал работу по созданию специального аппарата, назначением которого являлось нанесение электрического импульса на сердце при его остановке. В 1931 г. доктор Хайман запатентовал первый искусственный водитель ритма сердца, стимулирующий работу сердца при помощи трансторакальной иглы.
 Первый
запатентованный искусственный водитель
ритма
Первый
запатентованный искусственный водитель
ритма
Он использовал этот прибор для стимуляции предсердий при отказе синусного узла в эксперименте на животных. Позже Хайман назвал свой аппарат «artificial pacemaker» – искусственный водитель ритма, и этот термин получил всемирное распространение и признание. Первоначальный вариант данного прибора приводился в действие при помощи коленчатого вала. Позже он послужил прототипом пейсмекера, выпускаемого одной из немецких фирм, но большим спросом и успехом эта модель не пользовалась. К 1 марта 1932 г. Хайманом был накоплен некоторый опыт клинического использования пейсмекеров, но лишь в 14 случаях из 43 он оказался удачным. И только в 1942 г. появилось сообщение об эффективном использовании пейсмекера в течение непродолжительного срока для купирования приступов Морганьи-Адамса-Стокса [Hyman A.S. Resuscitation of the stopped heart by intracardial therapy. Arch. Intern. Med. 1932; 50: 283].
Хайман не торопился делать подробные сообщения о своих исследованиях на пациентах, возможно, из-за того, что в то время было слишком много противников «излишней технизации» медицины, а эксперименты на людях рассматривались как кощунственные вмешательства. Однако в своих работах Альберт Хайман ссылался на более ранние исследования в этом направлении. В 1926 г. в Сиднее, в акушерско-гинекологической клинике «Кроун Стрит» (Crown Street Women's Hospital) врачи, пожелавшие остаться неизвестными, реанимировали новорожденного при помощи созданного им электрического прибора. По всей видимости, желание врачей сохранить свои имена в тайне было связано с имевшимся в то время негативным отношением общества к экспериментам по искусственному продлению человеческой жизни. Как говорится, все тайное вскоре становится явным, и уже в 1929 г. австралийский врач Марк Лидвилл (Mark Lidwill) и физик Эдгар Бут (Edgar Booth) представили вниманию сиднейской медицинской общественности разработанный ими аппарат для стимуляции сердца и результаты исследований, которые проводились на мертворожденных младенцах. При помощи данного прибора можно было наносить электрические разряды различной мощности и частоты. Один, монополярный, электрод вводили прямо в сердце, другой, индифферентный, прикладывали непосредственно к коже после предварительного смачивания его в физиологическом растворе. В одном случае, когда обычные реанимационные мероприятия были безуспешны, стимуляция желудочков позволила реанимировать младенца. Через 10 минут стимуляция была прекращена, у ребенка появились признаки жизни. Он выжил. Вероятно, именно этот случай следует считать первым клиническим опытом применения кардиостимуляции.
Параллельно накапливались знания и практические результаты в области дефибрилляции сердца. В 1947 г. американский хирург Клод Бек (Claude Beck, 1894-1971), один из пионеров сердечно-сосудистой хирургии в Кливленде, провел успешную дефибрилляцию во время оперативного вмешательства на сердце у четырнадцатилетнего мальчика. До этого случая у других шести пациентов Клода Бека дефибрилляция прошла неудачно [Beck C.S., Pritchard W.H., Feil S.A.: Ventricular fibrillation of long duration abolished by electric shock. JAMA, 1947; 135: 985-989.].
 Дефибриллятор
Клода Бека
Дефибриллятор
Клода Бека
Успеху Клода Бека, кардиохирурга из Кливлендского университета Западного Резерва (Western Reserve University), способствовали многолетние предшествующие эксперименты по дефибрилляции на животных, проведенные Карлом Дж. Виггерсом (Carl J. Wiggers), профессором физиологии этого же университета. Именно Виггерс обеспечил методологическую базу первой успешной клинической дефибрилляции [Wiggers C.J., Wegria R. Ventricular fibrillation due to single localized induction in condenser shock supplied during the vulnerable phase of ventricular systole. Am. J. Physiol. 1939; 128: 500].
Интересно отметить, что одновременно с Виггерсом в США интенсивные исследования в области дефибрилляции велись в СССР Н.Л. Гурвичем. Советские разработки в области электрической реанимации были инициированы академиком Л.С. Штерн, которая была ученицей Жана-Луи Прево в Женевском университете и продолжила работу своего учителя по возвращении на Родину. Она поручила эти исследования своему аспиранту Н.Л. Гурвичу, посвятившему этим чрезвычайно плодотворным исследованиям всю свою жизнь. Хотя Гурвич и отстал на несколько лет с клиническим применением дефибрилляции от американцев, именно он предложил в 1939 г. форму импульса, которая в дальнейшем получила широкое применение во всем мире, в отличие от дефибрилляции Виггерса, которая не получила широкого распространения, несмотря на начальный успех в клинике [Gurvich N.L., Yuniev G.S. Restoration of regular rhythm in the mammalian fibrillating heart. Byulletin Eхper. Biol. & Med. 1939; 8: 55-58.].
В 1950 г. Джон Хопс, канадский инженер-электрик и член Национального исследовательского совета, совместно с двумя врачами, профессором Торонтского университета Уилфредом Бигелоу (Wilfred Bigelow) и его учеником Джоном К. Каллэгеном (John C. Callaghan), доказал, что координированное сокращение миокардиоцитов может быть стимулировано электрическим импульсом, переданным в синоатриальный узел. Разработанный этой исследовательской группой пейсмекер был длиной 30 см и работал на лампах, его питание осуществлялось от бытовой электрической сети с частотой 60 Гц [Bigelow W.G., Callaghan J.C., Hopps J.A. "General hypothermia for experimental intracardiac surgery." Ann Surg 1950; 1132: 531-539].
К содержанию
«Золотая декада» кардиостимуляции
Современная эра электрической кардиостимуляции относится к началу 50-х годов XX века, и одновременно с этим начинается «золотая декада» кардиостимуляции. Неоценимый вклад в развитие электрических методов лечения аритмий и блокад сердца, как электростимуляции, так и дефибрилляции, внес герой данного выпуска Виртуального календаря, анестезиолог-реаниматолог, американский врач Пол Золл. Он уже был знаком с работами вышеперечисленных пионеров электрофизиологии сердца и во многом ориентировался на результаты исследований У. Бигелоу и Д. Каллэгена.
В 1950 г. Золл воспользовался электростимулятором профессора Отто Крайера (Otto Krayer) и, используя транспищеводную стимуляцию, сумел вызвать желудочковые экстрасистолы у собаки. Вот что писал об этом сам Пол Золл: «После нескольких безуспешных попыток сконструировать генератор импульсов я последовал рекомендации Каллэгена и воспользовался лабораторной моделью физиологического кардиостимулятора (физиологический генератор импульсов «Thyratron» Грасса), который был получен благодаря любезности профессора Отто Крайера, заведующего кафедрой фармакологии Гарвардской медицинской школы…
При использовании длинного проводного электрода в пищеводе и второго электрода в прекардиальной области у собаки, мы смогли продемонстрировать, что электрический стимул действительно может вызвать электрическую ответную реакцию со стороны предсердий или желудочков и эффективные сердечные сокращения, благодаря которым можно ликвидировать асистолию сердца и поддерживать кровообращение» [Zoll P.M. Development of Electric Control of Cardiac Rhythm. Lasker Awards. JAMA, 1973; 226: 881-882.].
В том же 1950 г. на заседании Американской коллегии хирургов в Бостоне состоялась презентация стимуляции синусно-предсердного узла через трансвенозный катетер, созданный Золлом. Эта оригинальная методика была предложена им для возможности электрокардиостимуляции через неповрежденную грудную стенку во время асистолии. В дальнейшем эта методика неоднократно совершенствовалась, но, тем не менее, даже уже в 1973 г. сам Золл все еще считал этот подход «менее удовлетворительным». В это же время ему удалось добиться и некоторого ответа на электрические стимулы, приложенные к грудной клетке снаружи. В экспериментах на животных он установил, что электрический импульс, нанесенный на наружную поверхность грудной клетки, может быть использован для стимуляции сердца. В неоднократно повторенных опытах была доказана простота, безопасность и быстрота восстановления сердечной деятельности после нанесения электрических импульсов определенной характеристики через накожные электроды. Это послужило основанием к использованию данного метода у человека для устранения асистолии желудочков.
Тем не менее вплоть до 1952 г. ему не представлялось возможности проверить свои идеи в клинической практике. И, наконец, в августе 1952 г. в клинику «Beth Israel Hospital» поступил 65-летний мужчина с терминальной стадией ишемической болезни сердца, полным блоком проводимости и рецидивирующими остановками сердца. Попытка трансторакальной кардиостимуляции оказалась успешной. Кардиостимуляция проводилась на протяжении 52 часов, и пациент прожил после этого еще 6 месяцев.
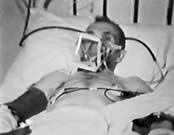 Исторический
пациент Пола Золла
Исторический
пациент Пола Золла
Электрическая стимуляция сердца через закрытую грудную клетку требовала значительно больших напряжения и силы тока, чем при прямом наложении электродов на эпикардиальную поверхность желудочков. Зато отсутствие необходимости выполнения торакотомии расширяло перспективные возможности для широкого применения метода. Серьезным недостатком метода были часто возникающие при стимуляции болевые ощущения и вынужденное ограничение подвижности пациента. Позднее стали использовать кожные электроды с большей площадью и с большей продолжительностью импульсов, что позволило сделать применение электрического разряда менее болезненным.
Демонстрация достаточно длительной наружной стимуляции сердца и первый клинический успех Пола Золла явились мощнейшим толчком к дальнейшему развитию электрических методов лечения аритмий и блокад сердца. Сообщение об этом случае было представлено Полом Золлом в престижном медицинском журнале «New England Journal of Medicine» и получило положительные отклики от многих ученых. Однако нашлись некоторые врачи, которые критически отнеслись к работе Золла, рассматривая ее как «сопротивление воле Бога». Позже Пол Золл засвидетельствовал свою признательность за статью, появившуюся в католической газете «The Pilot»: «Очень благосклонно настроенный редактор сказал своим прихожанам, чтобы они не боялись диковинного лечения, проводящегося в клинике «Beth Israel Hospital», так как пути господни неисповедимы и это лечение является одним из путей выражения Божественной воли». Не обращая внимания на критику, Золл продолжил свои исследования, совмещая их с активной клинической практикой и преподаванием в Гарвардской медицинской школе.
Через два года после своего первого сообщения об успешной трансторакальной электрокардиостимуляции Золл и его коллеги доложили еще о 14 подобных случаях [Zoll P.M., Linenthal A.J., Norman L.R., Belgard A.H. Treatment of Stokes-Adams Disease by External Electric Stimulation of the Heart. Circulation 1954; 9: 482-493].
Большинство из этих пациентов страдали приступами синдрома Морганьи-Адамса-Стокса. Девять пациентов потребовали длительных периодов стимуляции, продолжительность которых была от 25 минут до 108 часов. Одному из пациентов с асистолией желудочков из-за полного блока проводимости потребовалась повторная длительная электрокардиостимуляция. Первый период электростимуляции у данного пациента продолжался в течение 96 часов, а второй – в течение 108 часов (см. рис.).

Несмотря на применение нового лечебного метода, смертность у пациентов с синдромом Морганьи-Адамса-Стокса оставалась по-прежнему высокой. Тем не менее некоторые пациенты из этой группы прожили несколько месяцев. Опубликованная Золлом и его коллегами статья содержала несколько очень важных выводов:
1. «…Наружная электрокардиостимуляция является методом выбора неотложной терапии при неожиданной остановке кровообращения в результате асистолии сердца».
2. Боль в груди и интенсивность мышечных судорог варьируют от пациента к пациенту. У двух больных наблюдалась крайняя степень выраженности этих симптомов. Неприятные ощущения были ослаблены приемом меперидина гидрохлорида или паральдегида. Назначение курареподобных препаратов и местных анестетиков было безрезультатным. Был сделан вывод, что лучшим методом будет считаться тот, при котором выраженность неприятных ощущений удается свести к минимуму. Пол Золл достиг этой цели 29 лет спустя.
3. Представлен алгоритм ответной реакции сердца при асистолии на успешную или неудачную трансторакальную электрокардиостимуляцию. Золл предсказал, что будет возможна наружная трансторакальная дефибрилляция. Он достиг этой цели через два года. 4. Показана необходимость разработки метода, обеспечивающего постоянную электрокардиостимуляцию после быстрого восстановления сердечной деятельности. Золл и его команда достигли своей цели шесть лет спустя с помощью имплантированного кардиостимулятора.
К содержанию
Дальнейший научный вклад Пола Золла в развитие реаниматологии и кардиологии
Еще в своей легендарной статье 1952 г., посвященной внешней электрической кардиостимуляции, Пол Золл предположил, что применение сильного наружного электрического разряда может позволить клиницистам прерывать фибрилляцию желудочков и обеспечить успешную реанимацию.
И уже в 1956 г. он совместно со своими коллегами провел первую клиническую демонстрацию успешной трансторакальной дефибрилляции, которая привела в дальнейшем к настоящей революции в терапии нарушений сердечного ритма и переоценке традиционных фармакологических подходов [Zoll P.M., Linethal A.J., Gibson W., et al. Termination of ventricular fibrillation in man by externally applied electric shock. N. Engl. J. Med. 1956; 254: 727].
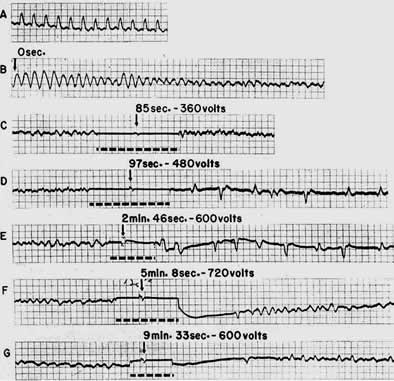 ЭКГ,
приведенная в качестве примера в статье
Золла и его коллег и демонстрирующая,
что желудочковая фибрилляция может
быть устранена с помощью трансторакального
электрического разряда
ЭКГ,
приведенная в качестве примера в статье
Золла и его коллег и демонстрирующая,
что желудочковая фибрилляция может
быть устранена с помощью трансторакального
электрического разряда
В статье были описаны четыре случая фибрилляции желудочков. Причинами фибрилляции являлись острый инфаркт миокарда, дигиталисная интоксикация, приступы синдрома Морганьи-Адамса-Стокса. В одном случае причину фибрилляции желудочков выявить не удалось. Из этих пациентов выжил только больной с синдромом Морганьи-Адамса-Стокса.
Использованный в исследовании дефибриллятор был сконструирован командой Пола Золла. Однако следует заметить, что изначально Золл пошел более сложным путем. Предложенный им прибор генерировал переменный ток. Только через шесть лет Лаун (B.Lown) применил дефибриллятор, воздействовавший на сердце разрядами постоянного тока. По своему устройству он мало чем отличался от нашего первого отечественного конденсаторного дефибриллятора постоянного тока, созданного Н.Л.Гурвичем. В настоящее время в электрических дефибрилляторах конденсаторного типа используется постоянный ток. Лауном же впоследствии был предложен и метод кардиоверсии – использования синхронизированных с сердечным циклом электрических разрядов для лечения тахикардий. Электрическую дефибрилляцию и кардиоверсию часто объединяют под названием «электроимпульсная терапия».
Вместо термина «дефибрилляция» доктор Золл предпочитал использовать термин «электрошок» («countershock»). Тем самым он отдавал дань уважения сделанному Карлом Виггерсом историческому описанию моделирования фибрилляции желудочков под действием электрических разрядов на сердце животных во время восприимчивой фазы и последующего возврата синусового ритма в результате второго разряда электрошока. Благодаря проведенной Золлом в 1956 г. успешной трансторакальной дефибрилляции электрошоковая терапия постепенно превратилась в основной метод реанимации при остановке сердца в результате фибрилляции желудочков. Прежде единственно приемлемыми подходами в данной ситуации считались экстренная торакотомия и прямой массаж сердца. В 1960 г. Золл сообщил об эффективности внешнего электрошокового разряда при терминальной наджелудочковой и желудочковой тахикардии, а также при фибрилляции предсердий.
Широкое внедрение в клиническую практику новых электрических методов терапии аритмий и блокад сердца потребовало от клиницистов умения быстро распознавать электрофизиологические признаки остановки сердца, опасных для жизни аритмий и блокад. Еще в своем первом описании успешной клинической трансторакальной дефибрилляции доктор Золл обратил внимание на то, что «успех дефибрилляции зависит от быстроты диагностики критического состояния и скорости применения наружного дефибриллятора». Для достижения этой цели еще в начале 50-х годов ХХ века Полом Золлом и его сотрудниками было разработано практичное контролирующее устройство для отражения электрической активности сердца на экране осциллоскопа, для регистрации каждого сердечного сокращения с помощью аудиосигнала и сигнала тревоги при начале остановки сердца. Таким образом, Пол Золл является также основоположником и пионером современного кардиомониторинга. Первая такая контролирующая аппаратура была произведена компанией «Electrodyne», с которой он длительное время сотрудничал. Совместно с инженером Аланом Белгардом (Alan Belgard) Золл разработал осциллоскопические непрерывно работающие мониторы, которые визуально и с помощью аудиосигналов регистрировали сердечную деятельность и подавали сигнал тревоги, когда предварительно заданные границы частоты сердечных сокращений нарушались.
 Один
из первых кардиомониторов Пола Золла
Один
из первых кардиомониторов Пола Золла
После внедрения в клиническую практику электрической стимуляции сердца терапия синдрома Морганьи-Адамса-Стокса сфокусировалась на предупреждении рецидива приступов. Так как ранее лекарственная терапия при профилактике приступов Морганьи-Адамса-Стокса обычно была неадекватной, появилась возможность обеспечить полное предупреждение приступов при условии, что работа желудочков будет контролироваться и поддерживаться электрической стимуляцией неограниченный период времени.
В связи с этим между 1960 и 1964 гг. Золлом и его коллегами был разработан метод длительной прямой электрической стимуляции сердца при помощи имплантируемого кардиостимулятора. Имплантируемые кардиостимуляторы были также использованы Золлом для улучшения состояния пациентов при застойной сердечной недостаточности с редким желудочковым ритмом.
 Имплантируемый
кардиостимулятор Пола Золла
Имплантируемый
кардиостимулятор Пола Золла
В 1976 г. Пол Золл описал механическую технику для «стимуляции» асистолического сердца. Еще во время войны, работая в госпитале совместно Дуайтом Харкеном и наблюдая за его операциями на сердце, Золл заметил, простое прикосновение пальца или медицинского инструмента к поверхности сердца вызывает его сокращение. Позднее он внедрил принцип механической стимуляции сердца в виде одного или нескольких повторяющихся ударов по грудной стенке для того, чтобы возобновить сердечные сокращения при асистолии. Специально для этого им был разработан ЭКГ-синхронизированный механический наружный кардиостимулятор.
 Механический
кардиостимулятор Пола Золла
Механический
кардиостимулятор Пола Золла
К содержанию
Пол Золл как ученый и человек

Пол Золл прошел путь от стипендиата-исследователя и ассистента до профессора-клинициста Гарвардской медицинской школы и врача знаменитой бостонской клиники «Beth Israel Hospital». С 1947 по 1958 гг. он был заведующим кардиологическим отделением в «Beth Israel Hospital». В 1977 г. он стал заслуженным клиническим профессором медицины Гарвардской медицинской школы.
С 1956 по 1965 гг. Золл являлся заместителем редактора журнала «Circulation» и членом редколлегии журналов «Journal of Medical Electronics», «Journal of Electrocardiology».
Он был почетным членом многих медицинских обществ и отмечен многочисленными престижными наградами. В 1973 г. Пол Золл был награжден премией Ласкера и признан пионером электростимуляции сердца.

Всегда очень оберегавший свою частную жизнь, Пол был сосредоточен на семье и нескольких давних друзьях. В 1939 г. Пол Золл женился на Джанет Джонс (Janet Jones). Дженет умерла в 1978 г. после продолжительной болезни. Его сын Росс, много лет помогавший отцу в лаборатории, избрал своей основной специальностью анестезиологию. Его дочь Мэри работает научным редактором. В 1981 г. Пол Золл женился на Энн Блюмгарт Гуревич (Ann Blumgart Gurewich).
 Пол
Золл вместе с соавтором в исследованиях
по имплантируемым
кардиостимуляторам
Говардом Франком (Howard Frank)
Пол
Золл вместе с соавтором в исследованиях
по имплантируемым
кардиостимуляторам
Говардом Франком (Howard Frank)
Золл внешне производил обманчивое впечатление очень мрачного человека. Он много требовал как от себя, так и от коллег. Немногословный, он был внимательным слушателем. Он пользовался большим уважением со стороны пациентов и их семей, которым посвящал себя, был всегда доступен – включая случайные домашние визиты.
Золл был практикующим врачом на протяжении всей жизни и был заботливым и внимательным по отношению к своим пациентам, многим из которых он служил десятилетия. На этом фоне Золл продолжал свои изнурительные исследования по контролю бради- и тахикардии. Он умер на 88-м году жизни 5 января 1999 г.
 Пол
Золл на конференции по сердечно-легочной
реанимации в 1975 г.
1-й
ряд: James Jude, David Leighninger, Lois Del Cuercio,
Guy
Knickerbocker, Charles Guildner, Don Dembo.
2-й
ряд:
Christopher Rattenborg, Rober Huber, Peter Safar, Robert Oswald,
Joseph
Redding, Hugh Stephenson, Jr.Archer Gordon, Leon Resnekov,
Gerald
Modell, Leonard Sherlis, James Elam, James Evans.
3-й
ряд:
Keith Thwaites, Poul Zoll, Edwin Nemoto, Larry Birch,
Eugene
Nagel, Asmund Laerdal.
Пол
Золл на конференции по сердечно-легочной
реанимации в 1975 г.
1-й
ряд: James Jude, David Leighninger, Lois Del Cuercio,
Guy
Knickerbocker, Charles Guildner, Don Dembo.
2-й
ряд:
Christopher Rattenborg, Rober Huber, Peter Safar, Robert Oswald,
Joseph
Redding, Hugh Stephenson, Jr.Archer Gordon, Leon Resnekov,
Gerald
Modell, Leonard Sherlis, James Elam, James Evans.
3-й
ряд:
Keith Thwaites, Poul Zoll, Edwin Nemoto, Larry Birch,
Eugene
Nagel, Asmund Laerdal.
