Билет №9.
1.Ковалентная связь.
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер.
Существуют три вида ковалентной химической связи, отличающихся механизмом образования:
1. Простая ковалентная связь. Для ее образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью. Такую связь имеют простые вещества, например: О2, N2, Cl2. Но не только неметаллы одного типа могут образовывать ковалентную неполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы, электроотрицательность которых имеет равное значение, например в молекуле PH3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора.
Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью.
2. Донорно-акцепторная связь. Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов — донор. Второй из атомов, участвующий в образовании связи, называется акцептором. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу.
3. Семиполярная связь.Её можно рассматривать как полярную донорно-акцепторную связь. Этот вид ковалентной связи образуется между атомом, обладающим неподелённой парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера). Образование семиполярной связи протекает в два этапа:
1. Перенос одного электрона от атома с неподелённой парой электронов к атому с двумя неспаренными электронами. В результате атом с неподелённой парой электронов превращается в катион-радикал (положительно заряженная частица с неспаренным электроном), а атом с двумя неспаренными электронами — в анион-радикал (отрицательно заряженная частица с неспаренным электроном).
2. Обобществление неспаренных электронов (как в случае простой ковалентной связи).
При образовании семиполярной связи атом с неподелённой парой электронов увеличивает свой формальный заряд на единицу, а атом с двумя неспаренными электронами понижает свой формальный заряд на единицу.
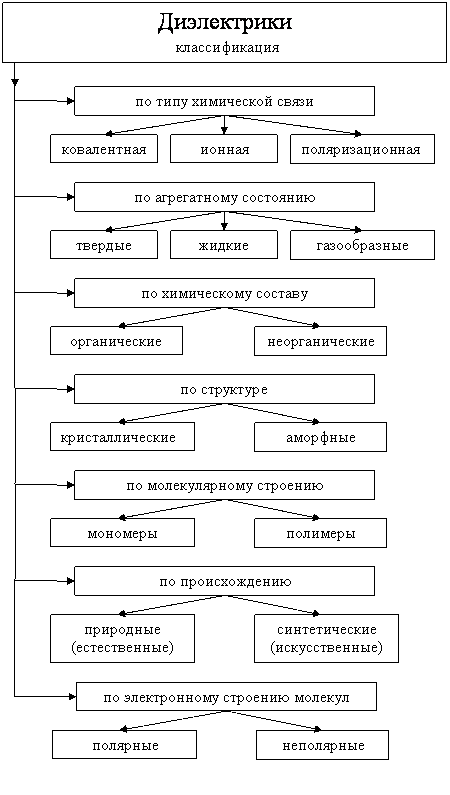
3.Общая классификация диэлектриков. Их классификация.
Диэлектрик (изолятор) — вещество, плохо проводящее электрический ток. Концентрация свободных носителей заряда в диэлектрике не превышает 108 см−3. Основное свойство диэлектрика состоит в способности поляризоваться во внешнем электрическом поле. С точки зрения зонной теории твёрдого тела диэлектрик — вещество с шириной запрещённой зоны больше 3 эВ.
Физические свойства.
Условно к проводникам относят материалы с удельным электрическим сопротивлением ρ < 10−5 Ом·м, а к диэлектрикам — материалы, у которых ρ > 108 Ом·м. При этом надо заметить, что удельное сопротивление хороших проводников может составлять всего 10−8 Ом·м, а у лучших диэлектриков превосходить 1016 Ом·м. Удельное сопротивление полупроводников в зависимости от строения и состава материалов, а также от условий их эксплуатации может изменяться в пределах 10−5—108 Ом·м. Хорошими проводниками электрического тока являются металлы. Из 105 химических элементов лишь двадцать пять являются неметаллами, причём двенадцать элементов могут проявлять полупроводниковые свойства. Но кроме элементарных веществ существуют тысячи химических соединений, сплавов или композиций со свойствами проводников, полупроводников или диэлектриков. Чёткую границу между значениями удельного сопротивления различных классов материалов провести достаточно сложно. Например, многие полупроводники при низких температурах ведут себя подобно диэлектрикам. В то же время диэлектрики при сильном нагревании могут проявлять свойства полупроводников. Качественное различие состоит в том, что для металлов проводящее состояние является основным, а для полупроводников и диэлектриков — возбуждённым.
Развитие радиотехники потребовало создания материалов, в которых специфические высокочастотные свойства сочетаются с необходимыми физико-механическими параметрами. Такие материалы называют высокочастотными. Для понимания электрических, магнитных и механических свойств материалов, а также причин старения нужны знания их химического и фазового состава, атомной структуры и структурных дефектов.
Удельное сопротивление деионизированной воды (см. также бидистиллят) — 10-20 МОм·см.
Классификация диэлектриков: