- •1. Основные определения и понятия термодинамики
- •2. Параметры состояния и уравнения состояния.
- •3.Термодинамическая работа, координаты p-V
- •4. Потенциальная (техническая) работа
- •5. Теплоемкость. Определение теплоемкости веществ.
- •Вопрос 8. Определение температуры смеси. Теплоемкость смеси
- •Вопрос 9. Термодинамические условия фазовых переходов.
- •Вопрос 10. Критические параметры чистого вещества и смесей.
- •Вопрос 11. Теория соответственных состояний. Коэффициент сжимаемости.
- •13. Аналитическое выражение первого начала термодинамики
- •14. Первое начало термодинамики для идеального газа.
- •1 5. Принцип существования энтропии идеального газа.
- •31. Теплопроводность. Закон Фурье. Коэффициент теплопроводности
- •32. Дифференциальное уравнение теплопроводности. Условия однозначности
- •39. Теплообмен излучением. Основные законы.
- •40. Теплообмен излучением между телами.
- •42. Сложный теплообмен (теплопередача)
- •43. Теплопередача. Основное уравнение теплопередачи. Коэффициент теплопередачи.
- •44. Теплопередача через плоскую однослойную и многослойную плоскую стенку
- •45. Теплопередача через криволинейные однослойные и многослойные стенки.
- •48. Теплопередача при переменных температурах. Средняя разность температур.
- •49. Тепловой баланс теплообменного аппарата и частные случаи.
- •50.Средняя разность температур для сложных схем теплообмена
- •51.Обобщенные уравнения теплопередачи при переменных температурах
- •52. Расчет теплообменный аппаратов первого рода.
- •53. Расчет теплообменный аппаратов второго рода.
- •54. Круговые процессы. Кпд и холодильный коэффициент.
- •55. Обратимый цикл Карно.
- •56. Математическое выражение второго начала термостатики. Основные следствия.
- •57. Математическое выражение второго начала термодинамики. Основные следствия.
- •58. Истечение жидкостей и газов. Основные расчётные соотношения.
- •59.Особенности истечения сжимаемой жидкости. Кризис истечения. Режимы истечения.
- •60.Переход через критическую скорость (сопло Лаваля).
- •61. Особенности истечения через каналы переменного сечения, сопло и диффузор.
- •62. Дросселирование. Эффект Джоуля-Томсона. Основные понятия
- •63. Процессы парообразования, определение параметров насушенного пара, диаграмма h-s.
- •64.Классификация гту:
- •72. Паросиловые установки, цикл Ренкина, методы повышения кпд.
- •73.Схема,рабочий процесс и цикл паросиловой установки с промежуточным перегревом
- •74.Схема,рабочий процесс и цикл паросиловой установки с регенерацией
- •76.Рабочий процесс парокомпрессионной холодильной установки:
- •77. Воздушные холодильные машины.
- •78.Абсорбционная холодильная установка
- •79.Схема,рабочий процесс и цикл теплового насоса
- •82. Индикаторные и эффективные характеристики двигателей внутреннего сгорания
13. Аналитическое выражение первого начала термодинамики
Значения удельных внутренней энергии и энтальпии простого тела однозначно определяются двумя независимыми переменными и могут быть представлены следующим образом:
![]() ;
;
![]()
Изменения внутренней энергии и энтальпии простого тела, как функций состояния, в элементарных процессах являются полными дифференциалами и определяются соотношениями
![]() ;
;
![]()
Д![]()
![]() ля
изохорного процесса (
ля
изохорного процесса (![]() )
частная производная внутренней энергии
по температуре равна истинной изохорной
теплоемкости
а для изобарного процесса (
)
частная производная энтальпии по
температуре равна истинной изобарной
теплоемкости
)
частная производная внутренней энергии
по температуре равна истинной изохорной
теплоемкости
а для изобарного процесса (
)
частная производная энтальпии по
температуре равна истинной изобарной
теплоемкости
В результате подстановки
выражение (1) и (2) в уравнение![]() и разделения переменных
и разделения переменных
![]() Аналитической
форме.
Аналитической
форме.
Выражения в квадратных скобках в литературе часто называют калорическими коэффициентами,
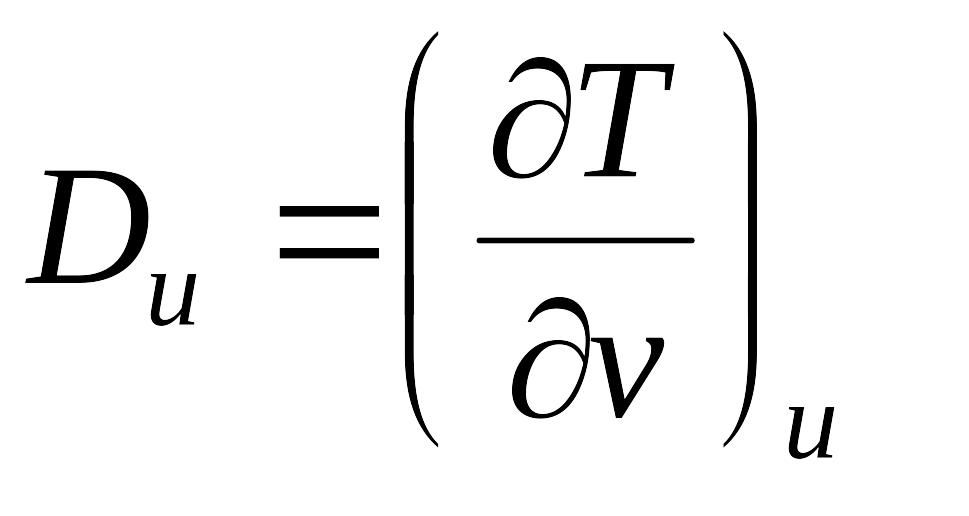
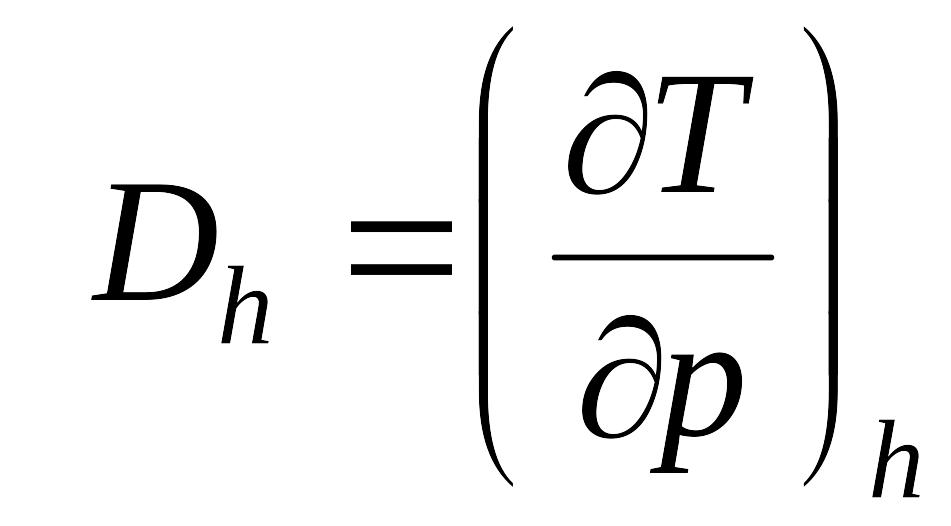
Коэффициент Джоуля - Гей Люссака коэффициент Джоуля-Томсона
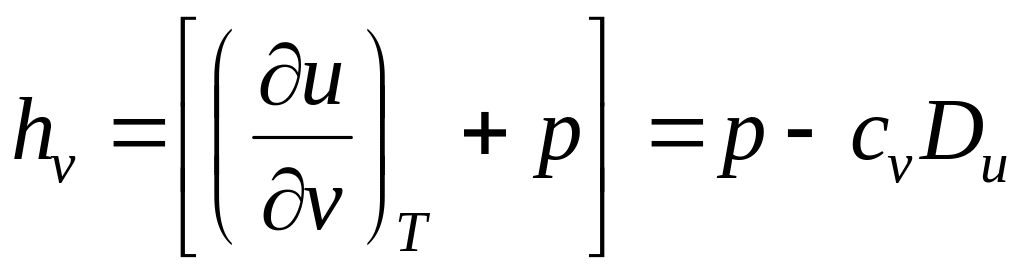
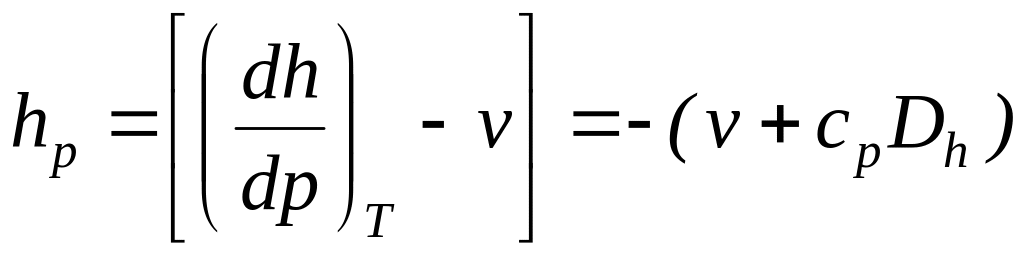
14. Первое начало термодинамики для идеального газа.
Идеальный газ
– система, которая подчиняется уравнению
Менделеева-Клаперона:
![]() и внутренняя энергия системы зависит
только от температуры
и внутренняя энергия системы зависит
только от температуры
![]() .
.
Первое начало термодинамики
для простого тела:
![]() .
Для идеального газа:
.
Для идеального газа:
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
Получим:
.
Получим:
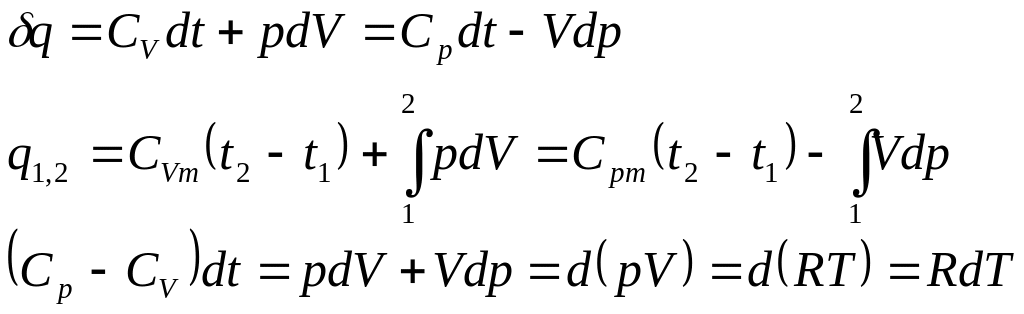 Получили закон Майера:
Получили закон Майера:
![]() .
.
Универсальная газовая
постоянная
![]() .
.
1 5. Принцип существования энтропии идеального газа.
Энтропия
![]() ,
,
![]() .
Удельная энтропия
.
Удельная энтропия
![]() ,
,
![]()
![]()
Принципом существования энтропии идеального газа
Энтропия всё время возрастает. В изолированной системе энтропия может оставаться постоянной.
![]()
При
![]() и температуре
и температуре
![]() удельная энтр
удельная энтр
![]() .
.
![]() ,
где
,
где
![]() - вторая средняя теплоёмкость или
logарифмет.
теплоёмкость.
- вторая средняя теплоёмкость или
logарифмет.
теплоёмкость.
Так как
![]() ,
то если энтропия растёт, то есть
,
то если энтропия растёт, то есть
![]() ,
то тепло подводится, то есть
,
то тепло подводится, то есть
![]() .
.
Уравнение, определяющее энтропию (полученное)
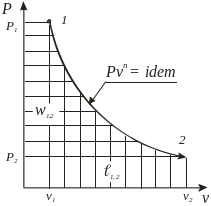
Термодинамические процессы изменения состояния простого тела
Название и уравнение процесса |
Показатель Политропы |
Графическое изображение |
Работа |
Количество теплоты |
Координаты T-S |
1 |
2 |
3 |
4 |
5 |
|
Политропный pvn = idem |
- n +,
n
=
|
|
l1,2
= w1,2 = n ,
1,2
=
=
|
q1,2 = u1,2 + l1,2 = = h1,2 + w1,2 ,
q1,2
=
|
|
Изобарный p = idem, dp = 0 |
n = 0 |
|
l1,2 = p(v2 - v1), w1,2 = 0,
1,2
= |
q1,2 = u1,2 + l1,2 = = h1,2 |
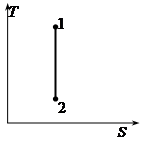
1-2 – изобарный процесс
|
1 |
2 |
3 |
4 |
|
1-2’ – изохорный процесс
|
Изохорный v = idem, dv = 0 |
n = ± ∞ |
|
l1,2 = 0, w1,2 = v(p1 - p2),
1,2
= |
q1,2 = u1,2 = h1,2 + w1,2 |
|
Изопотенциаль-ный pv = idem |
n = 1 |
|
l1,2 = w1,2 =
=
pvln 1,2 = 1 |
q1,2 = u1,2 + l1,2 = = h1,2 + w1,2 |
|
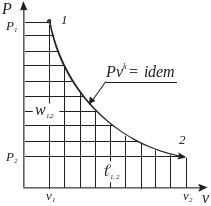
Адиабатный δq = 0, pvk = idem |
n = k = ns =
|
|
l1,2
=
w1,2 = k ,
1,2
=
= |
q1,2 = 0 |
|
27-30. Политропа с постоянным показателем.
Политропным процессом с постоянным показателем называется обратимый термодинамический процесс изменения состояния простого тела.
Уравнение политропного
процесса с постоянным политропным
показателем:
![]()
где - политропный показатель, являющий в рассматриваемом процессе постоянной (- n +). Физический смысл показателя политропы п определяется после дифференцирования выражения
Тогда:

Следовательно постоянный показатель политропы определяется соотношением потенциальной и термодинамической работ в элементарном или конечном процессах.
Показателем политропного
процесса является линейная зависимость
![]() от
от
![]() ,
то есть:
,
то есть:
![]() .
.

![]() 1.
1.
![]() 2.
2.
![]() -истинный
-истинный
показатель политропы.
![]() - второй средний показатель политропы.
- второй средний показатель политропы.
![]() - первый средний показатель политропы.
- первый средний показатель политропы.
П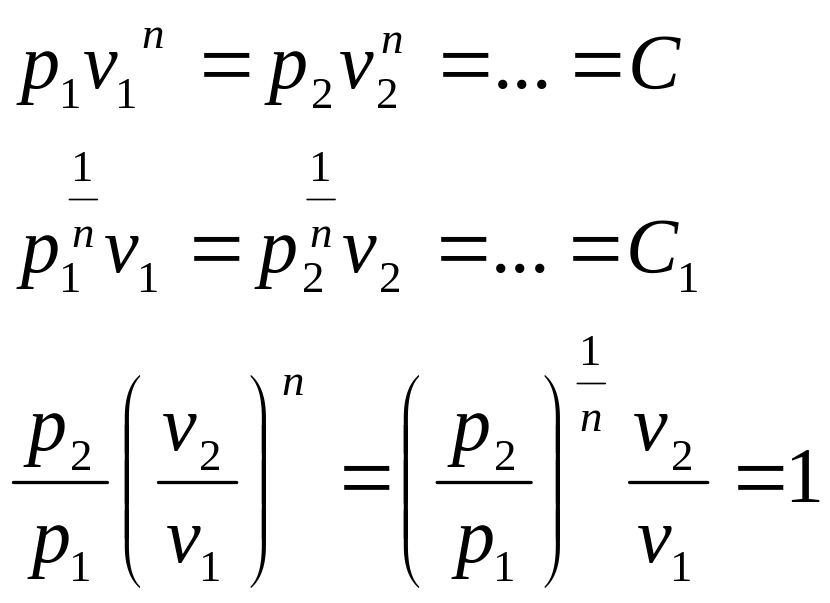 ри
этом политропный показатель может
принимать значения в пределах от минус
бесконечности до плюс бесконечности и
оставаться постоянным в течение процесса.
Если
ри
этом политропный показатель может
принимать значения в пределах от минус
бесконечности до плюс бесконечности и
оставаться постоянным в течение процесса.
Если
![]() ,
то
,
то
![]() ,
следовательно
,
следовательно
![]() ,
то есть процесс изохорический. Если
,
то есть процесс изохорический. Если
![]() ,
то
,
то
![]() ,
следовательно
,
следовательно
![]() ,
то есть процесс изобарический. Если
,
то есть процесс изобарический. Если
![]() ,
то
,
то
![]() ,
следовательно
,
следовательно
![]() .
Так как для идеального газа
.
Так как для идеального газа
![]() ,
то
,
то
![]() .
.
Если уравнением процесса
является уравнение
![]() ,
то в этом процессе
,
то в этом процессе
![]() ,
следовательно
,
следовательно
![]() ,
то есть процесс изоэнергетический.
,
то есть процесс изоэнергетический.
Для идеального газа
![]() ,
следовательно
,
то есть процесс изоэнтальпийный.
,
следовательно
,
то есть процесс изоэнтальпийный.
![]() ,
,![]() - показатель адиабаты,
- политропы,
- показатель адиабаты,
- политропы,
![]() изоэнергетического процесса.
изоэнергетического процесса.
Для адиабатического процесса
![]() .
.
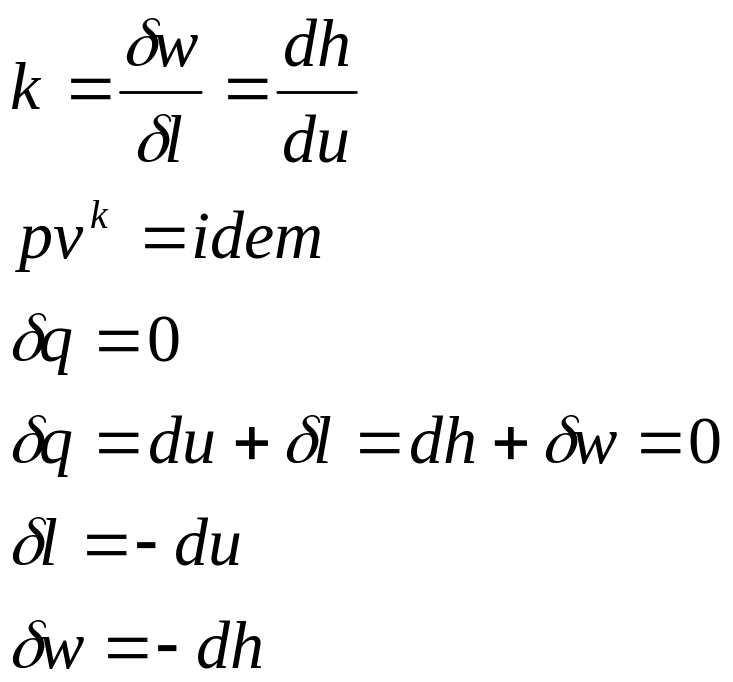
Все уравнения для политропного процесса остаются справедливы и для адиабатического процесса, только вместо политропного показателя используют адиабатический показатель.
Для идеального газа
![]() и
и
![]()
![]()
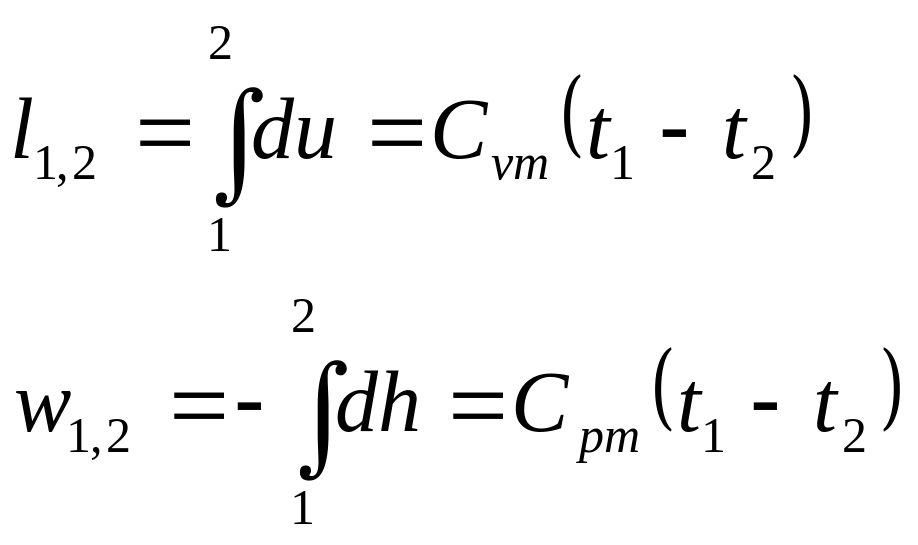
Характеристика растяжения (сжатия).

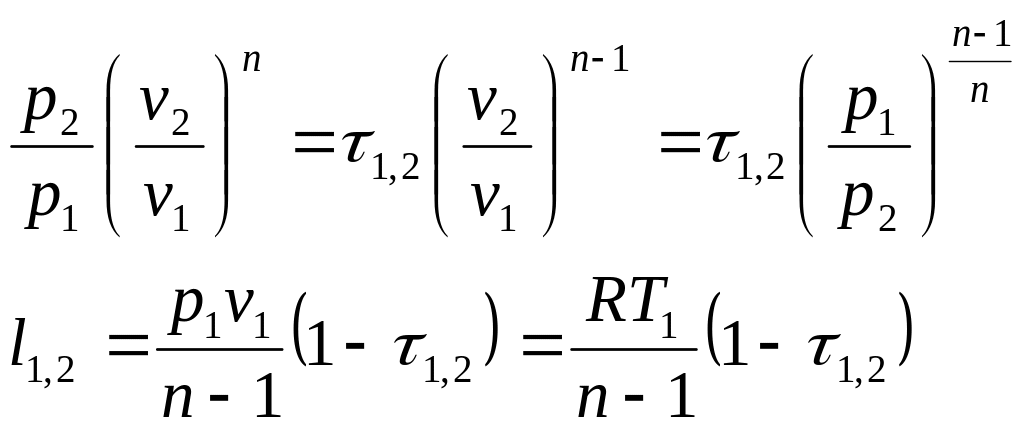
![]() - для идеального газа.
- для идеального газа.
Выражения конечных
(интегральных) величин термодинамической
и потенциальных работ в политропных
процессах можно получить при сопоставлении
их элементарных значений:
![]() ;
;
![]() .
.
После подстановки выражения
для показателя политропы
![]()
![]() ,
или \
,
или \![]() .
.
Интегрируя последнее выражение с учетом того, что процесс подчиняется уравнению политропы с постоянным показателем (n=idem), получаем следующее соотношение для определения удельной термодинамической работы в конечном процессе (1-2)
![]() .
.
Выражения конечных (интегральных) величин термодинамической и потенциальных работ в политропных процессах рассчитываются по следующим соотношениям
![]() .
(1.102)
.
(1.102)
![]() ,
(1.103)
,
(1.103)
где
![]() – характеристика процесса расширения
или сжатия.
– характеристика процесса расширения
или сжатия.
Соотношение
для определения характеристики расширения
или сжатия в рассматриваемом процессе
![]() определяется с учетом зависимостей
(1.101а) и имеет следующий вид:
определяется с учетом зависимостей
(1.101а) и имеет следующий вид:
=
 =
=
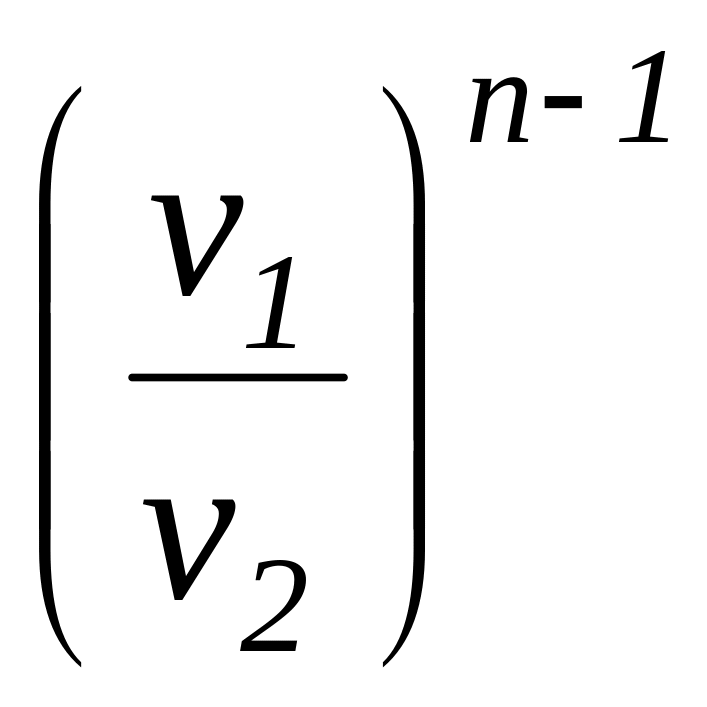 .
(1.104)
.
(1.104)
Расчетное выражения теплообмена для простых тел выводится на основе рассмотрения выражения первого начала термодинамики и имеет следующий вид
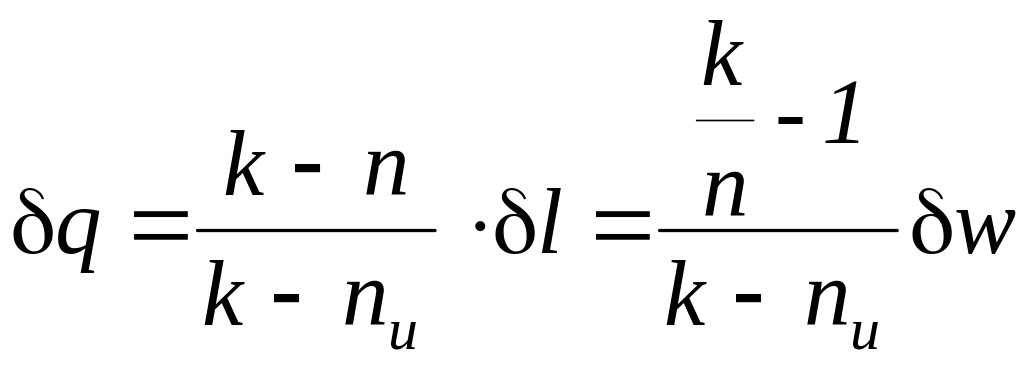 .
.
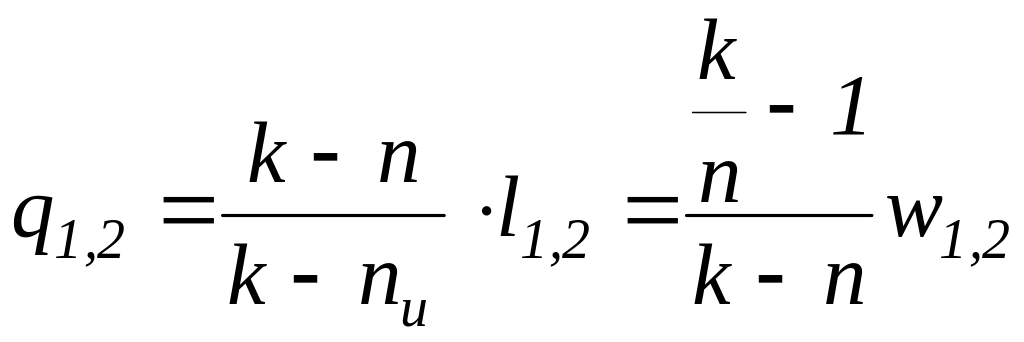 ,
,
где k – показатель адиабаты, n – показатель политропы, nu – показатель изоэнергетического процесса.


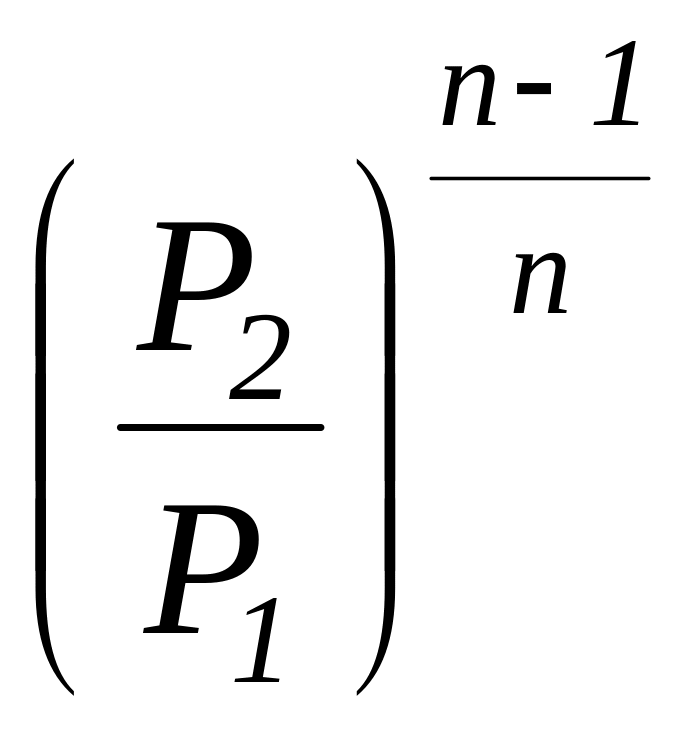 =
=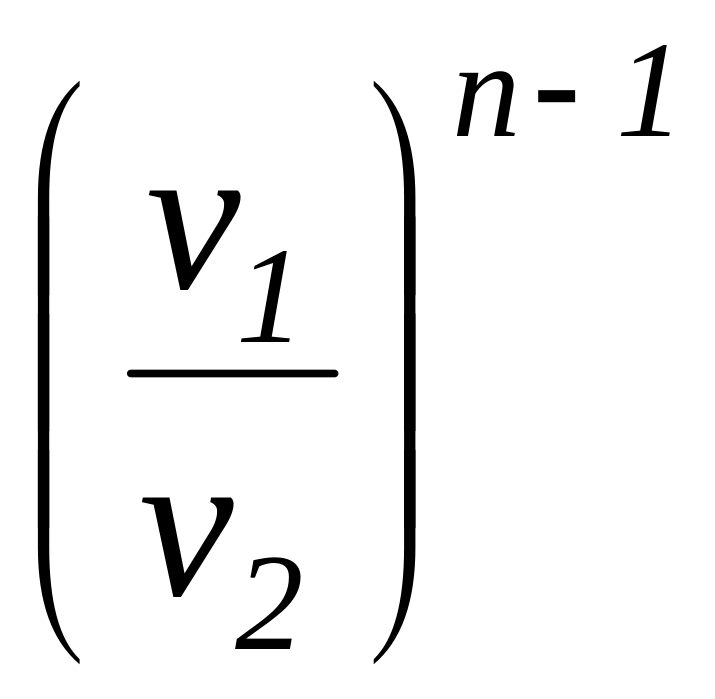 =
=
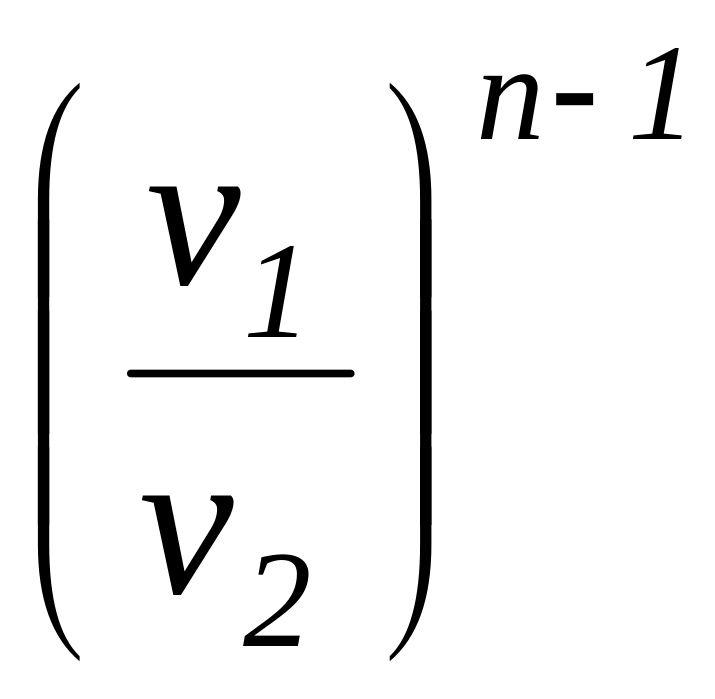 =
=
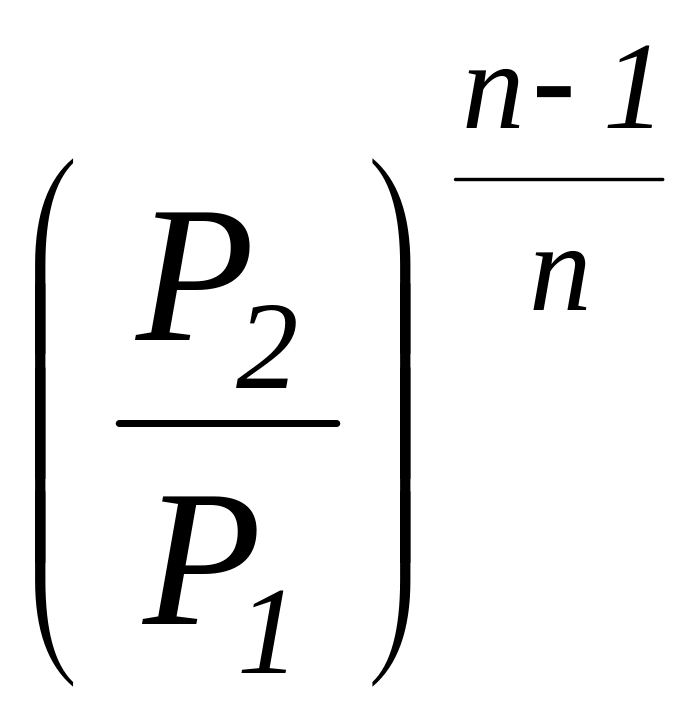 =
=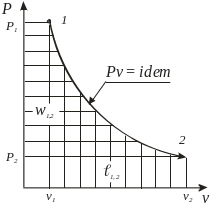
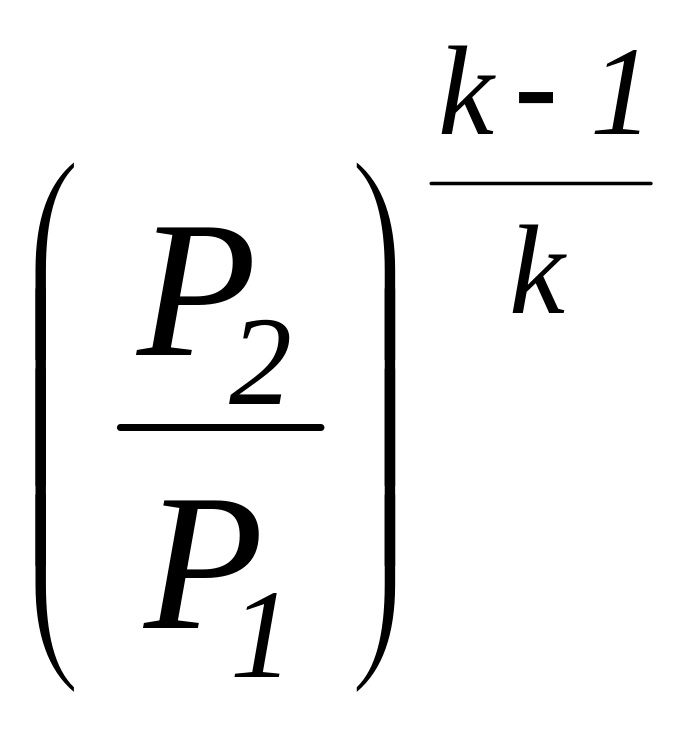 =
=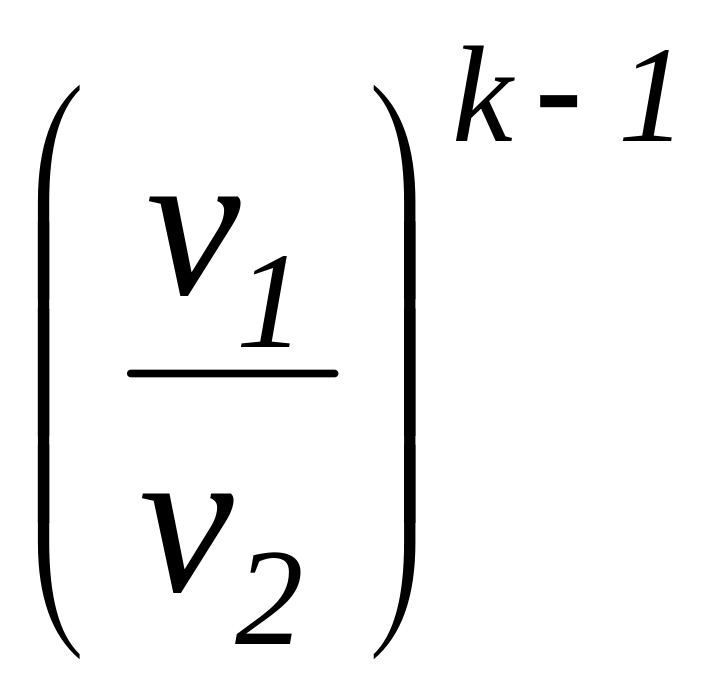 =
=