
Министерство образования и науки российской федерации
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
НЕФТИ И ГАЗА им. И.М.ГУБКИНА
_____________________________________________________________________
Кафедра термодинамики и тепловых двигателей
К.Х.Шотиди, М.М.Шпотаковский
ОПРЕДЕЛЕНИЕ ИЗОБАРНОЙ ТЕПЛОЕМКОСТИ ВОЗДУХА
Методические указания к лабораторной работе по курсам
Термодинамика и Теплотехника
для студентов специальностей: 200503, 130501, 130503,
130504, 151001, 150202, 150205, 130602, 130603, 240401,
240403, 280201, 280202
Москва 2008
ВВЕДЕНИЕ
Знание значений теплоемкостей различных веществ (в основном, жидких и газообразных) необходимо при решении ряда задач термодинамики и теплопередачи в различных отраслях промышленности, когда приходится выполнять теплотехнические расчеты тепловых машин и других устройств, в которых эти вещества являются рабочими телами. В частности, можно рассчитать ряд важных характеристик рабочих тел, к числу которых относятся показатель адиабаты, удельные внутренняя энергия, энтальпия и энтропия, а также определить количество теплоты, передаваемое в различных термодинамических процессах.
Рассчитать значения теплоемкостей (изобарной, изохорной) рабочих тел можно только в результате проведения экспериментас этими телами или на установке, основным элементом которой является калориметр, или на установках с использованием более точных, но относительно сложных методов спектроскопического анализа [1].
В настоящих методических указаниях приведены основные теоретические положения по вопросу определения теплоемкостей различных веществ, а также рассмотрена лабораторная работа, позволяющая определить изобарную теплоемкость воздуха с помощью проточного калориметра [2]. Кроме того, для самоконтроля эффективности освоения изложенного в методических указаниях материала студентам предложен ряд контрольных вопросов.
1. Теоретическая часть
Удельная теплоемкость или просто теплоемкость cz вещества, называемого в дальнейшем рабочим телом или просто телом, представляет собой отношение теплоты qz, подводимой к единице тела или отводимой от него в процессе z (qz является удельной теплотой, измеряемой в (Дж/кг)), к изменению температуры тела t, обусловленному теплообменом qz [3, 4],
cz
=
![]() . (1)
. (1)
Если изменение температуры t стремится к нулю (t 0), то отноше-ние (1) в пределе представляет собой производную от теплоты qz по температуре t
cz
=
![]() , (2)
, (2)
где символ , обозначающий бесконечно малую величину, вместе с тем, указывает на то, что изменение теплоты qz не является полным дифференциалом.
Теплоемкость тела, определяемая соотношением (2), называется истинной, т.е. рассчитанной при температуре t.
Если теплообмен происходит при постоянном давлении p (z p = idem и qz qp), то теплоемкость тела, определяемая соотношением (2), называется изобарной и обозначается cр (cz cр). Если теплообмен происходит при посто-янном объеме, а, значит, и при постоянном удельном объеме v (z v = idem и qz qv), то теплоемкость тела, определяемая соотношением (2), называется изохорной и обозначается cv (cz cv).
Изобарная cр и изохорная cv теплоемкости тела, а также характеристическая газовая постоянная для этого тела R, измеряемая в (Дж/(кгК)), связаны между собой следующим образом:
cр cv = R , (3)
представляющим собой математическое выражение закона Майера. Из формулы (3) следует, что cv cр.
Для
молярных изобарной
![]() и изохорной
и изохорной![]() теплоемкостей тела формула (3) принимает
вид
теплоемкостей тела формула (3) принимает
вид
![]()
![]() =
=
![]() , (4)
, (4)
где
![]()
универсальная газовая постоянная,
универсальная газовая постоянная,
![]() = 8314 (Дж/(кмольК)).
= 8314 (Дж/(кмольК)).
В
зависимости от условий теплообмена
теплоемкость тела может изменяться от
минус бесконечности (![]() )
до плюс бесконечности (+
)
до плюс бесконечности (+![]() ).
Если теплота отводится от тела (qz
< 0) и последнее при этом сжимается так,
чтобы температура его не изменялась (t
= idem,
т.е. dt
= 0), то теплоемкость тела равна минус
бесконечности (cz
=
).
Если теплота отводится от тела (qz
< 0) и последнее при этом сжимается так,
чтобы температура его не изменялась (t
= idem,
т.е. dt
= 0), то теплоемкость тела равна минус
бесконечности (cz
= ![]() ).
Если теплота подводится к телу (qz
> 0) и последнее при этом расширяется
так, чтобы температура его не
изменялась (t
= idem,
т.е. dt
= 0), то теплоемкость тела равна плюс
бесконечности (cz
= +
).
Если теплота подводится к телу (qz
> 0) и последнее при этом расширяется
так, чтобы температура его не
изменялась (t
= idem,
т.е. dt
= 0), то теплоемкость тела равна плюс
бесконечности (cz
= +![]() ).
Для однозначного определения теплоемкости
необходимо указать условия теплообмена
между телом и окружающей средой.
).
Для однозначного определения теплоемкости
необходимо указать условия теплообмена
между телом и окружающей средой.
Если под единицей тела в определении теплоемкости подразумевается единица массы, т.е. 1кг, то qz в этом случае будет измеряться в (Дж/кг), а теплоемкость тела, определяемая соотношением (2), будет называться массовой cz и измеряться в (Дж/(кгК)).
Если под "единицей тела" в определении теплоемкости подразумевается единица объема, т.е. 1 м3, то qz в этом случае будет измеряться в (Дж/м3), а теплоемкость тела, определяемая соотношением (2), будет называться объемной cz и измеряться в (Дж/(м3К)).
Если
под "единицей тела" в определении
теплоемкости подразумевается 1 кмоль,
то qz
в этом случае будет измеряться в
(Дж/кмоль), а теплоемкость тела, определяемая
соотношением (2), будет называться мольной
![]() и измеряться в (Дж/(кмольК)).
и измеряться в (Дж/(кмольК)).
Объемная
cz
и мольная ![]() теплоемкости тела связаны с массовой
теплоемкостью тела cz
следующими соотношениями:
теплоемкости тела связаны с массовой
теплоемкостью тела cz
следующими соотношениями:
cz = cz ; (5)
![]() =
cz
, (6)
=
cz
, (6)
где , соответственно плотность (в (кг/м3)) и молярная масса (в (кг/кмоль)) тела.
В расчетах, как правило, используется массовая теплоемкость cz, которая в дальнейшем называется просто теплоемкость.
Физический смысл массовой (объемной, мольной) теплоемкости тела формулируется, исходя из соотношения (2). Массовая (объемная, мольная) теплоемкость тела представляет собой количество теплоты, которое надо подвести к 1кг (соответственно к 1м3, 1 кмоль) этого тела или отвести от него в термодинамическом процессе z (где z p, v), чтобы изменить температуру этого 1кг (соответственно 1м3, 1 кмоль) тела на один градус (оС или оК).
Как показали экспериментальные исследования, теплоемкость тела зависит от температуры и давления:
cz = cz (t, p) . (7)
В частности, зависимость теплоемкости идеального газаот давления настольконезначительна, что ейпренебрегают, т.е. теплоемкость идеального газа рассматривается как функциятолькотемпературы:
cz = cz (t) . (8)
Поскольку в настоящем разделе методических указаний речь пойдет об экспериментальном определении теплоемкости воздуха при атмосферном давлении, при котором воздух по своим свойствам близокк идеальному газу, в дальнейшем рассматривается теплоемкостьидеального газа, называемого просто "газом".
Если в результате подвода к газу теплоты qz,1-2 в термодинамическом процессе z (z p, v) температура газа увеличивается от t1 до t2 (t1 t2), то теплоемкость газа, рассчитанная в этом случае по формуле
cz,m
=
![]() , (9)
, (9)
называется средней в интервале температур (t1 t2) cz,m, на что указывает индекс m в обозначении теплоемкости в отличие от обозначения истинной теплоемкости газа cz, определяемой соотношением (2). Индексы 1 и 2 в формуле (9) обозначают состояние газа соответственно в начале и в конце термодинамического процесса z.
Для расчета теплоемкости cz,m по формуле (9) необходимо знать зависимость истинной теплоемкости cz от температуры, т.е. иметь соотношение (8).
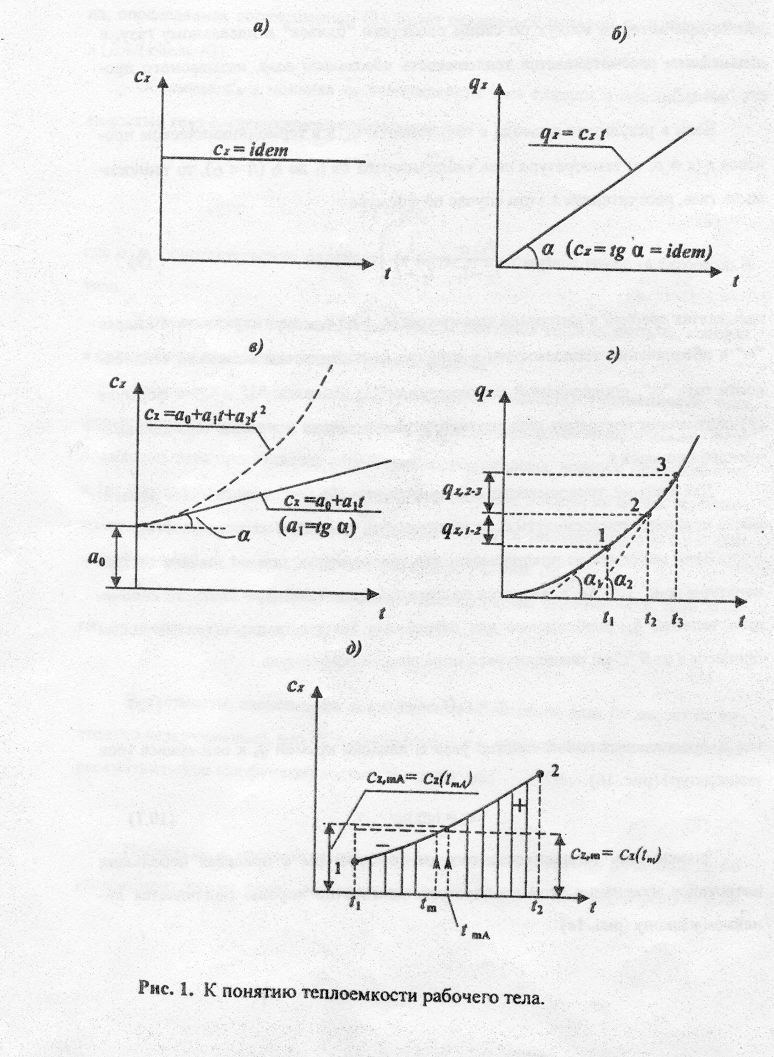
Если исходить из предпосылки, что теплоемкость газа не зависит от температуры (рис. 1а), т.е. cz является постоянной величиной (cz = idem), то количество теплоты qz, необходимое для нагревания 1кг газа в термодинамическом процессе z от 0 °С до температуры t, определится по формуле
qz = cz (t 0)= cz t , (10)
где cz представляет собой тангенс угла наклона прямой qz к оси абцисс (оси температур) (рис. 1б)
cz = tg . (10.1)
Зависимость теплоемкости газа от температуры в пределах небольших интервалов изменения этой температуры достаточно хорошо подчиняется линейному закону (рис. 1в)
cz = a0 + a1t , (11)
где коэффициенты a0 и a1 определяются экспериментально: a0 представляет собой истинную теплоемкость газа при 0 °С, a a1 тангенс угла наклона пря-мой (11) к оси температур (a1 = tg) (рис. 1в). В этом случае график зависимости удельной теплоты qz от температуры t имеет вид, представленный на рис. 1г. Средняя теплоемкость газа в термодинамическом процессе 1-2 cz,1-2 представляет собой тангенс угла 1 наклона секущей 1-2 к оси температур (cz,1-2 = tg1), а средняя теплоемкость газа в термодинамическом процессе 2-3 cz,2-3 представляет собой тангенс угла 2 наклона секущей 2-3 к оси температур (cz,2-3 = tg2). Теплоемкость газа cz,1-2 меньше, чем теплоемкость газа cz,2-3 (cz,1-2 cz,2-3).
При линейной зависимости теплоемкости газа от температуры (см. соотношение (11)) средняя теплоемкость газа в диапазоне изменения температуры (t1t2)cz,mчисленно равна истинной теплоемкости газаczпри средней арифметической температуреtmА= 0,5 (t1+t2) в термодинамическом процессеz(рис. 1д):
cz,m
=
![]() . (12)
. (12)
Нелинейная зависимость истинной теплоемкости газа cz от температуры t представляется в виде
cz = a0 + a1t + a2t2 + ..., (13)
причем обычно ограничиваются первыми тремя слагаемыми, т.е. параболической зависимостью (рис.1в),
cz = a0 + a1t + a2t2 . (14)
Средняя теплоемкость газа в диапазоне изменения температуры (t1 t2) cz,m может быть не равна истинной теплоемкости газа cz, определенной при среднеарифметической температуре для указанного диапазона изменения температуры (см. рис. 1д).
Средняя массовая теплоемкость смеси газов cz,m (в (Дж/(кгК))) рассчитывается по формуле [3, 4]
cz,m
=
![]() , (15)
, (15)
где
N количество компонентов смеси;
mi массовая концентрация i-гo компонента смеси в долях единицы;
cz,m,i средняя массовая теплоемкость i-гo компонента смеси, (Дж/(кгК)).
Средняя
мольная
теплоемкость смеси
газов ![]() (в (Дж/(кмольК)))
определяется по формуле [3, 4]
(в (Дж/(кмольК)))
определяется по формуле [3, 4]
![]() =
=
![]() , (16)
, (16)
где
ri мольная концентрация i-гo компонента смеси в доля единицы;
![]() средняя
мольная теплоемкость i-гo
компонента смеси,
средняя
мольная теплоемкость i-гo
компонента смеси,
(Дж/(кмольК)).
Если
состав газовой смеси задан объемными
концентрациями, равными для идеального
газа мольным концентрациям r,
то объемную теплоемкость смеси при
нормальных физических условиях (давление
и температура равны соответственно 760
мм. рт. ст. и 0 °С)
определяется из соотношения, аналогичного
соотношению (16), с той лишь разницей, что
это соотношение, отнесенное к объему 1
кмоль, надо разделить на этот объем
![]() ,
одинаковый при нормальных условиях для
всех газов:
,
одинаковый при нормальных условиях для
всех газов:![]() =
v
= 22,4 (м3/кмоль)
[4].
=
v
= 22,4 (м3/кмоль)
[4].
Из изложенного следует, что теплоемкость любого вещества определяется только в результате проведения эксперимента с этим веществом.
Структура формул (1) и (9) позволяет спроектировать установку для экспериментального определения теплоемкости рабочего тела. В частности, теплоемкость воздуха при атмосферном давлении можно определить с помощью проточного калориметра 6, по которому прокачивается исследуемый воз-дух (рис. 2). При движении воздуха от сечения I к сечению II, которые расположены соответственно на входе и на выходе калориметра и в которых измеряется температура воздуха, последний нагревается с помощью электрической спирали 6в. Поверхность калориметра должна быть теплоизолирована во избежание теплового взаимодействия нагреваемого воздуха с окружающей средой, т.е. теплота, выделяемая электрической спиралью при прохождении по ней тока, должна полностью пойти на нагрев воздуха, не теряясь при этом в окружающую среду. Кроме того, проходящий по калориметру воздух не должен нагреваться за счет теплоты, которая может поступать из окружающей среды внутрь калориметра.
Формула для расчета изобарной теплоемкости воздуха, как идеального газа, по результатам эксперимента на лабораторной установке, основным элементом которой является проточный калориметр, выводится из первого начала термодинамики по балансу рабочего тела в дифференциальной форме
Q = Q* + Q** = dH + W = dH Vdp , (17)
где
Q полная элементарная теплота (или термодинамический (приведенный) теплообмен), полученная или отданная газом, Дж;
Q * элементарная теплота (или внешний теплообмен), подведенная к газу извне или отданная им в окружающую среду, Дж;
Q ** элементарная теплота внутреннего теплообмена, Дж;
dH элементарное изменение энтальпии газа, Дж;
W элементарная потенциальная работа обратимого перемещения сплошной массы газа из области одного давления в область другого давления, Дж;
V объем газа, м3;
dp элементарное изменения абсолютного давления газа, Па.
В формуле (17) символы и d указывают на то, что изменение рассматриваемой величины представляет собой соответственно неполный и полный дифференциал.
Для термодинамического процесса 1-2 после интегрирования от первого состояния газа (в сечении I на рис. 2) ко второму (в сечении II на рис. 2) соотношение (17) принимает вид
Q1,2
=
![]() +
+![]() =H2
Hl
+ V
(p1
p2)
. (18)
=H2
Hl
+ V
(p1
p2)
. (18)
Уменьшение давления воздуха при движении его между сечениями I и II калориметра (p1 p2) (см. рис. 2), обусловленное трением, мало и им можно пренебречь:
(p1 p2) 0 . (19)
Внешний
теплообмен
![]() равен алгебраической сумме теплоты
Qэ.н,
подводимой к воздуху от электрического
нагревателя, и теплоты Qт.п,
теряемой с поверхности калориметра в
окружающую среду:
равен алгебраической сумме теплоты
Qэ.н,
подводимой к воздуху от электрического
нагревателя, и теплоты Qт.п,
теряемой с поверхности калориметра в
окружающую среду:
![]() =
Qэ.н
+ Qт.п
. (20)
=
Qэ.н
+ Qт.п
. (20)
В связи с тем, что поверхность калориметра теплоизолирована (Qт.п 0), соотношение (20) принимает вид
![]() =
Qэ.н
, (21)
=
Qэ.н
, (21)
т.е.
внешний теплообмен
![]() представляет собой теплоту Qэ.н,
полученную воздухом от электрического
нагревателя.
представляет собой теплоту Qэ.н,
полученную воздухом от электрического
нагревателя.
Поскольку
воздух в калориметре, как уже отмечено,
по своим свойствам близок
к идеальному
газу, теплотой
![]() можно пренебречь (в реальном процессе
при параметрах воздуха в условиях
эксперимента теплота внутреннего
теплообмена
можно пренебречь (в реальном процессе
при параметрах воздуха в условиях
эксперимента теплота внутреннего
теплообмена
![]() мала по сравнению с теплотой внешнего
теплообмена
мала по сравнению с теплотой внешнего
теплообмена
![]() (
(![]()
![]() )):
)):
![]() 0
. (22)
0
. (22)
С учетом соотношений (21) и (22) приведенный теплообмен в процессе нагревания воздуха в калориметре Q1,2 определяется следующим образом:
Q1,2
=
![]() +
+![]() =Qэ.н
. (23)
=Qэ.н
. (23)
Изменение энтальпии реального газа в элементарном процессе dH (в Дж) определяется из соотношения
dH
= Gdh
= G
![]() , (24)
, (24)
где
G масса реального газа, кг;
dh изменение удельной энтальпии реального газа, (Дж/кг);
cр изобарная теплоемкость реального газа, (Дж/(кгК));
dt изменение температуры реального газа t, К;
dp изменение абсолютного давления реального газа р, Па.
Энтальпия воздуха, рассматриваемого в нашем случае как идеальный газ, в соответствии с законом Джоуля зависит только от температуры и поэтому частная производная от удельной энтальпии h по давлению р при постоянной температуре t равна нулю ((h/p)t = 0). С учетом этого соотношение (24) принимает вид
dH = G cp dt . (25)
Применительно к процессу нагревания воздуха в калориметре между сечениями IиII(см. рис. 2) соотношение (25) запишется следующим образом:
H2 H1 = G cp,m (t2 t1) , (26)
где
cp,m средняя в интервале температур (t1 t2) изобарная теплоемкость воздуха.
С учетом соотношений (19), (23) и (26) первое начало термодинамики по балансу рабочего тела в интегральной форме (18) запишется следующим образом:
Qэ.н = G cp,m (t2 t1) . (27)
Если процесс подвода теплоты отнести к единице времени (к одной секунде), то в формуле (27) Qэ.н (в Дж) надо заменить на мощность электрического нагревателя Nэ.н (Qэ.н Nэ.н, где Nэ.н в Вт), т.е. на теплоту, выделяемую нагревателем за одну секунду, а массу воздуха G (в кг) на массовый расход воздуха Gс (G Gс, где Gс в (кг/с)). С учетом этого из соотношения (27) получается формула для расчета средней в интервале изменения температуры (t1 t2) изобарной теплоемкости воздуха по результатам проведения эксперимента
cp,m
=
![]() , (28)
, (28)
где
t1, t2 температура воздуха соответственно до и после нагревания его
в проточном калориметре, °C.
