
- •1. Основные определения и понятия термодинамики
- •2. Параметры состояния и уравнения состояния.
- •3.Термодинамическая работа, координаты p-V
- •4. Потенциальная (техническая) работа
- •5. Теплоемкость. Определение теплоемкости веществ.
- •Вопрос 8. Определение температуры смеси. Теплоемкость смеси
- •Вопрос 9. Термодинамические условия фазовых переходов.
- •Вопрос 10. Критические параметры чистого вещества и смесей.
- •Вопрос 11. Теория соответственных состояний. Коэффициент сжимаемости.
- •13. Аналитическое выражение первого начала термодинамики
- •14. Первое начало термодинамики для идеального газа.
- •1 5. Принцип существования энтропии идеального газа.
- •31. Теплопроводность. Закон Фурье. Коэффициент теплопроводности
- •32. Дифференциальное уравнение теплопроводности. Условия однозначности
- •39. Теплообмен излучением. Основные законы.
- •40. Теплообмен излучением между телами.
- •42. Сложный теплообмен (теплопередача)
- •43. Теплопередача. Основное уравнение теплопередачи. Коэффициент теплопередачи.
- •44. Теплопередача через плоскую однослойную и многослойную плоскую стенку
- •45. Теплопередача через криволинейные однослойные и многослойные стенки.
- •48. Теплопередача при переменных температурах. Средняя разность температур.
- •49. Тепловой баланс теплообменного аппарата и частные случаи.
- •50.Средняя разность температур для сложных схем теплообмена
- •51.Обобщенные уравнения теплопередачи при переменных температурах
- •52. Расчет теплообменный аппаратов первого рода.
- •53. Расчет теплообменный аппаратов второго рода.
- •54. Круговые процессы. Кпд и холодильный коэффициент.
- •55. Обратимый цикл Карно.
- •56. Математическое выражение второго начала термостатики. Основные следствия.
- •57. Математическое выражение второго начала термодинамики. Основные следствия.
- •58. Истечение жидкостей и газов. Основные расчётные соотношения.
- •59.Особенности истечения сжимаемой жидкости. Кризис истечения. Режимы истечения.
- •60.Переход через критическую скорость (сопло Лаваля).
- •61. Особенности истечения через каналы переменного сечения, сопло и диффузор.
- •62. Дросселирование. Эффект Джоуля-Томсона. Основные понятия
- •63. Процессы парообразования, определение параметров насушенного пара, диаграмма h-s.
- •64.Классификация гту:
- •72. Паросиловые установки, цикл Ренкина, методы повышения кпд.
- •73.Схема,рабочий процесс и цикл паросиловой установки с промежуточным перегревом
- •74.Схема,рабочий процесс и цикл паросиловой установки с регенерацией
- •76.Рабочий процесс парокомпрессионной холодильной установки:
- •77. Воздушные холодильные машины.
- •78.Абсорбционная холодильная установка
- •79.Схема,рабочий процесс и цикл теплового насоса
- •82. Индикаторные и эффективные характеристики двигателей внутреннего сгорания
Вопрос 9. Термодинамические условия фазовых переходов.
Различают три агрегатных состояния простых систем: твердое, жидкое и газовое.
С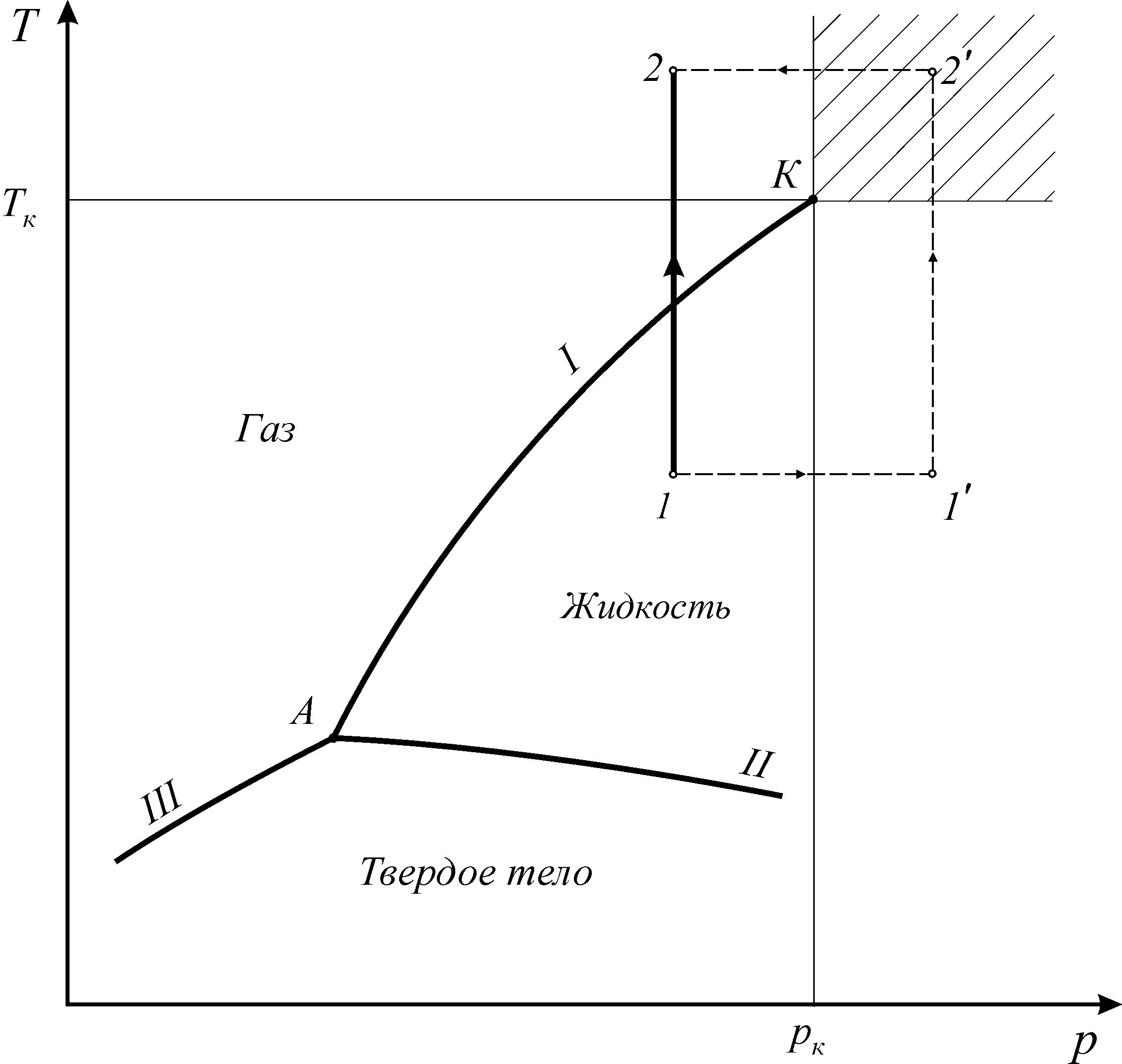 помощью фазовой диаграммы можно
проследить переход тела из одного
агрегатного состояния в другое.
помощью фазовой диаграммы можно
проследить переход тела из одного
агрегатного состояния в другое.
Линии фазовых превращений (испарение - I, плавление - II, сублимации - III) отображают термодинамическое равновесие двухфазных систем и делят диаграмму на области различных агрегатных состояний.
Фазами системы называются области, ограниченные поверхностями раздела. На линиях фазовых превращений существует однозначная зависимость между давлением и температурой. Эти линии пересекаются в тройной точке, где вещество одновременно находится в трех агрегатных состояниях. Параметры тройной точки принадлежат к термодинамическим константам вещества.
Энергетической
границей между жидкостью и паром является
теплота
испарения,
а между твердым телом и жидкостью –
теплота
плавления.
Процессы испарения и плавления протекают
при постоянной температуре, то теплоты
испарения, плавления и сублимации есть
теплоты изотермических превращений.
Теплота
фазового перехода
обозначается символом
![]() (количество
теплоты, которое надо подвести, чтобы
перейти из одного агрегатного состояния
в другое).
(количество
теплоты, которое надо подвести, чтобы
перейти из одного агрегатного состояния
в другое).
Интерес для проведения технических расчетов представляют Г и Ж. При увеличении давления термодинамическое различие в их свойствах заметно уменьшается и критической точке исчезает вовсе
Вопрос 10. Критические параметры чистого вещества и смесей.
Критические
параметры являются важнейшими
термодинамическими постоянными вещества.
Критическая температура
![]() –
это температура, при которой и выше
которой газ никаким сжатием не может
быть переведен в жидкое состояние.
Критическое давление
–
это температура, при которой и выше
которой газ никаким сжатием не может
быть переведен в жидкое состояние.
Критическое давление
![]() –
это такое давление, при котором и выше
которого жидкость невозможно перевести
в газообразное состояние никаким
изменением температуры.
–
это такое давление, при котором и выше
которого жидкость невозможно перевести
в газообразное состояние никаким
изменением температуры.
В
закритической области (![]() )
вещество может находиться только в
однофазном состоянии. Переход из
состояния 1
в состояние 2
возможен кратчайшим путем по линии 1-2.
Можно этот переход осуществить через
закритическую область, то есть без
изменения агрегатного состояния,
например по линии
)
вещество может находиться только в
однофазном состоянии. Переход из
состояния 1
в состояние 2
возможен кратчайшим путем по линии 1-2.
Можно этот переход осуществить через
закритическую область, то есть без
изменения агрегатного состояния,
например по линии
![]() (рис. 1.3).
(рис. 1.3).
Условным признаком непрерывности однофазного состояния вещества является возможность перехода его из любого однофазного исходного состояния в другое однофазное состояние путем непрерывных изменений параметров состояния, минуя фазовые энергетические барьеры.
Поэтому
в принципе, для простых тел (однородных
систем) должно существовать единое
уравнение состояния
![]() ,
описывающее любое однофазное состояние
вещества. Такого уравнения пока еще не
получено. Ниже рассмотрим уравнения
состояния идеальных и реальных газов.
,
описывающее любое однофазное состояние
вещества. Такого уравнения пока еще не
получено. Ниже рассмотрим уравнения
состояния идеальных и реальных газов.
Идеальными газами называются газы, у которых молекулы представляют собой материальные точки и между молекулами отсутствуют силы взаимодействия.
При относительно низком давлении и высоких температурах реальные газы имеют малую плотность и, с известным допущением, могут рассматриваться как газы идеальные.
Уравнение состояния идеальных газов - уравнение Клапейрона:
для
1 кг газа
![]() ;
для
;
для
![]() кг газа
кг газа
![]() ,
,
где
![]() – характеристическая постоянная газа;
Т
– абсолютная температура газа
– характеристическая постоянная газа;
Т
– абсолютная температура газа
Используя уравнение Авагадро уравнение Клапейрона можно привести к виду:
для
1
кмоля газа
![]() ;
для
;
для
![]() кмолей газа
кмолей газа
![]()
где
![]() (
Дж/кмоль К
) – универсальная
газовая
постоянная, не зависит от природы газов
(
Дж/кмоль К
) – универсальная
газовая
постоянная, не зависит от природы газов
Отсутствие теоретически обоснованного единого уравнения состояния реального газа привело к выводу большого количества эмпирических и полуэмпирических уравнений состояния, справедливых для отдельных газов в ограниченном диапазоне изменения параметров их состояния.
