
- •Содержание:
- •1.Определение. Общая формула.
- •2.Классификация. Номенклатура. Важнейшие представители (международное и тривиальное название).
- •3. Изомерия.
- •1. Изомерия углеродного скелета
- •2. Изомерия положения функциональных групп
- •3. Оптическая изомерия
- •4.Строение.
- •5.Получение в лабораторных и промышленных условиях.
- •6.Физические свойства.
- •7. Химические свойства.
- •8.Применение.
3. Изомерия.
1. Изомерия углеродного скелета

2. Изомерия положения функциональных групп

3. Оптическая изомерия
Все a-аминокислоты, кроме глицина H2N-CH2-COOH, содержат асимметрический атом углерода (a-атом) и могут существовать в виде оптических изомеров (зеркальных антиподов).

4.Строение.
α-Аминокислоты содержат одновременно основную аминную и кислую карбоксильные группы. Поэтому они могут давать соли как с основаниями, так и с кислотами, т.е. являются амфотерными соединениями:
+
![]() Cl-[NH3CH2COOH]
[H2NCH2COO-]Na+
Cl-[NH3CH2COOH]
[H2NCH2COO-]Na+
хлоргидрат глицина натриевая соль глицина
Водные растворы одноосновных моноаминокислот имеют почти нейтральную реакцию(РН=6,8).
Ряд фактов свидетельствует о солеобразном строении аминокислот. Так, например, известно, что слабо диссоциированные жирные кислоты в водных растворах обнаруживают характерную для недиссоциированной карбоксильной группы линию в ИК-спектре. Эта линия исчезает при добавлении к раствору сильной щелочи вследствие почти полной диссоциации образующейся соли. Первичные амины же в виде оснований обнаруживают в ИК-спектрах интенсивные линии. Оказалось, что в ИК-спектрах растворов аминокислот и те и другие линии отсутствуют.
При подкислении раствора аминокислоты появляется линия, соответствующая карбоксильной группе, а при подщелачивании – линия, характерная для аминогруппы.
На основании приведенных фактов следует признать, что в аминокислотах нет ни свободной аминогруппы, ни карбоксильной группы. Они представляют собой внутренние соли, у которых карбоксильная группа ионно связана с аммониевым атомом азота:
+
H3N-CH2COO-
В водных растворах молекулы аминокислот ведут себя как биполярные ионы:

Под действием электрического тока они мигрируют к аноду или к катоду в зависимости от рН среды. Если этот процесс проводят на хроматографической бумаге или в гелях, то он называется электрофорезом. Этот метод часто применяют для идентификации и разделения аминокислот. В связи с тем, что в зависимости от строения молекулы могут преобладать либо кислотные свойства карбоксила, либо основные свойства аминогруппы, в водных растворах аминокислот рН среды отличается от 7. Но на кривой титрования аминокислоты имеется значение рН, при котором число групп NH3+ оказывается точно равным числу групп – COO- . Следовательно, при этом РН в условиях электрофореза переноса ионов происходить не будет. Такое значение рН называют изоэлектрической точкой.
5.Получение в лабораторных и промышленных условиях.
Действие аммиака на α-галогенкислоты. Подобно тому, как амины образуются при действии аммиака на галогенопроизводные углеводородов, аминокислоты могут быть получены действием аммиака на α-галогенкислоты:
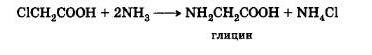
В настоящее время этот метод является основным промышленным методом синтеза α-аминокислот.
Циангидридный метод. α-аминокислоты получают действием аммиака на
α-оксинитрилы, которые при омылении дают соответствующие аминокислоты. Так как оксинитрилы получаются присоединением синильной кислоты к альдегидам и кетонам, эта реакция позволяет перейти от альдегидов и кетонов к аминокислотам (циангидридный синтез):

Как показал Н.Д. Зелинский, α-аминокислоты получаются сразу при действии на альдегиды и кетоны водного раствора цианида калия и хлорида аммония с последующим гидролизом. В результате обмена образуются хлорид калия и цианид аммония:
![]()
Цианид аммония, вступая в реакцию с альдегидом и кетоном, непосредственно образует аминонитрил.
Восстановление α-нитрокислот, оксимов или гидразонов α-оксокислот:

α-Аминокислоты получаются также при каталитическом восстановлении оксокарбоновых кислот водородом в присутствии аммиака:

Метод В.В. Феофилактова. При действии на замещенные ацетоуксусные эфиры солей фенилдиазония в щелочной среде идет азосочетание, затем гидролиз, отщепляется уксусная кислота и образуется неустойчивое азосоединение, изомеризирующееся в фенилгидразон α-кетокислоты:

Восстановление фенилгидразона кетокислоты водородом в момент выделения (Zn+HСl) приводит к α-аминокислоте:

