
«Ангидриды карбоновых кислот»
План:
Определение. Общая формула.
Классификация. Номенклатура. Важнейшие представители (международное и тривиальное название.)
Строение.
Получение в лабораторных и промышленных условиях.
Физические свойства.
Химические свойства с написанием реакций, названием продуктов.
Применение.
Литература.
Карбоновые кислоты - класс органических соединений, содержащих карбоксильную группу (карбоксил). В зависимости от природы радикала, связанного с группой — COOH, Карбоновые кислоты могут принадлежать к алифатическому (жирному), алициклическому, ароматическому или гетероциклическому ряду. По числу карбоксильных групп в молекуле различают одно-, двухи многоосновные (соответственно моно-, дии поликарбоновые) кислоты. Кроме того, Карбоновые кислоты могут быть насыщенными (предельными) и ненасыщенными (непредельными), содержащими в молекулах двойные или тройные связи.
Номенклатура.
Номенклатура ИЮПАК разрешает сохранять их тривиальные названия (см. таб. 1). Для более сложных случаев названия кислот проиводят от названия углеводородов с тем же числом атомов углерода, что и в молекуле кислоты, с добавлением окончания - овая и слова кислота. Муравьиная кислота Н-СООН называется метановой кислотой, уксусная СН3-СООН - этановой кислотой. В большинстве случаев пользуются тривиальными названиями, которые обыкновенно указывают на природный источник, из которого была выделена кислота.
Таблица 1.
Названия и формулы некоторых карбоновых кислот.
Муравьиная |
НСООН |
Уксусная |
СН3СООН |
Пропионовая |
С2Н5СООН |
Масляная |
С3Н7СООН |
Изомасляная |
(СН3)2СООН |
Валериановая |
СН3(СН2)3СООН |
Капроновая |
СН3(СН2)4СООН |
Щавелевая |
НООС - СООН |
Малоновая |
НООС- СН2 - СООН |
Янтарная |
НООС-( СН2)2 - СООН |
Глутаровая |
НООС- (СН2)3 - СООН |
Адипиновая |
НООС- (СН2)4 - СООН |
Акриловая |
СН2 = СНСООН |
Кротоновая |
транс- СН3СН = СНСООН |
Изокротоновая |
цис- СН3СН = СНСООН |
Олеиновая |
цис- СН3(СН2)7СН = СН(СН2)7СООН |
Элаидиновая |
транс- СН3(СН2)7СН = СН(СН2)7СООН |
Линолевая |
СН3(СН2)4СН = СНСН2СН = СН(СН2)7СООН |
Бензойная |
С6Н5СООН |
Фталевая |
о- С6Н4(СООН)2 |
Терефталевая |
п - С6Н4(СООН)2 |
Физические свойства.
Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в воде. С повышением относительной молекулярной массы растворимость кислот в воде уменьшается, а температура кипения повышается. Высшие кислоты, начиная с пеларгоновой (н-нонановой) СН3-(СН2)7-СООН, — твердые вещества, без запаха, нерастворимые в воде.
Химические свойства.
Кислотные свойства обусловлены способностью Карбоновые кислоты к диссоциации в водном растворе:
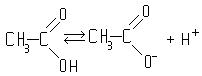
Как правило, Карбоновые кислоты слабее минеральных. Константы диссоциации одноосновных насыщенных кислот жирного ряда при 25°С изменяются от 1,7.10-4(муравьиная кислота) до 1,3.10-5 (высшие гомологи). Сила Карбоновые кислоты существенно зависит также от электрофильности радикала, связанного с карбоксилом. Введение электроотрицательных заместителей (например, NO2, CN, Cl) в положение, соседнее с карбоксильной группой, резко повышает кислотность, например циануксусная кислота CNCH2COOH примерно в 200 раз сильнее уксусной кислоты CH3COOH. По мере удаления от карбоксила влияние заместителей ослабевает. Дикарбоновые кислоты сильнее монокарбоновых, причём влияние одного карбоксила на другой тем больше, чем они ближе расположены друг к другу. Так, в ряду кислот щавелевая кислота HOOC—COOH сильнее малоновой кислоты HOOCCH2COOH, которая, в свою очередь, сильнее янтарной HOOC (CH2)2COOH, и т.д. Кислотность непредельных кислот выше, чем предельных; влияние двойной связи тем сильнее, чем она ближе расположена к карбоксилу. Так, акриловая кислота CH2=CH—СООН в 4 раза сильнее пропионовой CH3—CH2—COOH. Ароматические кислоты сильнее предельных алифатических (например, константа диссоциации бензойной кислоты 6,5.10-5).
Наиболее важные химические свойства, характерные для большинства карбоновых кислот:
1) Карбоновые кислоты при реакции с металлами или их осно́вными гидроксидами дают соли соответствующих металлов:
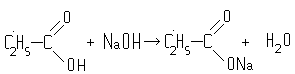
натриевая соль пропионовой к-ты
2) Также карбоновые кислоты могут вытеснять более слабую кислоту из её соли:
CH3COOH + NaHCO3 = CH3COONa + H2CO3
(потом H2CO3 разлагается на углекислый газ и воду)
3) Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):
CH3COOH + СН3СН2ОН = CH3COOСН2СН3 + H2O
4) При нагревании аммонийных солей карбоновых кислот образуются их амиды:
CH3COONH4 = CH3CONH2 + H2O
5) Действие галоидных соединений фосфора. При действии галоидных соединений фосфора на органические кислоты гидроксильная группа карбоксила замещается на галоид:
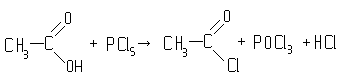
В результате этой реакции образуются галоидангидриды кислот (в данном случае хлорангидрид уксусной кислоты), представляющие собой производные кислот, в которых гидроксильная группа замещена на галоид.
Эта реакция указывает на некоторое сходство карбоновых кислот и спиртов; в спиртах при действии галоидных соединений фосфора также происходит замена гидроксила на галоид с образованием галоидпроизводных углеводородов.
6) Восстановление кислот. При восстановлении кислот образуются соответствующий альдегид, который при дальнейшем восстановлении превращается в спирт:
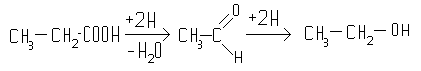
Обычно восстанавливают не сами кислоты, а их хлорангидриды, ангидриды или сложные эфиры.
