«Амиды и имиды карбоновых кислот на примере формамида, сукцимида, ε-капролактам. Полиимиды»
СОДЕРЖАНИЕ
«Амиды и имиды карбоновых кислот на примере формамида, сукцимида, ε-капролактам. Полиимиды» 1
СОДЕРЖАНИЕ 2
АМИДЫ И ИМИДЫ КАРБОНОВЫХ КИСЛОТ, ЛАКТАМЫ 3
1. МЕТОДЫ ПОЛУЧЕНИЯ 3
2. ФИЗИЧЕСКИЕ СВОЙСТВА И СТРОЕНИЕ 3
3. ХИМИЧЕСКИЕ СВОЙСТВА 4
АМИДЫ 4
ИМИДЫ 7
4. ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ 11
Литература 14
АМИДЫ И ИМИДЫ КАРБОНОВЫХ КИСЛОТ, ЛАКТАМЫ
1. МЕТОДЫ ПОЛУЧЕНИЯ
Амиды и имиды карбоновых кислот получают взаимодействием карбоновых кислот или их функциональных производных с аммиаком или аминами. Наиболее трудно реагируют сами карбоновые кислоты. Вначале образуются аммониевые соли, которые при нагревании выше 200 °С превращаются в амиды или имиды:
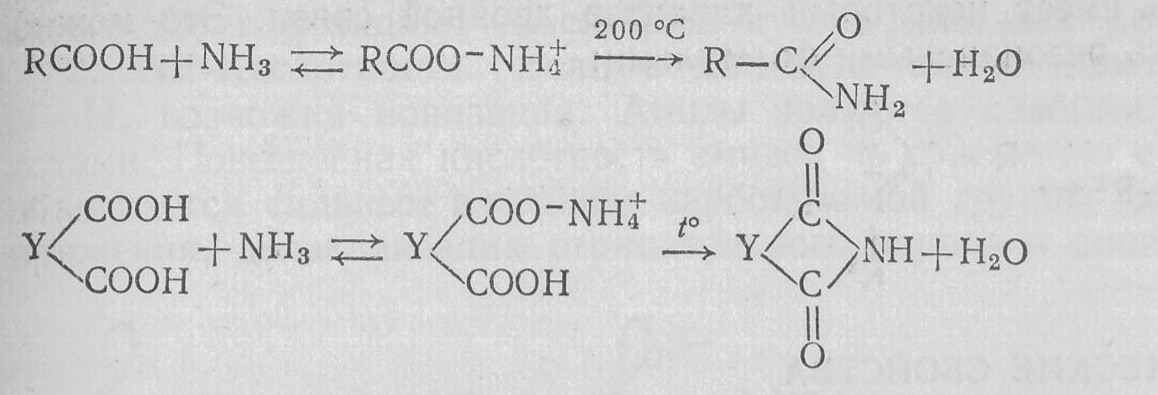
- и -Аминокарбоновые кислоты легко циклизуются в лактамы:
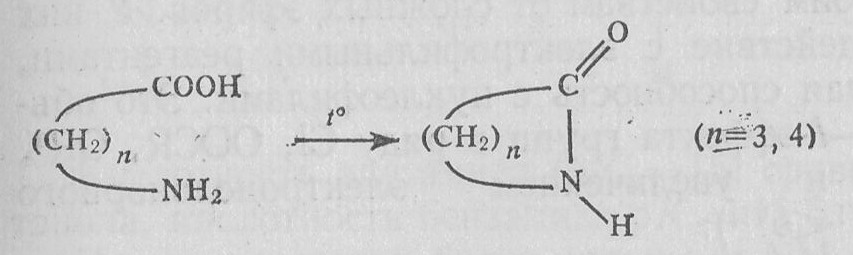
Легко реагируют с аммиаком и аминами ацилгалогениды, ангидриды, сложные эфиры:
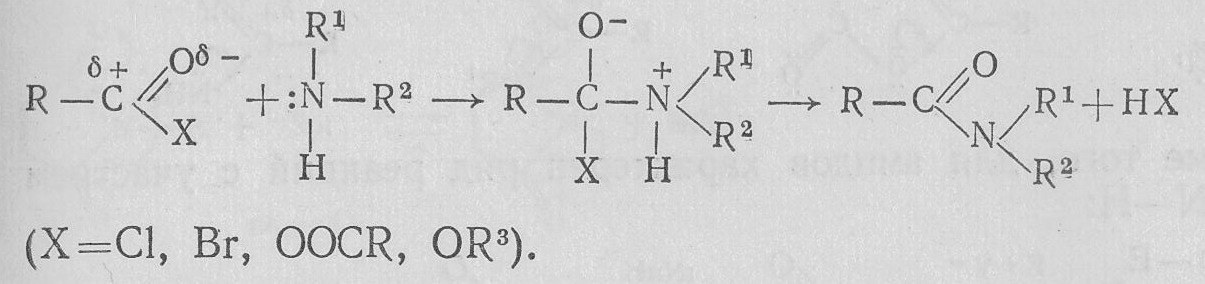
2. Физические свойства и строение
Амиды и имиды представляют собой бесцветные кристаллические вещества или жидкости, растворяющиеся в воде и органических растворителях. Амиды, в молекулах которых имеются связи N—Н, ассоциированы вследствие образования межмолекулярных водородных связей и имеют более высокие температуры кипения.
В молекулах амидов осуществляется значительное взаимодействие между неподеленной электронной парой атома азота и п-электронной системой двойной связи С=O. Образуется сопряженная система связей, изменяются природа связей С—N и С=O и распределение электронной плотности. В результате связь С—N становится короче, а связь С=O несколько длиннее по сравнению с несопряженными соединениями:
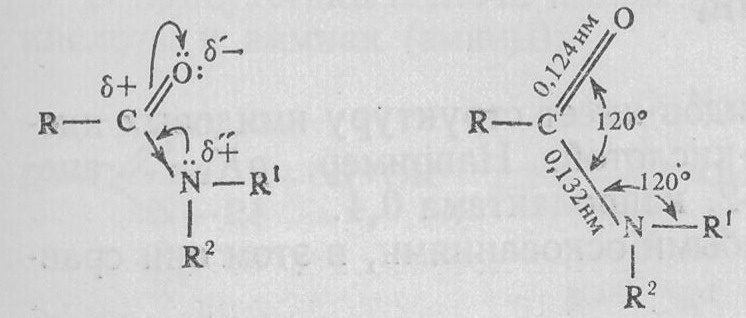
Атомы амидной группировки С(CO)N находятся в одной плоскости, вращение по амидной связи С—N в значительной степени заторможено, связь имеет некоторый характер двойной связи. Это можно изобразить резонансными формулами:
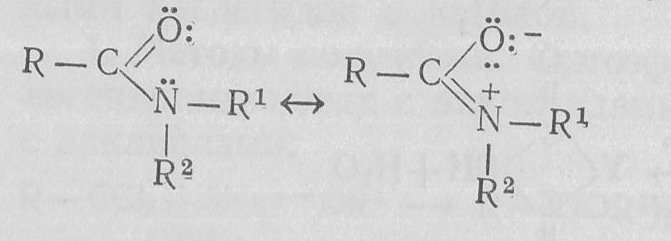
3. Химические свойства амиды
Амиды отличаются по своим свойствам от сложных эфиров. У них более выражено взаимодействие с электрофильными реагентами, но уменьшена реакционная способность с нуклеофилами. Это объясняется уменьшением — I-эффекта групп в ряду CI, OOCR, OR1, NH2 (>I>II>III) и увеличением электронодонорного +М-эффекта (IV<V<VI<VII):
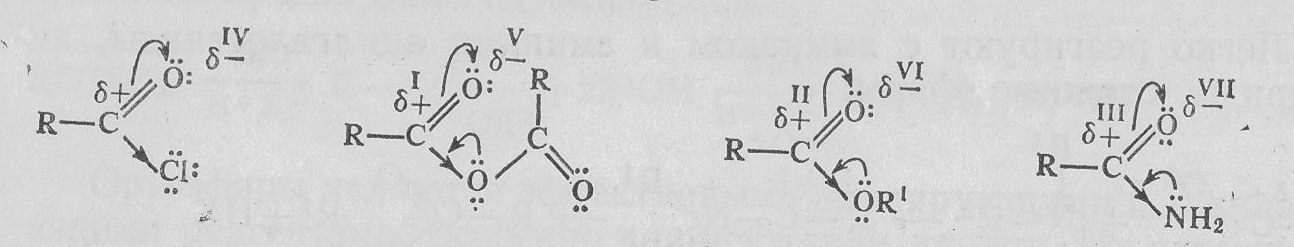
Кроме того, для амидов характерен ряд реакций с участием связей N—Н:
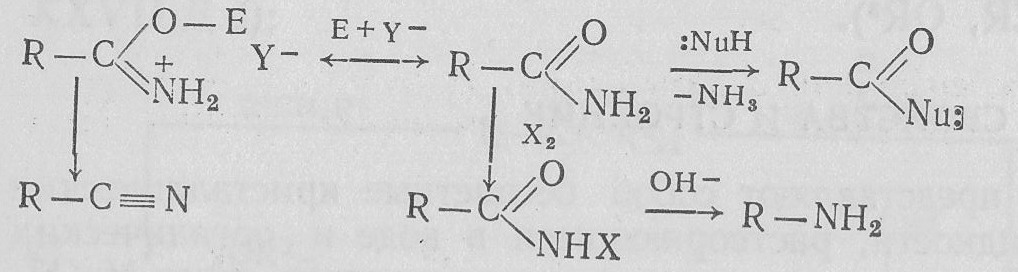
(здесь Х=Сl, Вr).
1. Основность. По сравнению с аминами амиды карбоновых кислот являются слабыми основаниями ввиду сильного взаимодействия неподеленной электронной пары атома азота с карбонильной группой. Присоединение протона обычно происходит по атому кислорода:
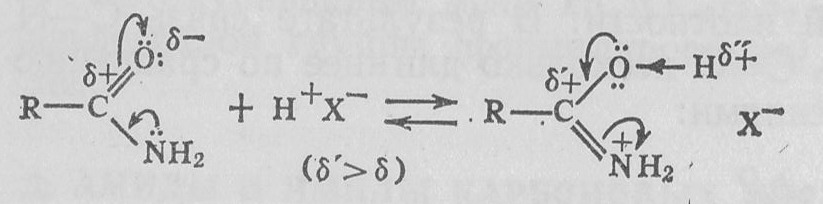
Протонированная форма амидов имеет структуру имидовых кислот и является сильной ОН-кислотой. Например, рKвн+ ацетамида равен 0,1, бензамида —2, капролактама 0,4.
Имиды являются очень слабыми основаниями, в этом они сравнимы со спиртами и эфирами.
В протонированной форме амидов положительный заряд на углеродном атоме значительно больше, чем в амидной форме. Это способствует реакциям со слабыми нуклеофильными реагентами.
2. NH-Кислотность. Если в молекуле амида имеется связь N—Н, возможна ионизация. Амиды являются слабыми NH-кислотами. Повышенная кислотность амидов по сравнению с аминами объясняется сильным влиянием карбонильной группы (эффект сопряжения, делокализация отрицательного заряда в анионе):

Кислотность ацетамида (рKа=15) сравнима с кислотностью метанола, кислотность бензамида рKа= 13,5.
Имиды являются более сильными NH-кислотами, так как атом азота находится под влиянием двух карбонильных групп:

3. Реакции нуклеофильного замещения. В реакциях с нуклеофильными реагентами может произойти замещение группы NH2 (NR2):
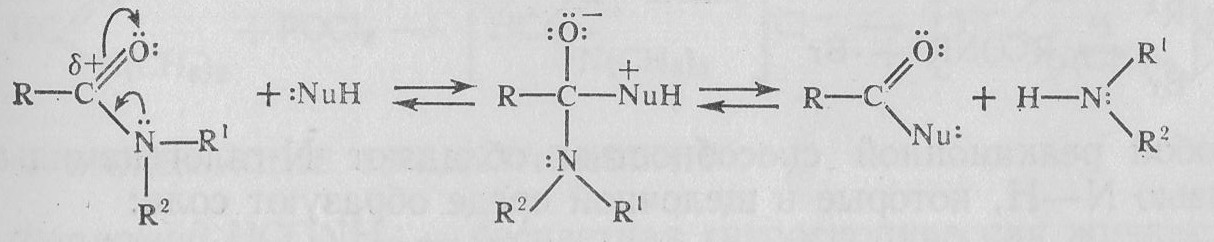
Реакционная способность амидов меньше, чем сложных эфиров. Наиболее известны реакции с водой (гидролиз) и спиртами (алкоголиз).
Гидролиз амидов легко происходит в присутствии щелочи или кислоты и очень медленно — в нейтральной среде.
В присутствии щелочи амиды превращаются в соль карбоновой кислоты и аммиак (амины):
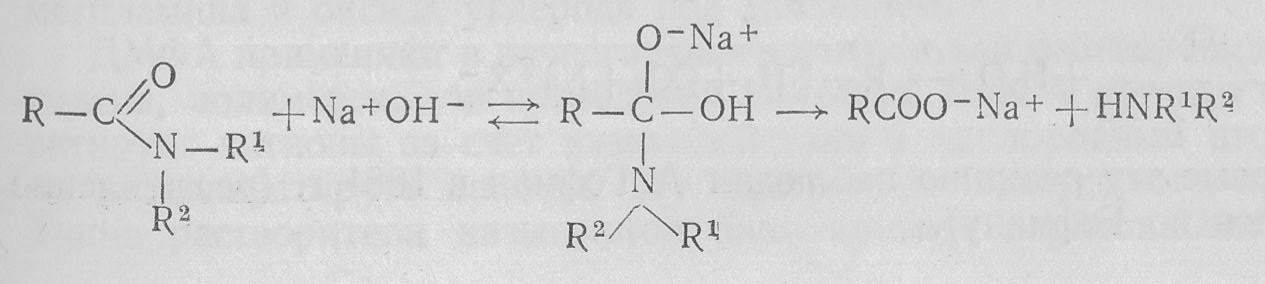
Если R1 или R2 являются водородными атомами, промежуточно образуется также анион амида.
Присутствие кислоты активирует молекулу амида (протонирование), поэтому происходит реакция со слабыми О-нуклеофилами — водой и спиртами:
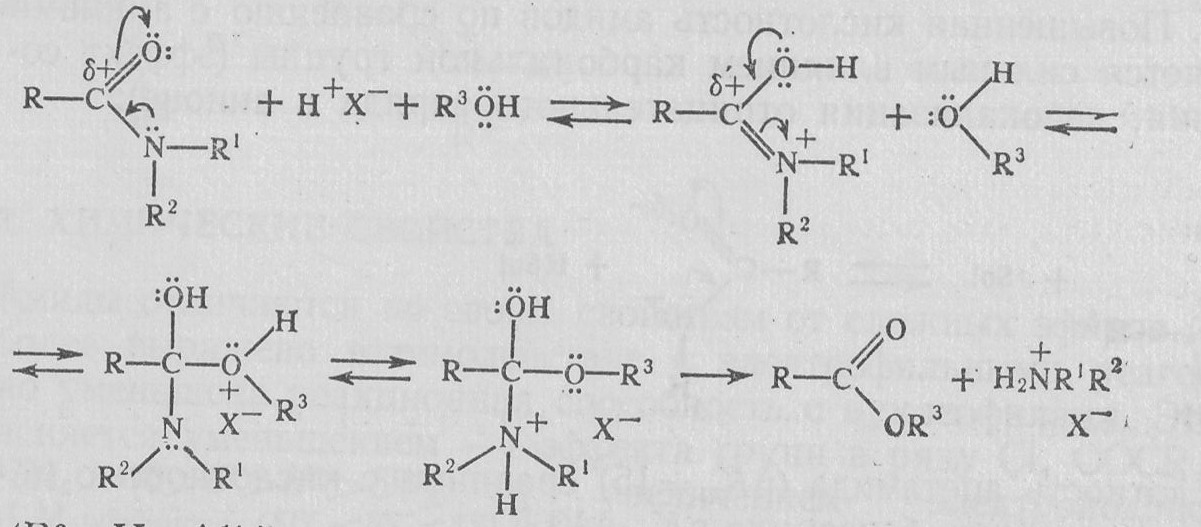
(R3=H, Alk).
Имиды в реакциях с нуклеофилами более активны, так как влияние атома азота на одну карбонильную группу меньше.
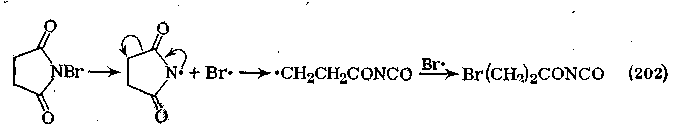
4. Образование и превращения N-галогенамидов. N-Незамещенные или N-монозамещенные амиды легко галогенируются у атома азота. Обычно действуют галогенами в присутствии оснований:
![]()
N-Галогенамиды являются весьма нестабильными соединениями и обладают свойствами окислителя. Их применяют в качестве галогенирующих реагентов. Разрыв связи N—галоген может осуществиться гомолитически:
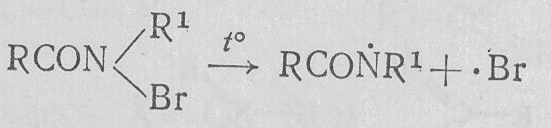
Особой реакционной способностью обладают N-галогенамиды связью N—Н, которые в щелочной среде образуют соли:
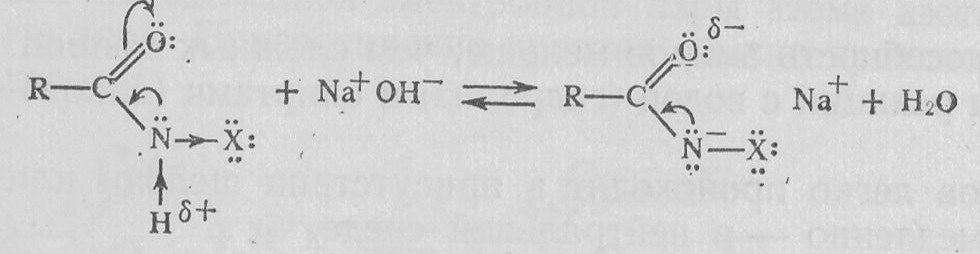
Соли N-галогенамидов при нагревании превращаются в первичные амины:
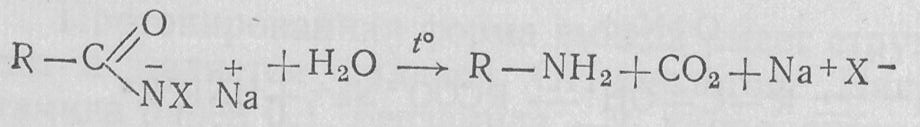
Впервые эту реакцию наблюдал А. Гофман в 1881 г. (расщепление амидов по Гофману).
Промежуточными продуктами в реакции Гофмана являются изоцианаты, которые образуются в результате перегруппировки своеобразных частиц — ацилнитренов. Ацилнитрены — аналоги кето-карбенов — образуются из N-галогенамидов:
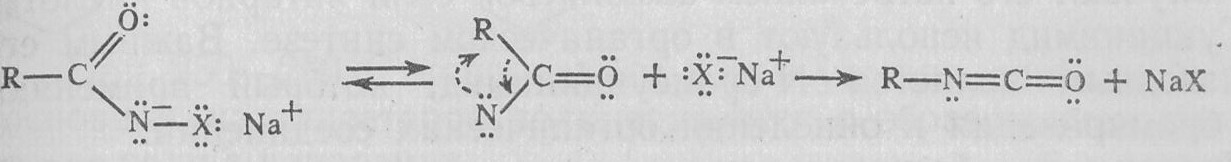
Изоцианаты очень легко реагируют с водой и образуют карбами новые кислоты, которые декарбоксилируются:
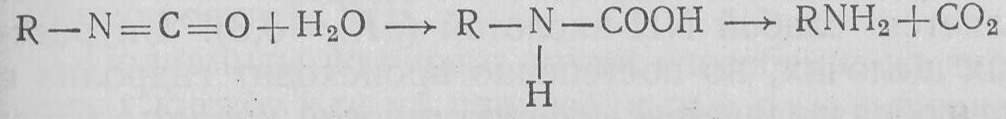
5. Взаимодействие с электрофильными реагентами, дегидратация. Электрофильные реагенты атакуют кислородный атом. Сильные алкилирующие реагенты дают производные имидоэфиров (гл. XXXIII. Ж.1). Сильные кислоты Льюиса вызывают дальнейшие превращения. N-Незамещенные амиды превращаются в нитрилы (гл. XXXIII. К.1):
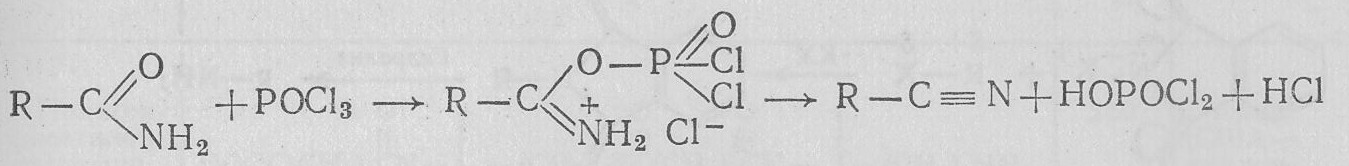
N,N-Дизамещенные амиды с РОС13 дают производные хлорангидрида имидокислот — активные ацилирующие реагенты. Например, N,N-диметилформамид с РОС13 дает соль N.N-диметил-хлорформимидиния — активный формилирующий реагент:
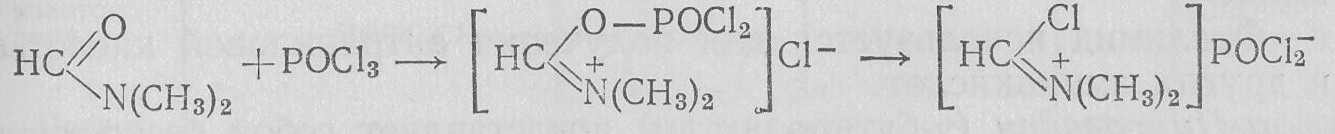
ИМИДЫ
Присутствие двух карбонильных групп в молекуле имидов увеличивает кислотность атома водорода аминогруппы, снижает нуклеофильность как атома кислорода, так и азота, а также увеличивает дефицит электронов на карбонильном атоме углерода. Если принять во внимание указанные различия, то реакции имидов можно рассматривать как достаточно близкие к реакциям амидов. Так, например, с большим трудом, чем в случае имидов протекают хорошо известные реакции нуклеофильного присоединения к карбонильному атому углерода (гидролиз или реакция с реактивами Гриньяра), а также реакции с электрофильными реагентами (алкилгалогенидами, ацилирующими и галогенирующи-ми агентами и карбонильными соединениями). Вместе с тем имеется несколько примеров реакций с нитрозирующими и нитрующими агентами, а также с галогенангидридами неограниче-с.ких кислот. Имиды достаточно устойчивы к окислению, но легко восстанавливаются и подвергаются фотолизу.
Гидролиз имидов легко проходит как в кислой, так и в основной среде, при этом основной катализ имеет место при низких рН (=3), некатализируемый процесс реализуется при рН 2— 3, а кислотный катализ протекает при рН менее 1,5. В результате гидролиза происходит разрыв N-ацильной связи и имид деацилируется до амида. В случае циклических имидов продуктами являются амидовые кислоты, которые в зависимости от условий могут подвергаться дальнейшему гидролизу до дикарбоновых кислот и амина или аммиака.
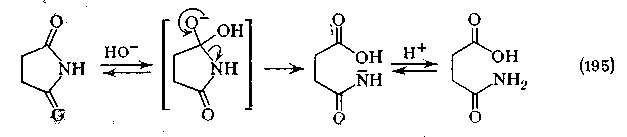
Механизм катализируемого основаниями гидролиза сукцинимидов относительно прост и включает первоначальную атаку _ОН на карбонильный углерод и последующее образование тетраэдрического интермедиата, который затем распадается с разрывом связи С (О)—N.
Наблюдаемое влияние размера цикла (в случае циклических имидов) и природы заместителей у атома N' можно было ожидать, например происходит возрастание скорости реакции при переходе от пятичленных (планарных) к шестичленным циклам вследствие меньшей стерической затрудненности карбонильного атома углерода, а также при замене N-алкильных групп на N-фенильные. Фталимид проявляет необычные свойства, вероятно, из-за сильной ионизации очень кислой группы N—Н. Скорость реакций зависит от рН, но наличие электронооттягивающего заместителя в положении 4 облегчает гидролиз при рН 7—10; при более высоких рН скорость реакции не зависит от рН и не зависит от природы заместителя. Напротив, скорость гидролиза N-арилфталимидов зависит от рН даже при высоких значения рН. Катализируемый кислотой гидролиз имидов затруднен и обычно требует продолжительного нагревания при 80—100°С. Поэтому промежуточно образующийся амид не выделяют, но гидролизуют дальше до карбоновой кислоты и аммиака или амина. Поскольку скорость реакции растет с увеличением кислотности, ее механизм включает, вероятно, атаку воды на протонированный субстрат. Образуются ли в данном случае О- или N-сопряженные кислоты, точно не установлено.
Наблюдалось возрастание скорости гидролиза фталимидов за счет влияния соседних карбоксильных групп, а также за счет нуклеофильного катализа соседних имидазольных и аминогрупп.
Как и в случае амидов, хорошо известна атака на карбонильный атом углерода имидов таких нуклеофильных реагентов как спирты (сольволиз), амины, гидроксиламин и гидразин, которая приводит в первых двух случаях к раскрытию цикла с образованием амидовых эфиров и диамидов соответственно. В случае гидразина и гидроксиламина происходит последующее замыкание цикла, которое сопровождается включением в имидный цикл более нуклеофильного NH2- и НО-замещенного атома азота с образованием 1,1-диацилгидразинов и N-ацилгидроксамовых кислот соответственнно.
Имиды, как и амиды, взаимодействуют с карбанионами (полученными из реактивов Гриньяра) по карбонильному атому углерода. Первой стадией реакции является образование замещенного -гидроксилактама, затем в зависимости от природы реактива Гриньяра может протекать дегидратация или раскрытие цикла:
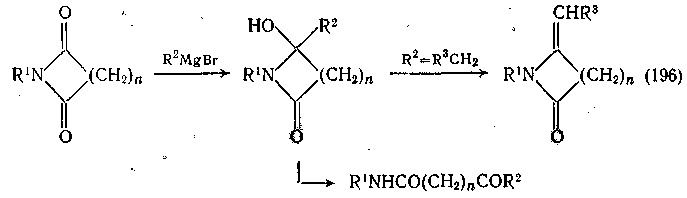
Конкретные примеры таких реакций рассмотрены в упомянутых выше обзорах. В связи с повышенным по сравнению с амидами дефицитом электронов на карбонильном углероде имиды могут присоединять некоторые менее активные карбанионы, такие как анионы из цинка и -галогенэфиров или фосфоранов (реакции Реформатского и Виттига, давая алкилиденовые производные; а также взаимодействовать с ацетиленидом натрия, давая гидроксилактамы.
Алкилирование имидов алкилгалогенидами обычно протекает в основных условиях (т. е. с калиевой или серебряной солью имида) при 150—180 °С и приводит к N-алкилпроизводным.
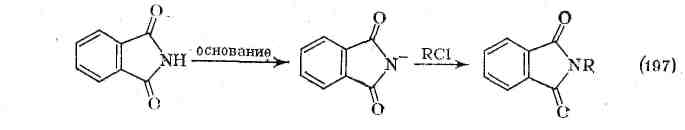
Эта реакция составляет основу синтеза аминов по Габриэлю, в котором получение амина состоит в мягком гидролизе имида после алкилирования алкилгалогенидом. Алкилирование в нейтральных условиях более активными солями оксо-ния или алкилсульфатами изучено недостаточно. Однако имеются данные о внутримолекулярном О-алкилировании имида соседней галогеналкильной группой, что приводит к возникновению N-ацилгетероциклической соли в качестве интермедиата с последующим раскрытием цикла и образованием амидового эфира.
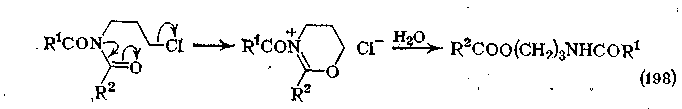
Эта реакция аналогична получению лактамов из ω-галогеналкиламидов. Как и в случае амидов, при взаимодействии 2 моль амида натрия с соответствующим имидом (например, глутаримидом), происходит образование карбаниона (в -положенни по отношению к карбонилу) и аниона азота, однако обычно преимущественно алкилируется карбанион, а не азот.
Реакции имидов с альдегидами и кетонами очень близки аналогичным реакциям вторичных амидов. Так, формальдегид, ацетон и изобутиральдегид реагируют в нейтральных или основных условиях, давая соответствующие N--гидроксиалкильные производные, которые в случае высших гомологов могут далее дегидратироваться.
Ацилирование незамещенных имидов хлорангидридами или ангидридами кислот приводит к триациламинам (RCO)3N. Имеются косвенные доказательства того, что в слабоосновных условиях (например, в пиридине) реакция протекает через промежуточное образование О-ацильных производных. При взаимодействии с более активными ацилирующими агентами, например с кетенами и с изопренильными эфирами, образуются N-замещенные продукты, аналогичные получаемым из амидов. В случае N-алкилдиацетамидов дальнейшее замещение по азоту невозможно, однако с помощью 14С-меченого уксусного ангидрида в пиридине продемонстрирован факт транс-ацилирования.
N-Галогенимиды, получаемые из соответствующего имида действием молекулярного галогена или гипогалогенит-иона, являются хорошо известными источниками атомарного или положительно заряженного галогена. Широкое применение в синтезе нашел главным образом N-бромсукцинимид. Гетеролитиче-ское бромирование под действием N-бромсукцинимида (т. е. через НОВr или Вr_) может происходить: в водной среде, когда присоединение к олефинам идет согласно правилу Марковникова; в концентрированной H2SO4 где замещение в ароматическом кольце протекает согласно орто/пара-ориентации, а также в смеси пиридина и трет-бутанола, где вторичные спирты подвергаются -замещению. Гомолитическое галогенирование под действием N-бромсукцинимида (т. е. через Hal-) протекает либо при облучении УФ-светом, либо в присутствии инициаторов радикальных реакций, например пероксидов. Типичными реакциями такого типа являются замещение аллильного или бензильного атома водорода (реакция Воля — Циглера), замещение в ароматическом ядре или даже замещение водорода у насыщенного атома углерода. Эти реакции являются цепными радикальными процессами; их детали зависят от природы N-галогенимида.
Другими интересными, но менее важными реакциями N-гало-генимидов являются введение СНг-группы между азотом и галогеном по связи Н—Hal, а также катализируемая основаниями перегруппировка N-галогенфталимида, приводящая к изоцианатам (аналогичная реакция Гофмана для амидов).
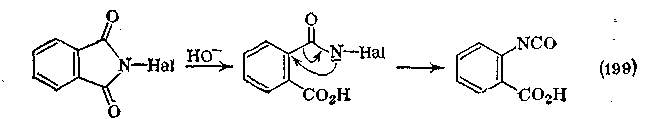
Данные по нитрованию и нитрозированию имидов отсутствуют, а количество примеров реакций с галоганангидридами неорганических кислот незначительно. Взаимодействие РС15 с глутаримидом приводит к ди-, три- и тетрахлорированным пиридинам, образование которых объясняется процессом, уже рассмотренным в случае амидов. РОС13 реагирует аналогичным образом.
Имиды очень устойчивы к окислению, и на них не действуют такие реагенты, как оксид азота, оксид хрома и перманганат калия. Это свойство имидов дало возможность применить удобный метод защиты амидных групп (путем превращения в имид) в процессе окисления других фрагментов молекулы. Имиды гладко восстанавливаются с помощью таких стандартных методов, как взаимодействие с комплексными гидридами металлов, каталитическое гидрирование и электрохимическое восстановление. Из циклических имидов обычно образуются -гидроксилактамы, лактамы и амины.
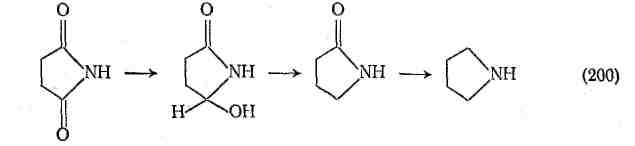
Электрохимическое восстановление на свинцовом или на амальгамированном цинковом катоде, а также восстановление LiAlH4 обычно приводит к получению лактамов. При действии LiAlHi наличие заместителей в кольце может способствовать образованию -гидроксилактамов. Каталитическое гидрирование обычно приводит к амидам. Хотя как имиды, так и амиды, поглощают в УФ-области приблизительно при той же длине волны, фотохимия имидов до последнего времени не вызывала интереса. Известные сейчас фотоперегруппировка Фриса ароматических имидов и перенос атома хлора в N-хлоримидах в -положение ацильной боковой цепи напоминают процессы, описанные в случае амидов.

цикла N-алкиламидов
и раскрытие имидного кольца с образованием ацилизоцианата.