
- •1 Общая характеристика: – классификация, номенклатура, изомерия.
- •2. Физические свойства карбоновых кислот
- •3. Способы получения
- •4. Химические свойства
- •5 Отдельные представители. Методы идентификации.
- •Карбоновые кислоты
- •Одноосновные карбоновые кислоты
- •1.1 Гомологический ряд и номенклатура
- •1.2 Физические свойства карбоновых кислот
- •Химические свойства
- •2. Двухосновные карбоновые кислоты
- •3. Непредельные карбоновые кислоты
2. Двухосновные карбоновые кислоты
О![]() бщая
формула гомологического ряда предельных
двухосновных кислот
бщая
формула гомологического ряда предельных
двухосновных кислот
Примерами могут служить:
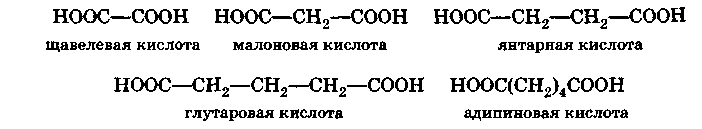
Предельные двухосновные кислоты — твердые кристаллические вещества. Подобно тому, как это отмечалось для одноосновных кислот, предельные двухосновные кислоты с четным числом атомов углерода плавятся при более высокой температуре, чем соседние гомологи с нечетным числом атомов углерода. Растворимость в воде кислот с нечетным числом атомов углерода значительно выше растворимости кислот с четным числом атомов углерода, причем с возрастанием длины цепи растворимость кислот в воде уменьшается.
Двухосновные кислоты диссоциируют последовательно:
![]()
Они сильнее соответствующих одноосновных кислот. Степень диссоциации двухосновных кислот понижается с увеличением их молекулярной массы.
В молекуле двухосновных кислот содержатся две карбоксильные группы, поэтому они дают два ряда производных, например средние и кислые соли, средние и кислые сложные эфиры:
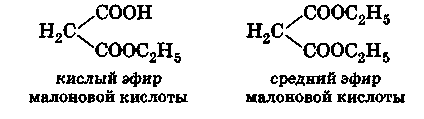
При нагревании щавелевой и малоновой кислот легко отщепляется СО2:
![]()
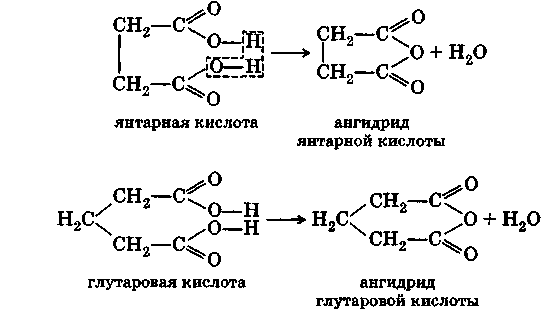
Двухосновные кислоты с четырьмя и пятью атомами углерода в молекуле, т. е. янтарная и глутаровая кислоты, при нагревании отщепляют элементы воды и дают внутренние циклические ангидриды:
3. Непредельные карбоновые кислоты
Состав непредельных одноосновных кислот с одной двойной связью можно выразить общей формулой СnН2n-1СООН. Как и для любых бифункциональных соединений, для них характерны реакции как кислот, так и олефинов. α.β-Непредельные кислоты несколько превосходят по силе соответствующие жирные кислоты, так как двойная связь, находящаяся рядом с карбоксильной группой, усиливает ее кислотные свойства.
Акриловая кислота. Простейшая непредельная одноосновная кислота
![]()
Олеиновая, линолевая и линоленовая кислоты.
Олеиновая кислота С17Н33СООН в виде глицеринового эфира чрезвычайно распространена в природе. Ее строение выражается формулой
![]()
Олеиновая кислота — бесцветная маслянистая жидкость, легче воды, на холоду затвердевает в игольчатые кристаллы, плавящиеся при 14 °С. На воздухе она быстро окисляется и желтеет.
М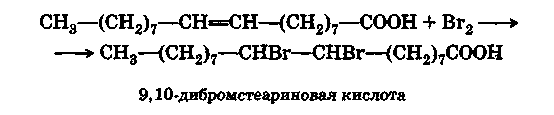 олекула
олеиновой кислоты способна присоединять
два атома галогена:
олекула
олеиновой кислоты способна присоединять
два атома галогена:
В присутствии катализаторов, например Ni, олеиновая кислота присоединяет два атома водорода, переходя в стеариновую кислоту.
Олеиновая кислота представляет собой цис-изомер (все природные непредельные высокомолекулярные кислоты, как правило, относятся к цис-ряду).
Линолевая С17Н31СООН и линоленовая С17Н29СООН кислоты еще более ненасыщены, чем олеиновая кислота. В виде сложных эфиров с глицерином — глицеридов — они являются главной составной частью льняного и конопляного масел:
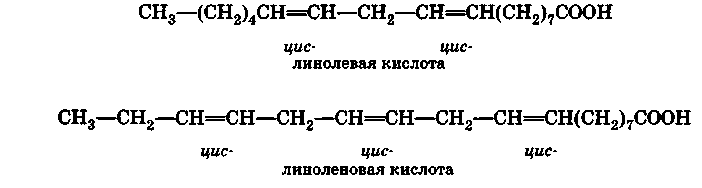
В молекуле линолевой кислоты две двойные связи. Она может присоединять четыре атома водорода или галогена. В молекуле линолевой кислоты три двойные связи, поэтому она присоединяет шесть атомов водорода или галогена. Обе кислоты, присоединяя водород, переходят в стеариновую кислоту.
Сорбиновая кислота
![]()
Она имеет две сопряженные друг с другом и с карбоксильной группой двойные связи, имеющие транс-конфигурацию; является прекрасным консервантом для многих пищевых продуктов: овощных консервов, сыра, маргарина, фруктов, рыбных и мясных продуктов.
Малеиновая и фумаровая кислоты. Простейшими из двухосновных кислот, содержащих этиленовую связь, являются два структурных изомера:

Кроме того, для второй из этих кислот возможны две пространственные конфигурации:
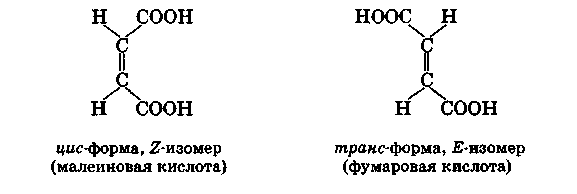
Фумаровая кислота содержится во многих растениях: особенно часто она встречается в грибах. Малеиновая кислота в природе не найдена.
Обе кислоты обычно получают при нагревании яблочной (оксиянтарной) кислоты:
![]()
При медленном, осторожном нагревании получается главным образом фумаровая кислота; при более сильном нагревании и при перегонке яблочной кислоты получается малеиновая кислота.
Как фумаровая, так и малеиновая кислота при восстановлении дают одну и ту же янтарную кислоту:
![]()
