
- •(83) Влияние природы растворителя на скорость химических реакций.
- •(84) Стадия обрыва цепи радикально-цепных реакций. Виды обрыва цепи. Понятие ингибитора. Передача цепи на растворитель и полимер.
- •29 (85) Понятие простой и сложной реакции.
- •(86) Металлокомплексный анализ
- •30 (88)Солевой эффект
- •(89) Основы ферментативного катализа.
- •(90) Гетерофазные процессы. Движущая сила массообменных процессов.
- •31 (91) Классификация хим. Р-ций по числу частиц вступающих во взаимодействия
- •(92) Иммобилизованный гомогенный катализ
- •(93) Идеальный периодический реактор и изучение кинетики в периодических исследованиях.
- •32(94) Гипотеза о мех-ме не элементарных р-ций.
- •(95) Гетерофазные р-ции. Катализ межфазного переноса. Понятие элементарной стадии р-ции.
28 (82) Основные хар-ки гетерогенного каt : пористость и удельная поверхность.
Удельная пов-ть каt (Sуд) определяется по объёму газа адсорбируемого на его пов-ти с обр-ем мономолекулярного слоя. Она изменяется в широких пределах от 1-2 до 800-1000 м2 на грамм. Первые (т.е. 1-2) явл-ся мало и широко пористыми.
Вторые (т.е. 800-1000) высокопористые тела (к ним пренадлежат активированные угли и цеолиты).
Пористость
каt
– это доля пор в его зерне: где Vn
- удельный объём пор, кот-ый определяется
по вытесненному объёму гелея, заполняющего
все поры;
где Vn
- удельный объём пор, кот-ый определяется
по вытесненному объёму гелея, заполняющего
все поры;
Vk – удльный объём зёрен, его опр-ют по вытесненному объёму ртути не заполняющей поры.
Из удельного объёма поры и уд. пов-ти в предложен.цилиндрич. формы пор вычесляют их средний радиус rn = 2Vn/ Sуд
(83) Влияние природы растворителя на скорость химических реакций.
Взаимодействие активированого комплекса со средой называеться сольватацией. Она может быть неспецифической,т . е обусловленной электростатическим взаимодействием реагентов и активированного комплекса с растворителем, и специфической,которая зависит от возникновения химических связей реагентов и активированного комплекса со средой. Это влияет на изменения константы скорости реакции. Существует методы количественного описания влияние среды на скорость химической реакции. При электрической сольватации принимают, что растворитель являеться непрерывной однородной средой. Исходя этого и из теорич. абсолютн. Скоростей реакции для взаимодействия между двумя ионами или ионами и диполями было обосновано уравнением Скетгарда. Оно дает линейную связь Ln К конст. Скорости с обратным значениям диэлектрической проницаемости среды.
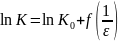
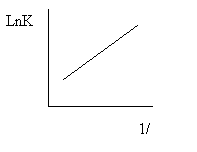
При взаимодействии двух диполей удовлетворительный результат дает уравнение Кирквува.

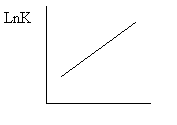
(84) Стадия обрыва цепи радикально-цепных реакций. Виды обрыва цепи. Понятие ингибитора. Передача цепи на растворитель и полимер.
Следующая стадия радик.цепн. мех-ма продолжении и обрыв цепи. Образ-ся при зарождении цепи своб. Атома или радикала обладал высок реакц. способ. Начинает цепь превращений,которая приводит к обр-ию продуктов р-ции. Эта цепь складываеться из элементарных стадий радик-го замещения,рассчепления или присоединения,которое специфичны для кажд. конкретн. реакции. Согласно общей схеме:
Y∙
+
A

Во второй ре-ции образвание тот же свободный радикал У с которого началось привращение. Благодаря этому послед-сть элементарных реакций может повториться вновь. Пока свободный радикал не исчезнет по той или иной причине. Т.обр и осущ=ся цепной процесс,в которой 1 радикал,обр-ся на стадии зарождения цепи приводит к образованию многих молекул продукта В.Совокупность элементарных стадий в результ. Которой обр-ся радикал начинавший цепь называеться звеном. Число повторяющих звеньев,состоя-щих цепь называеться ее длинной. В разных р-иях длинны цепи меняеться от нескольких единиц или десятков,до многих тысяч. Обрыв цепи ведет к исчезновению свободных радикалов или превращению его в более стабильный радикал,не способный к продолжению цепи. По отношению к радикалам реакция обрыва могут быть много или би молекулярны. В соотвествии с этим различают квадритичный и линейный обрыв цепи. При квадратичном обрыве цепи в результате би молекулярного взаимодействия двух радикалов их свободные электроны взаимноспариваються и образуют молекулярные продукты
Реакцию,при которой связываються два разных радикала называют перекрестным обрывом. Иногда квадратичный обрыв происходит также путем диспропорционирования углеводородных радикалов. С образованием молекул олифина и парафина.
Процесс рекомбинации радикалов сильно экзотермичен и протекает с нулевой энергией активации. В результате образуються молекулы с большой избыточной энергией. Скорость реакции обрыва описываеться кинетическими уравнениями.
Квадратичный обрыв цепи характерен для жидкофазных и температурных процессов кагда концентрация радикалов и вероятность их столкновения достаточно велика. Линейный обрыв цепи,мономолекулярен в отношении активных радикалов ведущей цепь осуществляеться различными путями. Один из них часто встречаеться при газофазных реакций,состоит в обрыве цепи на стенке сосуда или другой твердой поверхности.
Большей частью линейный обрыв происодит где то на ингибиторах ,т.е вещества,способных выводить активные радикалы из ценного процесса. Одны ингибиторы к которым относиться соли Ме переменой валентности Cu+,Fe2+,Mn2+,превращают радикалы в ионы за счет окис-востановительной реакции
Другие ингибиторы,наиболее распространенные дают в начале не реакционные способности радикалы и далее молекул продуктов. К ним относиться многие амины,фенолы,ораганические соединения серы и др. Химиз многих реакций этих соединений срадикалами не достаточно выяснен. Ингибирование хенона представляет следующим образом.
Некоторые ингибиторы сами содержат не спариные електроны легко обр-уя с радиками мол. Продукты.
К ним можно отнести О2 бирадикальны природа которых обеспечивает быструю с радик. Сообразование менее реакции способных пероксидных радикалов.
Во многих случаях этот радикал уже не способен продолжению цепи. Ингибир. Электроны действие оказыв.соединения других классов(изопарафины, ароматических соединений) которые дают более стабильные радикалы,чем участвующие в данной цепи реакции,поэтому первостепенно важно степень частоты исх. В-в для проведения радикально цепных реакций. Поскольку наличие ингибиованых примесей веден к преждевременному замедлению процесса. Скорость обрыва цепи в присуствии ингибит.
При рекомбинации радик.нетребуеться какой либо Еа. Процесс протекает при каждом их столкновении. Тоже оноситься к реакциям с ингибит,которые имеют неспар.электроны. С другими ингибиторными Еа обрыва цепи обычно очень мала. Поэтому обрыв цепи происходит на тех радикалах,концетрация и частота,столкновения которых с друг другом или с ингбиторами >. Таком услов.удовлет менее реакцинной способные радикалы,которые учавсивуют в lim станд. Цепи. Обрыв цепи будет происходить именно на них.
