- •(74) Электрофильный катализ.
- •26 (76) Влияние природы растворителя на скорость хим.Р-ий.Уравнение Кирквуда.
- •(77) Радикально-цепные реакции.Стадия продолжения цепи.Понятие звена, длины цепи.
- •(78) Массоперенос и массопередача.Переходная область с учетом реакций в пограничной пленке.
- •(80). Механизм катализа межфазного переноса.Катамины.
- •(81). Гетерогенно-каталитические р-ии.Переходная область при мгновенной хим. Р-ии.
25 (73) Классификация хим.реакций по фазовому состоянию реагирующих веществ и по скорости протекания
1. По фазовому состоянию
Гомофазные протекают в одной фазе и делятся на газофазные,жидкофазные,твердофазные.
Гетерофазные-протекают на границе раздела двух фаз: Г/Ж,Ж/Ж,Т/Т.Гетерофазными являются р-ии превращения тв. тел,сопровождающиеся образованием новой фазы.Но невсегда в гетерофазной системе р-ии протекают гетерофазно.Например,в системе Г/Ж газообр.реагент реагирует в р-ре,хотя исходная система гетерофазна.Х-р р-ии в гетерофазной системе часто зависит от соотношения скоростей диффузии реагентов и их химич. взаимодействия.В зависимости от реагентов,вступающих в р-ию,простые р-ии делят на : молекулярные(уч-т только молекулы),радикальные(один из реагентов атом,своб. радикал или ион-радикал),ионные(один или более ионов уч-т в р-ии),р-ии возбужденных молекул(в фотохимических процессах),р-ии с участием комплексных соединений.
2. По скорости протекания делят на быстрые и медленные.Скорость быстрых(диффузионно-контролируемых)р-ий зависит от скорости втреч частиц реагентов.К таким р-ям относятся простые р-ии,протекающие при невысокой температуре,без энергии активации.Медленные р-ии лимитируются хим.взаимодействием частиц,которые протекают значительно медленнее скорости диффузии реагентов.
С позиции кинетических методов,используемых для изучения р-ий,р-ии условно делят на : медленные(скорость измеряется обычными методами),быстрые(скорость измеряется одним из методов изучения быстрых р-ий).Характерное время первых больше 100 с.,вторых-меньше 10 с.
(74) Электрофильный катализ.
Осуществляется кислотами Льюиса.Кислоты Льюиса-нейтральные соединения и ионы,способные использовать свободную пару электронов основания (орг.реагента) для образования стабильной электронной группировки одного из своих атомов.Кним относятся апротонные кислоты : соли некоторых металлов(ZnCl2 ,AlCl 3,FeCl3),ионы металлов(Li +,Ag+ ,Hg2+ ),а также такие молекулерные ионы,как SO3 , P2O5 ,и др.Электрофильными катализаторами орг.р-ий являются ионы,соли и некоторые другие соединения,перечисл. выше металлы.Взаимодействие кислоты Льюиса с основанием илис с органическим реагентом,имеющим свободные или лабильные пары электронов,состоит в образовании донорно-акцепторной связи за счет пары электронов основания,занимающей вакантную орбиталь одного из атомов кислоты Льюиса(Cl2 +FeCl3 =Cl-Cl:FeCl3 ).Роль электрофильных к-ров в активировании.Но электрофильные катализаторы оказываются значительно более эффективными,чем протонные кислоты при активировании слабоосновных реагентов,таких как галогены,алкил-галогениды,галоген-ангидриды.Образование донорно-акцепторного комплекса реагента с электрофильным катализатором сильно поляризована.Связь галогена с остальной частью молекулы приводит к ее полному разрыву с образованием соответствующего катиона в составе ионной пары:
E-AlCl3 ,TiCl4 ,SnCl 4,FeCl 3;Ag+ , Hg2+ , Mg2+ .
│ │ │
─C─X : +E↔─C─X : E↔─C+ XE−
│ │ │
X─X : + E↔X−X :E↔X+ XE−
Образующийся по равновесию катион или поляризованная молекула легко вступает далее в превращение,типичное для сильных электрофильных частиц и карб.катиона с последующей регенерацией катализатора: │ │
Cl2+ FeCl3↔Cl─Cl : FeCl3+>C=C<→Cl─C─C++FeCl4→ Cl─C─C─Cl+FeCl3
│ │
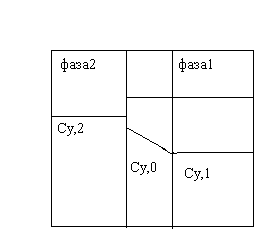
(75) Массопередача.Переходная область без учета реакций в пограничной пленке.
Особенностью гетерофазных процссов является необходимость переноса реагентов из одной фазы в другую за счет массопередачи.Известно что для идеальных систем межфазное равновесие описывается уравнением: Ci,2=γi∙Ci,1 и Pi,2=Hi∙Ci,1
γ-безразмерный коэффициент распределения.Простейшей моделью является двухпленочная модель.Согласно ей с обеих сторон границы раздела имеются пограничные пленки.Перенос вещества в пленках осуществляется молекулярной диффузией,а в обьеме конвективной диффузией.К обеим пленкам применим закон Фика: VD= ─D(dc/dt),где D- коэффициент молекулярной диффузии.Также применимо условие непрерывноости потока и получаем: VD = ─ (D/δ)∙∆C= ─ ß∙∆C,где ß-коэффициент массоотдачи.Также вводят понятие удельной поверхности раздела фаз.f и ß зависят от гидродинамического режима в аппарате и для ß есть уравнение ßT =ß0 ∙e (─ED/RT)
Рассмотрим область гетерофазных процессов,в которых определенную роль играет диффузионное торможение,но можно пренебречь взаимодействием в пограничной пленке из-за его малого обьема по сравнению с обьемом фазы, где протекает р-ия.Примем что р-ия идет в фазе 1 и диффузионное сопротивление сосредоточено в пограничной пленке этой фазы,при чем из-за быстрой конвективной диффузии концентрация реагента Y ,перешедшего в фазу 1- постоянна по всему ее обьему.В этом случае можно считать что юбщее сопротивление процесса равно сумме диффузионного и кинетического сопротивления.Доля каждого зависит от удельной поверхности фаз.Например при барботаже газа через жидкость скорость р-ии и удельная поверхность контакта фаз вначале линейно растут с повышением линейной скорости газа,а при большей ее величине скорость оказывается постоянной.В промежутке между ними наблюдают переходную область гетерофазных р-ий.Для нее характерно немного пониженное значение энергии активации из-за наложения диффузионного торможения.Это область образуется при определенном соотношении между толщиной пленки, константой скорости и коэффициентом молекулярной диффузии.