
- •Термодинамика процессов горения. Энтальпии образования химических веществ, тепловой эффект реакции. Адиабатическая температура горения.
- •Критические явления в горении. Тепловой взрыв. Режимы горения в реакторе идеального смешения.
- •Л аминарные пламена в предварительно перемешанных газовых системах. Механизм распространения пламени. Нормальная скорость распространения пламени. Пределы горения газовых смесей.
- •Горение газовых систем без предварительного смешения реагентов – диффузионное горение. Положение зоны горения и её температура.
- •Детонационное горение. Механизм распространения детонации. Структура детонационной волны.
- •Процессы фильтрационного горения. Фильтрационное горение газов. Фильтрационное горение конденсированных систем. Сверхадиабатические режимы горения.
- •Экологические аспекты процессов горения. Механизмы образования токсичных и экологически вредных продуктов горения.
- •Процессы горения в двигателях внутреннего сгорания.
- •Горение в псевдоожиженном (кипящем) слое
- •Горение жидких топлив, капель, аэрозолей – гетерогенное горение
КАФЕДРА ЭНЕРГОФИЗИКИ
ФИЗИЧЕСКИЙ ФАКУЛЬТЕТ БГУ
ОСНОВНЫЕ ВОПРОСЫ ПО СПЕЦКУРСУ
«ФИЗИКА ГОРЕНИЯ И ВЗРЫВА»
д.ф.-м.н.,
вед. научн. сотр. ИТМО НАН Беларуси Рабинович О.С.
Термодинамика процессов горения. Энтальпии образования химических веществ, тепловой эффект реакции. Адиабатическая температура горения.

![]()
Эквивалентное отношение (equivalence ratio)
f < 1 – бедная (топливом) смесь
f >1 – богатая смесь
![]()
Критерий химического равновесия
Д![]() ля
каждой пары постоянных термодинам.
переменных в случае равновесия должно
быть удовлетворено условие:
ля
каждой пары постоянных термодинам.
переменных в случае равновесия должно
быть удовлетворено условие:
В зависимости от выбора основных переменных, вид mi будет отличаться и, фактически, будут минимизироваться:
при S=const, p=const — Энтальпия H(S,p)
при V=const, T=const — Свободная энергия Гельмгольца F(V,T)
при p=const, T=const — Свободная энтальпия Гиббса G(p,T)
Стандартные энтальпия образования и энтропия (p0 = 105 Па)
![]()
![]()
![]()
![]()
Теплота образования, теплота реакции и теплота сгорания
![]()
![]()
энтальпия образования вещества при стандартных условиях
![]()
энтальпия образования при температуре Т
![]()
теплота реакции при температуре T
т![]() еплота
сгорания – теплота реакции окисления
1 моля топлива кислородом с образованием
конечных продуктов H2O,
CO2 и N2
еплота
сгорания – теплота реакции окисления
1 моля топлива кислородом с образованием
конечных продуктов H2O,
CO2 и N2
(p = p0, T = T0)
Адиабатическая температура горения – конечная равновесная температура, которая устанавливается после сгорания однородной смеси при постоянном давлении
Простая оценка Tad:
![]()
Критические явления в горении. Тепловой взрыв. Режимы горения в реакторе идеального смешения.
Теория теплового взрыва Н.Н. Семенова («нестационарная)
![]()
Кинетика процесса
Скорость тепловыделений Скорость теплоотвода
![]()
![]()
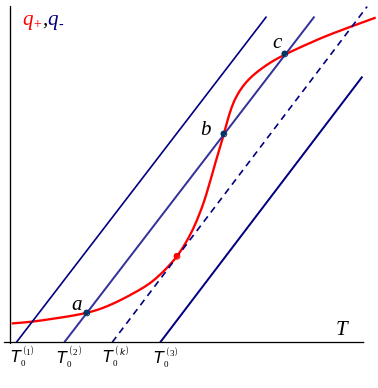
Идея стационарные решения (диаграмма Семенова)
Приближенный анализ - условие стационарности реакции
![]()
![]()
![]()
![]()
Безразмерные переменные ( Д.А. Франк-Каменецкий):
Характерные времена:
![]()
![]()
![]()
время тепловой релаксации время реакции при T0 время адиабат. разогрева на DT*
Б![]() езразмерные
переменные
езразмерные
переменные
( Д.А. Франк-Каменецкий)
![]()
Безразмерное уравнение теплового баланса:
![]()
![]()
Условие стационарного решения: где
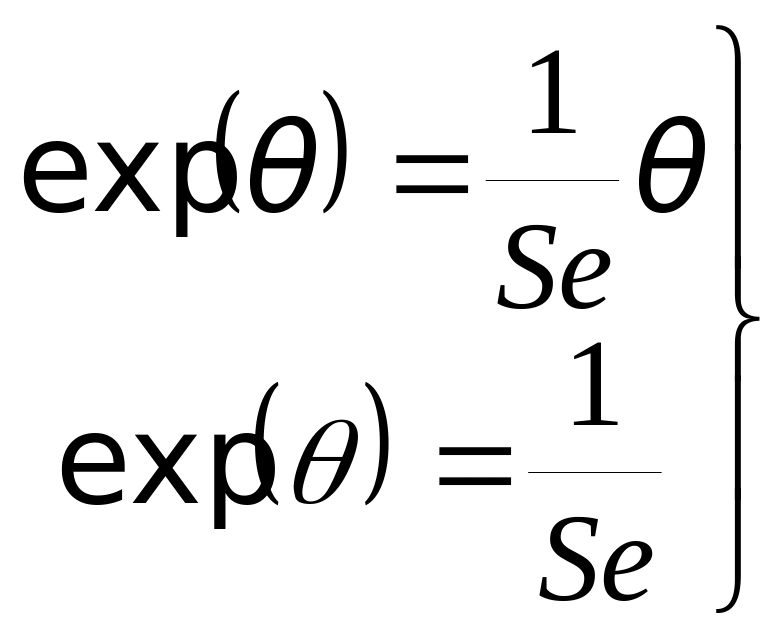
В приближении b®0 Общий критерий теплового взрыва:
![]()
Аналоги теплового взрыва: цепной взрыв, тепловой пробой диэлектриков, гидродинамический тепловой взрыв.

Р![]() ежимы
горения в реакторе идеального смешения
ежимы
горения в реакторе идеального смешения
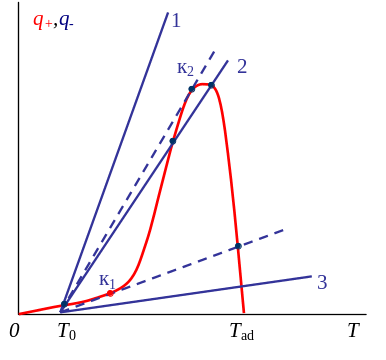
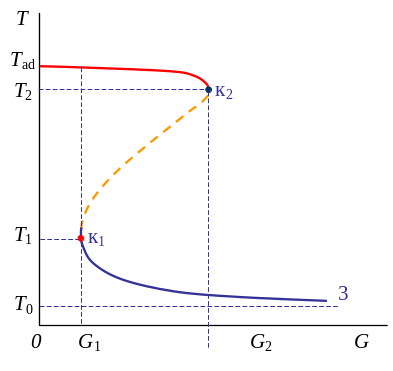 q+
q-
q+
q-
Л аминарные пламена в предварительно перемешанных газовых системах. Механизм распространения пламени. Нормальная скорость распространения пламени. Пределы горения газовых смесей.
Плоское ламинарное пламя как автоволна. Скорость стандартного пламени зависит только от свойств горючей смеси!
Дефлаграция – медленно распространяющееся пламя; uu~ 0.5 м/с; Dp << 1 бар
Механизм – теплопроводность и диффузия
Детонация – распространение пламени со сверхзвуковыми скоростями;
uu > 1000-2000 м/с; pb > 10 бар.
 Механизм–
воспламенение несгоревшей смеси в
результате её сжатия в ударной волне.
Механизм–
воспламенение несгоревшей смеси в
результате её сжатия в ударной волне.
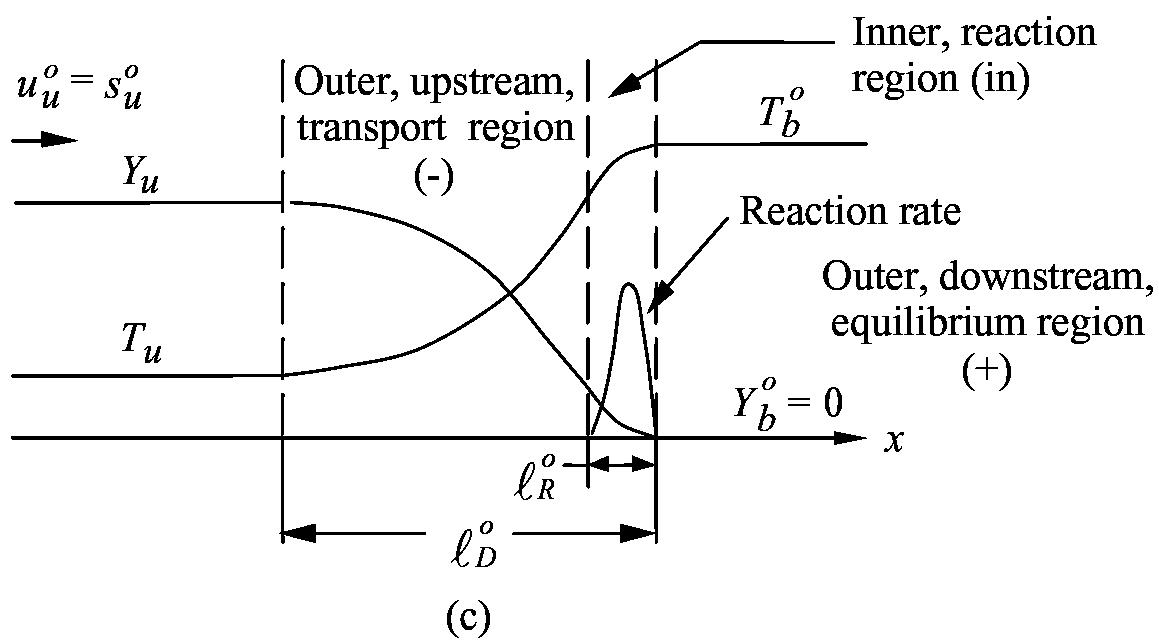
Структура ламинарного пламени:
Математическая формулировка задачи
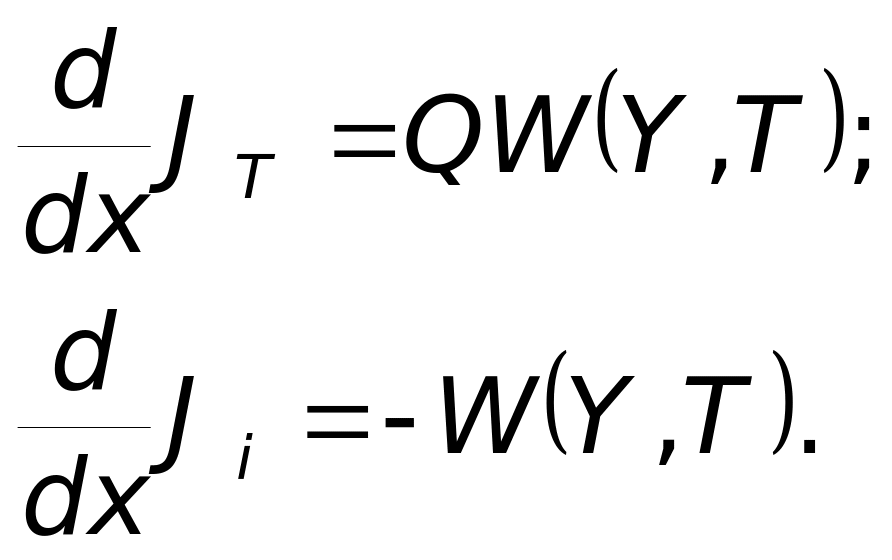
![]()
О![]() ценки
с помощью метода размерностей
ценки
с помощью метода размерностей
Идея метода узкой зоны реакции (З-Ф-К)
Основные предположения:
а) сp = const постоянна ; б) rD = constпостоянно; в) Le = D/a = const;
г) зона реакции узкая по сравнению с зоной прогрева (энергия активации большая);
д) в зоне прогрева тепловыделений нет;
е) в зоне реакции пренебрегаем конвективным переносом.
Выражение для скорости горения в приближении узкой зоны
(
 для
реакции 1-го порядка)
для
реакции 1-го порядка)
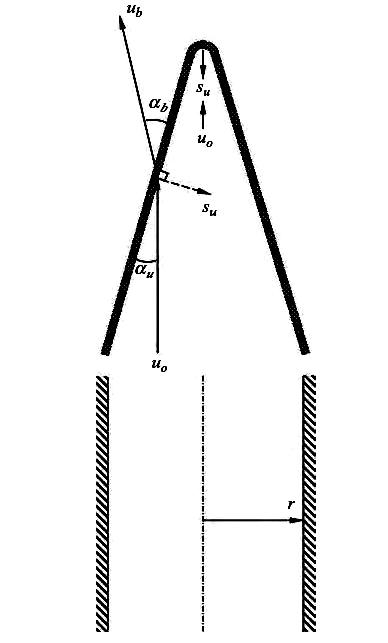
Определение нормальной скорости пламени – горелка Бунзена
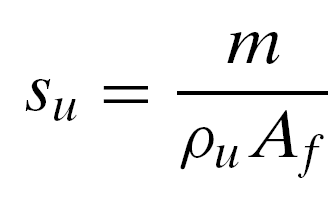
![]()
Предел распространения стационарной волны горения, связанный с теплопотерями
Идея метода расчета предела горения по Зельдовичу
Основной результат
![]()
![]()
