
- •Строение антител
- •Классы и подклассы иммуноглобулинов. Классификация по тяжелым цепям
- •Функции антител
- •Сывороточные ат:
- •13) Гены иммуноглобулинов
- •Рекомбинация генов, кодирующих легкие и тяжелые цепи иммуноглобулинов
- •15) По отношению к клеткам иммунной системы все органы делятся на 2 группы:
- •Переключение классов иммуноглобулинов.
- •Гены иммунного ответа
- •Строение молекул нla:
- •Биологическая роль системы hla.
11) Антитела (иммуноглобулины, ИГ, Ig) — это особый класс гликопротеинов, присутствующих на поверхности В-клеток в виде мембраносвязанных рецепторов и в сыворотке крови и тканевой жидкости в виде растворимых молекул. Они являются важнейшим фактором специфического гуморального иммунитета. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов — например, бактерий и вирусов. Антитела выполняют две функции: антиген-связывающую и эффекторную (вызывают тот или иной иммунный ответ, например, запускают классическую схему активации комплемента).
Антитела синтезируются плазматическими клетками, которыми становятся В-лимфоциты в ответ на присутствие антигенов. Для каждого антигена формируются соответствующие ему специализировавшиеся плазматические клетки, вырабатывающие специфичные для этого антигена антитела. Антитела распознают антигены, связываясь с определённым эпитопом — характерным фрагментом поверхности или линейной аминокислотной цепи антигена.
Антитела состоят из двух лёгких цепей и двух тяжелых цепей. У млекопитающих выделяют пять классов антител (иммуноглобулинов) — IgG, IgA, IgM, IgD, IgE, различающихся между собой по строению и аминокислотному составу тяжёлых цепей и по выполняемым эффекторным функциям.
Строение антител
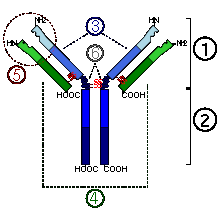
Общий план строения иммуноглобулинов: 1) Fab; 2) Fc; 3) тяжелая цепь; 4) легкая цепь; 5) антиген-связывающийся участок; 6) шарнирный участок
Антитела являются относительно крупными (~150 кДа — IgG) гликопротеинами, имеющими сложное строение. Состоят из двух идентичных тяжелых цепей (H-цепи, в свою очередь состоящие из VH, CH1, шарнира, CH2 и CH3 доменов) и из двух идентичных лёгких цепей (L-цепей, состоящих из VL и CL доменов). К тяжелым цепям ковалентно присоединены олигосахариды. При помощи протеазы папаина антитела можно расщепить на два Fab (англ. fragment antigen binding — антиген-связывающий фрагмент) и один Fc (англ. fragment crystallizable — фрагмент, способный к кристаллизации). В зависимости от класса и исполняемых функций антитела могут существовать как в мономерной форме (IgG, IgD, IgE, сывороточный IgA) так и в олигомерной форме (димер-секреторный IgA, пентамер — IgM). Всего различают пять типов тяжелых цепей (α-, γ-, δ-, ε-и μ- цепи) и два типа легких цепей (κ-цепь и λ-цепь).
Классы и подклассы иммуноглобулинов. Классификация по тяжелым цепям
Различают пять классов (изотипов) иммуноглобулинов, различающихся:
величиной
зарядом
последовательностью аминокислот
содержанием углеводов
Класс IgG классифицируют на четыре подкласса (IgG1, IgG2, IgG3, IgG4), класс IgA — на два подкласса (IgA1, IgA2). Все классы и подклассы составляют девять изотипов, которые присутствуют в норме у всех индивидов. Каждый изотип определяется последовательностью аминокислот константной области тяжелой цепи.
Аффинность (lat. affinitas: родственность) — термодинамическая характеристика, количественно описывающая силу взаимодействия антигена и антитела в растворе. Аффинность можно определить по закону действующих масс как отношение концентрации комплекса антиген — антитело к произведению концентраций компонентов. Высокой аффинностью в случае антител считают 10^12 М^−1, низкой аффинностью — 10^5 М^−1.
Авидность антител — характеристика общей стабильности комплекса антигена и антитела. Авидность определяется аффинностью антитела к антигену, количеством антигенсвязывающих центров в молекуле антитела и особенностями пространственной структуры антигена, создающими стерические препятствия для создания комплекса. Авидность антитела следует отличать от аффинности, так как аффинность является термодинамическим параметром, количественно описывающим силу единственного взаимодействия антигена и антитела, в то время как авидность описывает силу кооперативных взаимодействий аффинных взаимодействий.
Так, например, авидность IgM может быть высокой даже при низкой аффинности отдельных антиген-связывающих центров, так как молекула IgM имеет десять таких центров, в то время как IgG может иметь два высокоаффинных центра.
Авидность IgM и IgG очень важна в диагностике и позволяет провести ретроспективный анализ вирусных заболеваний. Так, например, высокая авидность первичных IgM, свидетельствует об острой фазе заболевания и недавнем — от одного до полутора месяцев — инфицировании. Следовые концентрации IgM могут сохраняться в организме, в отдельных случаях, до двух лет.
