
- •Введение
- •Концентрационные границы зажигания
- •6. Классификация газогорелочных устройств. Способы сжигания топлива
- •Допустимые уровни звукового давления и шума
- •Предельно допустимое содержание оксидов углерода (со)
- •И температуре не более 1400 с
- •4 1 2 3 Воздух
- •Формулы расчета
- •Углерода и однокомпонентных газов при стехиометрических условиях
- •Газов при нестехиометрических условиях
- •Цепных реакций горения
- •Способы сжигания топлива
- •Деталям и системам автоматизации газогорелочных устройств
- •Газогорелочных устройств
- •Средняя теплоемкость газов и воздуха, кДж/м3 к
- •Зависимости химического состава продуктов сгорания от коэффициента расхода первичного воздуха, 1
- •Основы теории горения и детонации
Концентрационные границы зажигания
Газ |
Содержание газа в смеси, % |
Содержание газа в теоретической смеси, % |
Отклонение от теоретического состава |
|
min |
max |
|||
Двухатомные газы: Водород (Н2) Оксид углерода (СО) Алканы: Метан (СН4) Этан (С2Н6) Пропан (С3Н8) Бутан (С4Н10) Пентан (С5Н12) Гексан (С6Н14) Алкены: Этен (С2Н4) Пропен (С3Н6) Бутен (С4Н8) Алкины: Этин (С2Н2) Ароматические угле-водороды: Бензол (С6Н6) |
4 12,5
5 2,2 2,4 1,8 1,5 1,2
2,7 2,0 1,7
2,5
1,4 |
74 74
15 12,5 9,5 8,4 7,5 6,9
28,6 11,1 9,0
80
6,8 |
30,0 30,0
9,5 5,6 4,0 3,1 2,5 2,2
6,5 4,5 3,5
7,8
2,7 |
0,13–2,5 0,40–2,5
0,50–1,5 0,60–2,0 0,60–2,5 0,60–2,5 0,60–3,0 0,60–3,0
0,40–4,5 0,50–2,5 0,50–2,5
0,30–10
0,50–2,5 |
В табл. 1 кроме границ зажигания газов, полученных опытным путем, также представлены соответствующие им аналитические параметры, а именно содержание газа в стехиометрической газовоздушной смеси и отклонение от стехиометрического состава по пределам зажигания. Следует отметить, что с границами зажигания напрямую связаны такие явления, как проскок и отрыв пламени. Нижняя граница соответствует наиболее «бедной» топливом горючей смеси, а верхняя – наиболее «богатой», поэтому на нижней границе и близко к ней сжигание происходит при существенных избытках воздуха, что повышает вероятность отрыва пламени от носика горелки, а на верхней границе происходит неполное сгорание топлива из-за недостаточного количества воздуха, подаваемого на горение. В этих условиях повышена вероятность проскока пламени в корпус горелки. Следует отметить, что параметры табл.1 получены экспериментально, поэтому необходимо привести аналитические формулы расчета основных теплотехнических параметров процессов горения.
2. ТЕПЛОТЕХНИЧЕСКИЕ И ФИЗИКО-ХИМИЧЕСКИЕ ПАРАМЕТРЫ ПРОЦЕССОВ ГОРЕНИЯ, ФОРМУЛЫ РАСЧЕ-ТА
2.1. Теплота сгорания
Теплота сгорания, или теплотворная способность Qр – это количество тепла, выделяемого при полном сгорании 1 кг твердого топлива или 1 м3 газа. Различают высшую Qвр и низшую Qнр теплоты сгорания. Причем, Qвр Qнр. Здесь знак равенства соответствует сгоранию топлива, в котором не содержится водород, например монооксид углерода (СО).
Это обусловлено тем, что Qнр рассчитывают, когда при сгорании топлива образуются водяные пары, а Qвр – с учетом конденсации паров с образованием воды, при котором выделяется дополнительное тепло, что позволяет повысить КПД теплотехнического оборудования, поэтому для углеводородного топлива Qвр Qнр. В котлах процесс конденсации проводят в водяных экономайзерах. В отечественной теплотехнике все расчеты принято проводить по низшей теплоте сгорания. В этом обстоятельстве изначально заложено серьезное противоречие, которое заключается в том, что на установках комплексного ступенчатого использования топлива, разработанных профессором М.Б. Равичем [10]–[12], КПД, рассчитанный по Qнр, превышает 100 %. Однако расчеты по Qнр не учитывают отбора дополнительного тепла в результате конденсации водяных паров, содержащихся в продуктах сгорания углеводородного топлива. В действительности КПД всегда меньше 100 %, а расчеты КПД и КИТ следует проводить, используя высшую теплоту сгорания топлива – Qвр. В котлах и установках комплексного ступенчатого использования топлива конденсацию водяных паров осуществляют в специальных теплообменниках, именуемых экономайзерами.
Наиболее точной формулой для определения низшей теплоты сгорания твердого и жидкого топлива является формула Д.И. Менделеева:
Qнр = 81,2 Ср + 246 Нр – 26(Ор – Sр) – 5,97 Wр, ккал/кг =
= 340 Ср + 1030 Нр – 109 (Ор – Sр) – 25 Wр, кДж/кг, (1)
где верхний индекс (р) обозначает «рабочий» («рабочие»); коэффициенты перед атомарными элементами соответствуют их теплоте сгорания в пересчете на 1 %; Wр отвечает содержанию влаги в топливе.
Для расчета Qнр и Qвр газообразного топлива Д.И. Менделеев рекомендовал использовать следующие формулы:
Qнр = 85,5СН4 + 30,2СО + 25,8Н2 + 152С2Н6 + 218С3Н8 +
+ 283С4Н10 + 141С2Н4 + 205С3Н6, ккал/м3 =
= 358СН4 + 126,4СО + 108Н2 + 636,4С2Н6 + 992,8С3Н8 +
+ 1285,4С4Н10 + 590,4С2Н4 + 858,3С3Н6, кДж/м3; (2)
Qвр = 95СН4 + 30,2СО + 30,5Н2 + 166С2Н6 + 237С3Н8 +
+ 307С4Н10 + 150С2Н4 + 220С3Н6, ккал/м3 =
= 397,8СН4 + 126,4СО + 127,7Н2 + 695С2Н6 + 992,3С3Н8 +
+ 1285,4С4Н10 + 628,1С2Н4 + 921,1С3Н6, кДж/м3, (3)
где коэффициенты перед компонентами соответствуют их теплоте сгорания в пересчете на один процент, а химические символы компонентов отвечают их процентному содержанию в газовой смеси.
2.2. Температуры
Жаропроизводительность (tmax) – максимальная температура, развиваемая при полном сгорании топлива в условиях, когда выделяемое тепло полностью расходуется на нагрев образующихся продуктов сгорания.
Жаропроизводительность топлива определяет эффективность его использования в технике, особенно в высокотемпературных процессах. На основе жаропроизводительности и температуры продуктов сгорания определяют располагаемое тепло, а также потери тепла с уходящими газами по упрощенной методике теплотехнических расчетов М.Б. Равича.
Жаропроизводительность газовых смесей рассчитывают по формуле
tmax = Qнр : Vi ci , (4)
где знаменателем является сумма произведений объемов химических компонентов продуктов сгорания на их теплоемкость при tmax. В связи с тем, что величина последней до проведения расчетов неизвестна, используют метод итераций.
Калориметрическая температура (tкал) – это температура, развиваемая при сжигании топлива при подогреве воздуха, подаваемого на горение. Калориметрическую температуру рассчитывают по формуле
tкал = (Qнр + Vв cв tв) : Vi ci.. (5)
Формула (5) отличается от формулы (4) наличием в числителе дополнительного члена, который является произведением объема, теплоемкости и температуры воздуха, подаваемого на горение. При прочих равных условиях калориметрическая температура всегда выше жаропроизводительности, поэтому подогрев воздуха весьма эффективен. Здесь уместно отметить, что при подогреве воздуха дополнительно на каждые 100 градусов (при условии отсутствия тепловых потерь в воздухопроводах от рекуператоров до горелок) при сжигании природного газа КПД теплотехнических установок увеличивается приблизительно на 5 %.
Теоретическая температура горения. При температуре выше 1700 С необходимо учитывать расход тепла на диссоциацию продуктов сгорания, поэтому теоретическую температуру при подогреве воздуха рассчитывают по формуле
tт = (Qнр + Vв св tв – Qд) : Vi ci , (6)
где tт – теоретическая температура горения, а Qд – расход тепла на диссоциацию продуктов сгорания. При парциальном давлении 20 кПа и температуре 1800 С происходит диссоциация приблизительно 3,7 % диоксида углерода (СО2), при 1900 С – 6 %, при 2000 С – 10 %, при 2100 С – 15 %, при 2200 С – 23 %.
Диссоциация водяного пара (Н2О) при том же давлении значительно меньше, чем СО2. Так, например, при температуре 2000 С она составляет 3,5 %. Это практически в три раза меньше, чем при диссоциации диоксида углерода. Диссоциация продуктов сгорания происходит по уравнениям
t t
СО2 СО + 0,5О2 , Н2О Н2 + 0,5О2 . (7)
При температурах продуктов сгорания 1800–2400 С теоретическая температура составляет, соответственно, 0,903–0,977 от калориметрической температуры.
2.3. Химический состав топлива, наличие сернистых соединений, токсичность. Калорийный эквивалент, условное топливо
Природный газ – наиболее эффективное, экологически чистое современное топливо, как правило, не содержащее сернистых соединений. Продукты его сгорания могут содержать токсичные оксиды углерода и азота, поэтому необходимо добиваться химической полноты его сжигания и не допускать содержания оксидов в продуктах сгорания выше норм.
Для сравнительной оценки различных видов топлива необходимо иметь «масштаб сравнения». В качестве такого масштаба принято условное топливо (УТ), низшая теплота сгорания которого равна 7000 ккал/кг (29,3 МДж/кг). Калорийный эквивалент (Эи) рассчитывают через УТ по формуле (6):
Эи = Qнр/29,3, кг р.т/кг у.т, (8)
где аббревиатура (РТ) и (УТ), соответственно, рабочее и условное топливо. Для качественного угля Эи 2, для высококалорийного газообразного топлива Эи 7, поэтому такое топливо, как торф, нецелесообразно транспортировать на значительные расстояния. В связи с этим торф и низкосортные угли относят к категории местных топлив.
2.4. Объемы
Стехиометрический объем воздуха (Vв0) – это минимальное количество воздуха, которое необходимо для полного сжигания единицы объема или массы топлива.
Суммарный объем продуктов сгорания (V0) – это общий объем продуктов сгорания, включая водяные пары, образующихся при полном сгорании единицы объема или массы топлива со стехиометрическим объемом воздуха.
Стехиометрический объем продуктов сгорания (Vc.г0), где нижний индекс (с.г) обозначает «сухие газы», – это количество сухих продуктов сгорания, образующихся после конденсации водяных паров при полном сгорании единицы объема или массы топлива со стехиометрическим объемом воздуха.
Фактический объем продуктов сгорания (Vc.гф) – это количество сухих продуктов сгорания, образующихся при сжигании единицы объема или массы топлива после конденсации водяного пара при фактическом коэффициенте расхода воздуха.
2.5. Коэффициенты
Коэффициентом разбавления продуктов сгорания является отношение фактического объема сухих продуктов сгорания к стехиометрическому объему:
h = Vс.гф/Vс.г0. (9)
Коэффициентом расхода (избытка) воздуха () называют отношение фактического количества воздуха, подаваемого для сжигания топлива, к количеству воздуха, необходимому для полного сжигания топлива при стехиометрическом соотношении расходов топлива и воздуха. Коэффициент определяют следующим образом:
= Vв /Vв0, (10)
где Vв и Vв0, соответственно, фактический и теоретический (стехиометрический) объемы воздуха. Если коэффициент 1, то его часто называют коэффициентом избытка воздуха. Если коэффициент 1, то его называют коэффициентом расхода воздуха. Впрочем, этот термин является универсальным и применим для обоих рассматриваемых способов сжигания всех видов топлива.
Коэффициент расхода первичного воздуха 1 математически выражается следующим образом:
1 = V1в /Vв0, (11)
где V1в – объем воздуха, предварительно перемешанного с топливом. Таким образом, коэффициент расхода первичного воздуха является отношением объема воздуха, предварительно перемешанного с топливом, к стехиометрическому объему воздуха. Коэффициент расхода первичного воздуха 1 1.
Коэффициент расхода вторичного воздуха 2 математически выражается следующим образом:
2 = V2в /Vв0, (12)
где V2в – объем воздуха, подаваемый на дожигание продуктов неполного сгорания топлива. Таким образом, коэффициент расхода вторичного воздуха представляет собой отношение объема воздуха, подаваемого на дожигание продуктов неполного сгорания топлива, к общему объему воздуха, 2 1. При отсутствии третичного воздуха = 1 + 2.
Коэффициент расхода третичного воздуха. В низкотемпературных промышленных печах, например для низкотемпературного отпуска стальных изделий, часть воздуха подают на горение через горелку или непосредственно в камеру сгорания для разбавления продуктов сгорания и понижения их температуры. Этот воздух, называемый третичным, характеризует коэффициент расхода третичного воздуха.
В печах с параллельными зонами сжигания и дожигания воздух на дожигание подают через сопла параллельными ламинарными струями, содержащими вторичный, третичный и последующие потоки, поэтому такую организацию процесса дожигания продуктов неполного сгорания следует классифицировать как постадийное дожигание [18], [22].
2.6. Максимальное содержание компонентов
Максимальное содержание диоксида углерода в продуктах сгорания (СО2)max математически выражается следующим образом:
(СО2)max = 100 Vсо2, т / Vc.г , %, (13)
где числитель представлен объемом диоксида углерода, нижний индекс (т) в формуле числителя обозначает «теоретическое (стехиометрическое) значение», а (с.г) – «сухие газы», так как рассматриваемый параметр рассчитывают по отношению к объему сухих продуктов сгорания. Таким образом, СО2max является отношением объема диоксида углерода, образующегося при = 1,0, к суммарному объему сухих продуктов сгорания. По результатам газового анализа по этому параметру определяют эффективность сжигания топлива.
Максимальное содержание водяного пара в продуктах сгорания (Н2Оmax) математически выражается следующим образом:
Н2Оmax = 100 Vн2о, т / V , %, (14)
где числитель представлен объемом водяных паров, а нижний индекс, как в (13), обозначает «теоретическое значение». В отличие от формулы (13), в знаменателе (14) указан суммарный объем продуктов сгорания, учитывающий содержание в них водяных паров. Этот параметр также используют в теплотехнических расчетах.
Следует отметить, что данные табл. 1 также являются важными теплотехническими параметрами процессов горения. Кроме того, в данной главе представлены формулы, вытекающие из определений теплотехнических и теплофизических параметров с использованием только экспериментальных данных.
2.7. Теплоемкость продуктов сгорания: С
Из формул (4)–(6) видно, что величины теплоемкости всех компонентов продуктов сгорания используют при расчетах жаропроизводительности, калориметрической и теоретической температуры. Однако в этих формулах сам параметр не выражен в явной форме, хотя в указанных формулах есть все его составляющие. Величину теплоемкости продуктов полного сгорания рассчитывают по формуле
С = Vi Ci / Vi = (ССО2 VСО2 + СН2О VН2О + СN2 VN2 +
+ CО2 VО2) / (VСО2 + VН2О + VN2 + VО2), (15)
где Vi и Ci , соответственно, объемы и теплоемкости продуктов сгорания, которые расшифрованы в выражениях в скобках, а сама формула с их использованием представлена в развернутом виде. Если полнота сгорания топлива обеспечивается при стехиометрическом соотношении расходов горючего и окислителя, то в формуле (15) в выражениях в скобках нет последнего члена.
3. ФИЗИКО-ХИМИЧЕСКИЕ РЕАКЦИИ ГОРЕНИЯ УГЛЕ-РОДА И ОДНОКОМПОНЕНТНЫХ ГАЗОВ ПРИ СТЕХИО-МЕТРИЧЕСКИХ УСЛОВИЯХ
В воздухе в объемных процентах содержится приблизительно 79 % азота (N2) и 21 % кислорода (О2), другие компоненты представлены слабо. Исключением является аргон (Ar). Его содержание в воздухе составляет приблизительно 0,4 % . Однако аргон является инертным газом, поэтому в химических реакциях горения не участвует, а балластирует продукты сгорания. Балластом также является азот. При действующих в теплотехнических установках технологических температурах азот, как правило, не вступает в химическую реакцию с кислородом воздуха. Его наличие в небольших концентрациях возможно только при очень высоких температурах и особых условиях, например при существенных избытках воздуха. Наличие в продуктах сгорания окислов азота свидетельствует о том, что при сгорании топлива достигнута полнота его сжигания. Это обусловлено тем, что кислороду много проще окислить любой другой компонент топлива, чем азот. В связи с этим уместно отметить, что при наличии в продуктах сгорания окислов азота появление в них менее токсичного газа – оксида углерода (СО – угарный газ) – исключено.
Окислы азота, например «веселящий» газ, являются высокотоксичными отравляющими веществами, поэтому процессы горения организуют так, чтобы обеспечить содержание оксидов азота в продуктах сгорания в пределах планово допустимых концентраций (ПДК). Согласно последним содержание оксидов азота (NnOm) в продуктах сгорания топлива не должно превышать 0,01 % по объему, тогда как для оксида углерода эта норма составляет 0,05 %, что свидетельствует о более существенной токсичности оксидов азота.
Отношение содержания азота в воздухе к содержанию в нем кислорода составляет 79/21 = 3,76. Следовательно, при сжигании топлива на одну молекулу кислорода приходится 3,76 молекул азота, являющегося балластом, поэтому эта цифра и ее производные фигурируют во всех химических реакциях, описывающих сжигание топлива. Указанное соотношение справедливо для всех видов топлива независимо от их агрегатного состояния.
3.1. Химические реакции горения компонентов топлива в воздухе
Сжигание углерода в воздухе:
С + О2 + 3,76N2 = СО2 + 3,76N2. (16)
Сжигание оксида углерода в воздухе (СО):
СО + 0,5О2 + 1,88N2 = СО2 + 1,88N2 + 3020 ккал/м3
(12 640 кДж/м3). (17)
Сжигание водорода в воздухе (Н2):
Н2 + 0,5О2 + 1,88N2 = Н2О + 1,88N2 + 2580 ккал/м3
(10 800 кДж/м3). (18)
Сжигание однокомпонентных газов
в воздухе
Сжигание алканов (СnН2n + 2)
Горение метана:
СН4 + 2О2 + 7,52N2 = СО2 + 2Н2О + 7,52N2 + 8550 ккал/м3
(35 800 кДж/м3). (19)
Горение этана:
С2Н6 + 3,5О2 + 13,16N2 = 2СО2 + 3Н2О + 13,16N2 +
+ 15 200 ккал/м3 (63 640 кДж/м3). (20)
Горение пропана:
С3Н8 + 5О2 + 18,8N2 = 3СО2 + 4Н2О + 18,8N2 + 21 800 ккал/м3
(99 280 кДж/м3). (21)
Горение бутана:
С4Н10 + 6,5О2 + 24,44N2 = 4СО2 + 5Н2О + 24,44N2 +
+ 28 300 ккал/м3 (128 540 кДж/м3). (22)
Сжигание алкенов (Сn H2n)
Горение этена:
С2Н4 + 3О2 + 11,28N2 = 2СО2 + 2Н2О + 11,28N2 +
+ 14 100 ккал/м3 (509 040 кДж/м3). (23)
Горение пропена:
С3Н6 + 4,5О2 + 16,92N2 = 3СО2 + 3Н2О + 16,92N2 +
+ 20 500 ккал/м3 (85 830 кДж/м3). (24)
Горение бутена:
С4Н8 + 6О2 + 22,56N2 = 4СО2 + 4Н2О + 22,56N2 . (25)
Сжигание алкинов (СnHn)
Горение этина:
C2H2 + 2,5О2 + 9,4N2 = 2CО2 + Н2О + 9,4N2. (26)
Горение бензола:
С6Н6 + 7,5О2 + 28,2N2 = 6СО2 + 3Н2О + 28,2N2. (27)
На основе приведенных химических уравнений несложно получить аналитические формулы для расчета характеристик, которые также являются важнейшими параметрами процессов горения.
Ранее такое обобщение в виде аналитической формулы для углеводородного газового топлива при его сжигании в кислороде представлено А.В. Арсеевым [1, с. 51]. При сжигании углеводородного топлива в воздухе эта формула и соответствующее ей уравнение горения имеют вид
CmHn + (m + n/4) О2 + 3,76 (m + n/4) N2 =
= m CО2 + n/2Н2О + 3,76 (m + n/4) N2 + Q. (28)
Формула (28) позволяет описывать физико-химические реакции горения углеводородов, но не учитывает возможности наличия в исходном топливе оксида углерода, водорода и компонентов самого топлива, которые являются продуктами его сгорания, а именно влаги, которая при сжигании топлива образует водяной пар и диоксид углерода. Нетрудно убедиться, что представленная формула абсолютно справедлива и компактна.
Однако в такой записи уравнения заложено серьезное противоречие. Формула (28) неоправданно усложнена, так как содержит два переменных коэффициента n и m, тогда как химические формулы всех углеводородных газов содержат только один коэффициент n. Так, формула гомологического ряда алканов – Cnн2n + 2, алкенов – Сnн2n , алкинов – СnHn , поэтому весьма вероятно, что можно ограничиться только одним коэффициентом: n. Таким образом, актуальной является задача получения такой формулы.
3.2. Стехиометрический (теоретический) объем воздуха
Стехиометрический (теоретический) объем воздуха (Vв0), необходимый для горения топлива, является знаменателем в формуле (12), позволяющей рассчитывать многие характеристики процессов горения топлива, например коэффициент расхода воздуха . Сам параметр также представляет самостоятельный интерес. При выводе формулы для расчета Vв0 используют приведенные выше уравнения химических реакций. Так, из уравнения (16) следует, что для сжигания 1 кг углерода требуется 1 м3 кислорода. Из уравнений (16)–(27) следует, что при сжигании всех видов топлив объем азота, вносимого с воздухом, в 3,76 раза больше объема кислорода, поэтому объем воздуха, необходимого для полного сжигания топлива, всегда в 4,76 раза больше объема содержащегося в нем кислорода.
Объединив данные уравнений (16)–(27), получим:
Vв 0 = 4,76 (С + 0,5СО + 0,5Н2 + 2СН4 + 3,5С2Н6 + 5С3Н8 +
+ 6,5С4Н10 + 3С2Н4 + 4,5С3Н6 + 6С4Н8 + 2,5С2Н2 + 7,5С6Н6), (29)
где цифровые коэффициенты перед углеродом и химическими символами газовых компонентов соответствуют необходимому для сжигания 1 м3 рассматриваемого газа объему кислорода. Таким образом, размерность этих коэффициентов м3/м3, а самих символов, как и искомого параметра, м3.
Формула (29) справедлива практически для любого топлива, содержащего углерод и горючие газы, однако имеет более компактный вид для любого реального топлива, например для природного газа, так как в нем, как правило, отсутствуют первые три и последние два компонента. Формула (29) также справедлива и для искусственного газового топлива, например для сжиженного, коксового и доменного газов.
Формуле (29) можно придать более компактный вид, если выявить следующую закономерность. Алканы – гомологи метана – представлены в формуле (29) четырьмя компонентами, начиная с метана, четвертого члена формулы (29), и заканчивая бутаном, седьмым членом этой формулы. Для каждого следующего в порядке возрастания гомолога ряда метана требуется кислорода на 1,5 объема больше, чем для предыдущего, а полный объем кислорода, необходимого для сжигания всех компонентов ряда алканов, описывается компактной формулой
VO2 = (1,5n + 0,5) СnH2n + 2. (30)
Алкены – гомологи этена (этилена) – представлены в формуле (24) тремя членами: этеном, пропеном и бутеном. Для них, как и для всего ряда алкенов, характерна закономерность
VO2 = 1,5n CnH2n . (31)
Алкины представлены в формуле (25) только двумя членами: этином (ацетиленом) и гексином (бензолом). Для них характерна закономерность
VO2 = 1,25n СnНn . (32)
В связи с закономерностями, выявленными для алканов, алкенов и алкинов, формулу (29) можно представить в виде
Vв 0 = 4,76 [С + 0,5 (СО + Н2) + (1,5n + 0,5) СnH2n + 2 +
+ 1,5n CnH2n + 1,25СnНn]. (33)
Если газ содержит только углеводородные газы, то расчет объема воздуха ограничивается тремя последними членами. В реальных газах, например в природном газе, как правило, отсутствуют углерод, оксид углерода, водород, ацетилен и бензол, поэтому для этого газа формула (27) имеет вид
Vв0 = 4,76 [(1,5n + 0,5) СnH2n + 2 + 1,5n Cn H2n]. (33.1)
Искусственные газы, например коксовый и доменный, имеют две горючих составляющих: оксид углерода и водород, поэтому для этих газов формула (27) примет вид
Vв = 2,38 (СО + Н2). (33.2)
Следует отметить, что при сжигании любых газовых смесей в условиях, отличных от стехиометрических, фактический объем воздуха рассчитывают по формуле
Vв = Vв0. (34)
3.3. Стехиометрический объем диоксида углерода
Стехиометрический объем диоксида углерода (СО2), образующегося при сжигании топлива в воздухе, широко используют при теплотехнических расчетах горения топлива. Суммируя результаты химических реакций для углеродосодержащих компонентов по диоксиду углерода, получим формулу
V 0CO2 = С + СО + СН4 + 2С2Н6 + 3С3Н8 + 4С4Н10 + 2С2Н4 +
+ 3С3Н6 + 4С4Н8 + 2С2Н2 + 6С6Н6 – СО2т , (35)
где С, СО, и СО2т, соответственно, содержание углерода, оксида и диоксида углерода в исходном топливе.
Проведя анализ формулы (29), аналогичный представленному выше, получим формулу
V 0CO2= С + СО2 + n (СnH2n + 2 + CnH2n + CnHn) – СО2т , (36)
где СО2 – объем диоксида углерода, который образовался при сгорании углерода и оксида углерода, а последний член обозначает наличие диоксида углерода в самом топливе. В отличие от формулы (28), формула (36) является более универсальной, так как, во-первых, позволяет выполнять расчеты при совместном сжигании твердого и газообразного топлива, во-вторых, обобщения, справедливые для алканов и алкенов, в этой формуле распространены и на алкины, хотя они представлены только двумя компонентами: этином (ацетиленом) и гексином (бензолом). Это обусловлено тем, что количество атомарного углерода во всех гомологических рядах для всех газов соответствует их порядковому номеру. Именно поэтому объемы диоксида углерода, образовавшегося при сжигании всех углеродосодержащих однокомпонентных газов, соответствуют количеству атомов углерода в молекуле газа.
3.4. Стехиометрический объем водяных паров
Стехиометрический объем водяных паров (Н2О), образующихся при стехиометрическом сжигании топлива в воздухе, также используют при теплотехнических расчетах сжигания топлива. Суммируя результаты химических реакций для водородосодержащих компонентов по водяному пару, получим формулу
V 0H2O = Н2 + 2СН4 + 3С2Н6 + 4С3Н8 + 5С4Н10 + 2С2Н4 +
+ 3С3Н6 + 4С4Н8 + С2Н2 + С6Н6 – Н2т , (37)
где Н2т – объем водяного пара в исходном топливе. Проведя анализ формулы (37) по аналогии с формулами (28), (31), получим:
V 0H2O = Н2О + (n + 1) СnH2n + 2n CnH2n + 0,5n СnHn – V 0H2Oт , (38)
где Н2О соответствует содержанию водорода, а V 0H2Oт – объему водяных паров в исходном топливе.
3.5. Суммарный объем продуктов полного сгорания и объем сухих продуктов сгорания
Объем продуктов полного сгорания (V 0п с.г) при стехиометрическом соотношении расходов газа и воздуха ( = 1,0) нетрудно рассчитать путем суммирования его составляющих по формуле
V 0п с.г = V 0СО2 + V 0Н2О + V 0 N2 – Vт.г , (39)
где Vт.г , соответственно, объемы диоксида углерода, водяных паров и азота в исходном топливе. Объем сухих продуктов сгорания (V 0с.г) определяют по частному случаю формулы (39) без учета образования и содержания влаги в исходном топливе. Для углеводородного газового топлива формула (28) в развернутой форме имеет вид
СnН2n + 2 + CnН2n + Cn Hn + n (O2 + 3,76N2) [(1,5 + 0,5/n)
CnН2n + 2 + 1,5СnН2n + 1,25CnHn] = n {[CO2 (CnH2n + 2 +
+ CnH2n + CnHn )] + H2O[(1 + 1/n) CnH2n + 2 + CnH2n + 0,5CnHn] +
+ 3,76N2 [(1,5 + 0,5/n) CnH2n + 2 + 1,5СnН2n + 1,25СnНn]}. (40)
При сопоставлении формул (40) и (28) видно, что формула (28) отличается компактностью, и это свойство дает ей известные преимущества при инженерных расчетах без привлечения современных программ и алгоритмов расчета. Однако при их наличии использование формулы с одним переменным коэффициентом позволяет существенно уменьшить время расчета. Кроме того, запись реакций горения по формуле (40) отвечает традициям органической химии и не позволяет использовать при расчетах ошибочные формулы углеводородных газов.
4. ФИЗИКО-ХИМИЧЕСКИЕ РЕАКЦИИ ГОРЕНИЯ ГАЗОВ ПРИ НЕСТЕХИОМЕТРИЧЕСКИХ УСЛОВИЯХ
4.1. Общие положения
Следует отметить, что на практике буквально для всех технологических процессов, на теплотехнических установках, в которых сжигают топливо, коэффициент расхода воздуха всегда отличен от единицы. В преобладающем большинстве теплотехнических установок в рабочем пространстве печей и топках котлов 1. Это обусловлено тем, что достичь химической полноты сгорания топлива при = 1,0 практически невозможно, поэтому в продуктах полного сгорания топлива в этих условиях также имеются оксид углерода (СО), являющийся высокотоксичным химическим соединением (так называемый угарный газ), и сажистый углерод (Сс), который, с одной стороны, проявляет себя положительно, повышая светимость факела и, как следствие, теплопередачу к садке, а с другой – отрицательно, так как его дожигание весьма проблематично. Кроме того, сажистый углерод отрицательно влияет на срок службы отдельных компонентов печей, например радиационных труб (РТ), так как науглероживает их внутреннюю поверхность с образованием пироуглерода.
В металлургической теплотехнике для термохимической обработки металлопродукции широко применяют безокислительный и малоокислительный нагрев, используя так называемые контролируемые атмосферы. При наличии в этих атмосферах углеродосодержащих компонентов обеспечивается защита поверхности садки не только от окисления, но и при необходимости от обезуглероживания. Возможна также реставрация углеродного потенциала (УП), так как последний является очень важным показателем качества термохимической обработки таких марок стали, как шарикоподшипниковая сталь ШХ15, и различных марок стали для изготовления игольной проволоки.
При сжигании топлива с коэффициентом расхода воздуха больше единицы ( 1) горение сдвигается в сторону нижней концентрационной границы воспламенения. Сжигание природного газа с существенными избытками воздуха ( 1) применяют для снижения температуры в рабочем пространстве печей низкотемпературного отпуска, а также для подавления процессов образования сажистого углерода в радиационных трубах.
Наиболее перспективным, экономически эффективным и экологически чистым топливом является природный газ, в котором, как и в древесине, отсутствует сера и ее химические соединения. Все другие виды топлива содержат сернистые соединения. Основной составляющей природного газа является метан (СН4). Физико-химические характеристики метана и природного газа очень близки. Это обусловлено тем, что наличие балласта в природном газе компенсируют содержащиеся в нем алканы, например этан и пропан, и алкены, например этилен, поэтому изучение химических реакций горения метана представляет особый интерес.
4.2. Сжигание метана (СН4) при существенных избытках воздуха, включая нижнюю концентрационную границу вос-пламенения
Большинство современных газогорелочных устройств позволяют обеспечить химическую полноту сгорания в широком диапазоне расходов топлива при 1,05 – 1,10. В качестве примера приведем химическую реакцию горения метана при = 1,10:
СН4 + 2,2О2 + 8,27N2 = СО2 + 2Н2О + 0,2О2 + 8,27N2 +
+ 8550 ккал/м3 (35 800 кДж/м3). (41)
Наибольший интерес представляют реакции горения метана на концентрационных границах воспламенения, которые определены экспериментально, представлены в табл. 1 и составляют 5–15 %. Этих данных вполне достаточно для описания химических реакций на концентрационных границах. Первичная задача состоит в определении коэффициентов расхода воздуха , которые соответствуют этим границам.
Очевидно, что нижней границе воспламенения для метана соответствует 5 %. Это так называемая «бедная» газовоздушная смесь. Ее горение происходит при существенных избытках воздуха, поэтому при 1 приемлем термин коэффициент избытка воздуха.
Определить соответствующий коэффициент избытка воздуха для нижней границы проще, чем для верхней, так как при сжигании любого вида топлива объемы продуктов полного сгорания всегда сохраняются, а дополнительным балластом является только избыточный воздух.
Нижний предел воспламенения метана составляет 5 %. Следовательно, воздуха в смеси 95 %. Таким образом, на 1 м3 метана приходится 19 м3 воздуха. При стехиометрическом горении на 1 м3 метана приходится 9,52 м3 воздуха. Следовательно, на нижней границе = 19/9,52 = 1,996 2,0. Тогда химическая реакция горения метана с указанным коэффициентом избытка воздуха будет иметь вид
СН4 + 4О2 + 15,04N2 СО2 + 2Н2О + 2О2 + 15,04N2 +
+ 8550 ккал/м3 (35 800 кДж/м3). (42)
Из уравнения (42) следует, что в результате сгорания метана на нижней границе воспламенения выделяется то же количество тепла, что и при стехиометрическом сгорании метана (19). Причина этой закономерности очевидна и характерна для любого вида топлива. При его сжигании с избытками воздуха существенно увеличивается объем продуктов сгорания. Избыточный воздух является балластом и в горении не участвует, поэтому при его наличии существенно снижается температура горения, но не изменяется количество выделяемой теплоты, поскольку достигнута химическая полнота сгорания топлива. Таким образом, при сжигании метана от стехиометрического значения до нижнего предела коэффициент избытка воздуха изменяется в диапазоне 2 1.
4.3. Сжигание природного газа при существенных недостатках воздуха, включая верхнюю концентрационную границу воспламенения
В результате сжигания топлива при существенном дефиците воздуха продукты его сгорания содержат не только продукты полного сгорания: диоксид углерода (СО2) и водяные пары (Н2О), но и продукты неполного сгорания: оксид углерода (СО) и водород (Н2). В качестве примера приведем химическую реакцию сгорания метана в воздухе при коэффициенте расхода воздуха = 0,625:
СН4 + 1,25О2 + 4,7N2 = 0,5СО2 + 0,5СО + Н2 + Н2О + 4,7N2 +
+ 4460 ккал/м3 (18 674 кДж/м3). (43)
Таким образом, при полном сжигании 1 м3 природного газа по уравнению (43) в результате неполного сгорания образуется 0,5 м3 оксида углерода и 1 м3 водорода. Тогда выделенное в результате реакции количество теплоты можно определить как разность между нижней теплотой сгорания 1 м3 метана и суммой потенциального тепла продуктов неполного сгорания:
Q=0,625 = 8550 – (0,5 3020 + 2580) = 4460 ккал/м3
(18 674 кДж/м3).
Именно поэтому данные значения количества теплоты фигурируют в физико-химическом уравнении (43).
Верхний предел воспламенения метана составляет 15 %, что соответствует предельно «богатой» метаном газовоздушной смеси. Следовательно, воздуха в смеси 85 %. Таким образом, на 3 м3 метана приходится 17 м3 воздуха, а на 1 м3 = 5,(6) 5,67 м3. Коэффициент расхода воздуха на верхней границе равен = 5,(6)/9,52 = 0,5952 0,60, поэтому химическая реакция горения метана имеет вид
СН4 + 1,2О2 + 4,512N2 0,4СО2 + 0,6СО + Н2О + Н2 +
+ 4,512N2 + 4158 ккал/м3 (17 410 кДж/м3). (44)
Таким образом, при сжигании метана на верхней концентрационной границе из-за химической неполноты сжигания при реализации химической реакции (44) выделяется приблизительно в два раза меньше тепла, чем при стехиометрическом сгорании. Эти результаты получены путем следующего расчета. При полном сгорании 1 м3 метана выделяется 8550 ккал/м3. При неполном сжигании 1 м3 метана с = 0,60 по реакции (39) продукты неполного сгорания содержат 0,6 м3 оксида углерода и 1 м3 водорода. Теплота сгорания СО, согласно уравнению (17), составляет 3020 ккал/м3, а водорода по уравнению (18) – 2580 ккал/м3. Тогда
Q = 8550 – (0,6 3020 + 2580) = 4158 ккал/м3
(17 410 кДж/м3).
Следует отметить, что при сжигании всех видов топлива при значениях коэффициента , близких к концентрационным гра-ницам, горение весьма неустойчиво. Однако если горение с существенными избытками воздуха на нижней концентрационной границе для предварительно подготовленной смеси метана и воздуха протекает только по реакции (42), то на верхней границе возможны отличные от (44) физико-химические реакции. Например, для метана при = 0,6 такие реакции имеют вид:
СН4 + 1,2О2 + 4,512N2 0,45СО2 + 0,5СО + Н2О + Н2 +
+ 0,05С + 4,512N2 + 4054 ккал/м3 (16 974 кДж/м3); (45)
CН4 + 1,2О2 + 4,512N2 0,5СО2 + 0,4СО + 0,9Н2О + 1,1Н2 +
+ 0,05 О2 + 4,512 N2 + 4504 ккал/м3 (18 858,2 кДж/м3). (46)
Расчеты выделений тепла в результате экзотермических физико-химических реакций (45) и (46) проводились аналогично приведенным расчетам для реакций (43), (44). При этом теплоту сгорания углерода в реакции (45) принимали согласно формуле (1) – 8120 ккал/м3 (33 998,4 кДж/м3).
Таким образом, из приведенных реакций (44)–(46) на верхней концентрационной границе горения метана, которой соответствует коэффициент расхода воздуха = 0,6, следует, что все три реакции являются экзотермическими. При этом количество теплоты, выделяемое в результате указанных реакций, минимально для варианта (45), где горение сопровождается образованием углерода, и максимально для варианта (46). Максимальное отличие выделений теплоты для приведенных трех вариантов горения составляет приблизительно 10 %.
Сжигание природного газа с коэффициентами расхода воздуха, близкими к верхней концентрационной границе – = 0,6, имеет большое практическое значение, связанное с проблемами окисления и обезуглероживания металлопродукции в промышленных печах [9], [16], [17]. В заключение следует отметить, что коэффициент расхода воздуха для метана, соответствующий пределам его воспламенения 5–15 %, изменяется в диапазоне 2 0,6.
4.4. Малоокислительный и безокислительный нагрев ме-таллопродукции, проблемы обезуглероживания ее поверхности
Окисление и обезуглероживание металлов и сплавов определяется многими факторами, к важнейшим из которых относятся химический состав и влажность контролируемой атмосферы, заполняющей рабочее пространство промышленных печей, химический состав и структура металлов и сплавов, температура термохимической обработки и ее скорость.
Эти факторы также определяют степень окисления и структуру окалины. Ее образование при нагреве приводит к большим потерям металлопродукции, к ухудшению качества ее поверхности, снижению стойкости и износу конструктивных элементов печей, затрудняет их обслуживание, препятствует внедрению таких эффективных и экономичных процессов, как непрерывная прокатка и точная штамповка. Последнее обстоятельство связано с тем, что наличие на поверхности металлопродукции окалины обуславливает необходимость ее последующего травления. Это прерывает общий технологический цикл.
В рамках данного параграфа целесообразно пояснить отличие малоокислительного и безокислительного нагрева. Оно во многом связано со специфическими особенностями технологических процессов в различных отраслях промышленности. Например, в машиностроении, если прошедшая термохимическую обработку деталь удовлетворяет целям точной штамповки, такой нагрев называют безоокислительным.
Иначе обстоит дело в черной металлургии, в частности в метизном производстве. Здесь на поверхности многих видов металлопродукции, например игольной проволоки, шарикоподшипниковой стали ШХ-15, низкоуглеродистой проволоки, предназначенной для изготовления металлической сетки с полимерным покрытием, после термохимической обработки недопустимы даже так называемые «цвета побежалости». При их наличии окисление поверхности стали измеряют в ангстремах. В связи с этим способ нагрева, именуемый в машиностроении как безоокислительный, в метизном производстве называют малоокислительным. Этот способ нагрева также широко применяют в непрерывных технологических линиях подготовки низкоуглеродистой проволоки к волочению, а также при горячем оцинковании и патентировании высокоуглеродистой проволоки.
В технологических линиях подготовки к волочению и при патентировании такой способ нагрева используют в многониточных термических печах рекристаллизационного отжига низкоуглеро-дистой проволоки и в нагревательных печах для производства высокоуглеродистой проволоки. При горячем оцинковании проволоки малокислительный нагрев также используют в печах-ваннах горячего оцинкования.
По способу нагрева и конструкции все рассматриваемые печи являются печами с двухстадийным сжиганием природного газа с последовательными и параллельными зонами сжигания и дожигания [18], [20], [22].
В одной из двух основных технологических зон этих печей природный газ сжигают при существенном недостатке воздуха. В печах с последовательными и параллельными зонами сжигания и дожигания природный газ сжигают по реакциям (43)–(46). При этом коэффициент расхода первичного воздуха в зоне неполного сжигания природного газа составляет 1 = 0,60 – 0,625.
Природный газ дожигают во второй основной технологической зоне печей при минимальных избытках воздуха таким образом, чтобы общий коэффициент расхода воздуха составлял = 1,05 – – 1,10. В термических печах с параллельными зонами из зоны дожигания в зону неполного сжигания через теплопроводный промежуточный под подводится дополнительное тепло, что позволяет снизить коэффициент расхода первичного воздуха 1 и тем самым улучшить качество контролируемой атмосферы. Это в совокупности с нагревом воздуха позволяет уменьшить коэффициент расхода первичного воздуха: 1 = 0,45 – 0,55.
Очевидно, что значению коэффициента = 1,05 при коэффициенте 1 = 0,60 отвечает коэффициент расхода вторичного воздуха 2 = 0,45, а при коэффициенте 1 = 0,625 2 = 0,425. Значению коэффициента = 1,10 при коэффициенте 1 = 0,60 отвечает 2 = = 0,50, а при 1 = 0,625 2 = 0,475. Для реакции (43) процесс дожигания продуктов неполного сгорания протекает следующим образом:
0,5СО + 0,25О2 + 0,94N2 = 0,5СО2 + 0,94N2 + 1510 ккал/м3
(6322,4 кДж/м3); (47)
Н2 + 0,5О2 + 1,88N2 = Н2О + 1,88N2 + 2580 ккал/м3
(10 802,5 кДж/м3). (48)
Суммируя результаты реакций (43), (47), (48), получим уравнение (19), соответствующее стехиометрическим условиям горения метана. Легко убедиться, что те же результаты можно получить для других вариантов. При сжигании метана с = 1,05 – 1,10 выделяется такое же количество тепла, что и при стехиометрическом горении, а коэффициенты при кислороде и азоте следует умножать на соответствующий суммарный коэффициент расхода воздуха .
Возвращаясь к проблемам, связанным с окислением поверхности металлопродукции, следует проиллюстрировать положительное влияние продуктов неполного сгорания: водорода и оксида углерода – на их решение, например, для окиси железа – вюстита (FeO):
FeO + Н2 Fe + Н2О; (49)
FeO + СО Feс + СО2. (50)
Из физико-химических реакций (49), (50) видно, что водород и оксид углерода восстанавливают на поверхности металлопродукции химически чистое железо. Двойное направление стрелок в физико-химических реакциях указывает на то, что они являются обратимыми. Нижний индекс «с» в реакции (50) свидетельствует о том, что помимо восстановительных свойств оксид углерода также обладает свойствами науглероживания. В данном случае это показано на примере окиси железа – вюстита.
Проблема обезуглероживания стали является не менее острой, чем проблема окисления поверхности металлопродукции, которая при термохимической обработке теряет углеродный потенциал, поэтому существует необходимость его восстановления. Это весьма актуально для шарикоподшипниковой стали ШХ-15, игольной проволоки и крепежных изделий. При наличии обезуглероженного слоя на поверхности бунтов и пакетов прутков, сформированных из стали ШХ-15, на соответствующих технологических линиях производят «обдирку» их поверхности. Игольную проволоку отжигают в мотках, поэтому при наличии обезуглероженного слоя необходимо снять с мотков последние витки. Эти способы связаны с необратимыми потерями металлопродукции, но позволяют обеспечить ее качество. Для крепежных изделий такие способы неприемлемы, поэтому необходимы повторные операции, например реставрационный отжиг в контролируемой атмосфере с высоким углеродным потенциалом, обуславливающий существенные дополнительные затраты.
Этим же свойством обладает и углерод, который образуется при неполном сжигании углеводородного топлива. Для метана образованию сажистого углерода соответствует физико-химическая реакция (45). Сажистый углерод повышает светимость факела. Это свойство в печах открытого малоокислительного нагрева является весьма положительным, так как позволяет существенно уменьшить удельные расходы топлива и увеличить производительность печей.
Сажистый углерод имеет также и отрицательное влияние, так как отлагается на поверхности, например, проволоки и препятствует последующему стравливанию окислов в технологических линиях. Кроме того, следует отметить, что в радиационных трубах также происходит сажеобразование. Его подавляют, подавая на сжигание избыточный воздух. Здесь наличие сажистого углерода недопустимо, поэтому наличие в продуктах неполного сгорания оксида углерода для решения означенной проблемы в печах открытого малоокислительного нагрева является более предпочтительным.
4.5. Сжигание природного газа для получения защитного газа в пределах концентрационных границ горения
Все вышеприведенные физико-химические реакции горения являются зкзотермическими. Это реакции, при которых сжигание топлива сопровождается выделением теплоты. Выше показано, что в строгом понимании экзогазовые атмосферы при сжигании топлива с существенным недостатком воздуха являются малоокислительными, так как в продуктах неполного сгорания помимо восстановительных компонентов: водорода (Н2) и оксида углерода (СО) – также содержатся окислительные компоненты: водяные пары (Н2О) и диоксид углерода (СО2). Так, например, в сухих продуктах неполного сгорания по реакции (43) содержится приблизительно по 7,5 % оксида и диоксида углерода, 15 % водорода и 70 % азота, по реакции (44) – 9,2 % СО, 6,1 % СО2, 13,3 % Н2, 69 % N2, а по реакции (46) – 6 % СО, 9,1 % СО2, 15,1 % Н2, 69,8 % N2. Реакция (45) здесь не рассматривается, так как влияние сажистого углерода на совокупный процесс, как показано выше, двояко. Химический состав, а следовательно, и восстановительные свойства всех четырех малоокислительных атмосфер, получаемых при неполном сжигании метана по реакциям (43)–(46), приблизительно одинаковы.
Наличие в продуктах неполного сгорания метана как окислительных, так и восстановительных компонентов предполагает обратимость реакций. Именно поэтому стрелка в физико-химических реакциях имеет два противоположных направления. Строго говоря, обратимыми являются реакции (43)–(46). Здесь установлено только одно прямое направление, так как горение протекает в пределах концентрационных границ воспламенения. Обратимость рассматриваемых реакций обусловлена тем, что одновременно с реакциями окисления горючего газа и образованием продуктов полного сгорания протекают обратимые реакции их разложения. Так, реакции горения простейших двухатомных газов (водорода и оксида углерода) протекают одновременно со встречными реакциями разложения водяных паров и диоксида углерода. С повышением температуры скорость встречных реакций возрастает. В связи с вышеизложенным получение надежных безокислительных атмосфер представляет особый интерес.
Из контролируемых газовых атмосфер, которыми заполняют рабочее пространство термических печей, наибольшее применение во всех отраслях промышленности получил так называемый защитный газ. Его синтезируют как из аммиака (NН3), так и из природного газа. При первом способе защитный газ содержит 4–5 % Н2 и 96–95 % N2. При втором способе помимо указанных компонентов защитный газ содержит до 2 % СО. Этот способ получения контролируемой атмосферы предпочтительнее первого, так как исключается использование аммиака, что обеспечивает большую экологическую безопасность процесса, а защитный газ позволяет не только предохранять металлопродукцию от окисления, но и обладает восстановительными свойствами по углеродному потенциалу. Однако в регионах, где производят аммиак и имеются крупные станции разделения воздуха, например в Череповце и Липецке, первый способ намного экономичнее второго. Влажность защитного газа не зависит от способа его получения и не должна превышать -40 С.
Технология получения защитного газа по указанным способам сложна, предполагает использование специального оборудования, дорогостоящих катализаторов, например, на основе палладия и других компонентов. Она реализуется на крупных газозащитных станциях (ГЗС). В связи со сложностью указанных способов данная технология здесь не рассматривается. Однако с ней можно ознакомиться по монографиям [9], [16], [17]. При использовании второго способа на первой стадии природный газ сжигают с коэффициентом расхода воздуха = 0,85 – 0,90, поэтому сам процесс горения является экзотермическим. Среднему значению коэффициента = = 0,875 соответствует физико-химическая реакция
СН4 + 1,75О2 + 6,58N2 = 0,5СО2 + 0,5СО + 2Н2О + 6,58N2 +
+ 7040 ккал/м3 (29 476,5 кДж/м3); = 1,75/2 = 0,875. (51)
4.6. Сжигание природного газа за концентрационными границами воспламенения, получение эндогаза
Сжигание всех видов топлива возможно и за концентрационными границами. Рассмотрение таких возможностей связано не только с техногенными процессами, но и с целесообразностью их внедрения в различные технологические процессы. Существуют различные пути их реализации, но все они основаны на одном принципе: в зону горения необходимо подвести дополнительную теплоту. На всех промышленных печах это несложно выполнить известными способами, например путем нагрева воздуха, а для низкокалорийных газов и топлива, подаваемых на горение, – в рекуператорах, рециркуляцией продуктов сгорания в горелочных туннелях с каталитическими свойствами и т.д.
К нетривиальным методам можно отнести применение специальных конструктивных элементов, например промежуточного пода и свода на печах открытого малоокислительного нагрева с параллельными зонами сжигания и дожигания. Так, согласно работам [18]–[23], такой метод при применении современных высокотеплопроводных материалов в совокупности с высокотемпературным нагревом первичного воздуха позволяет снизить коэффициент расхода первичного воздуха 1 с 0,60 до 0,45–0,55. Это способствует улучшению качества химического состава атмосферы, так как в продуктах неполного сгорания повышается содержание восстановительных компонентов.
Сжигание природного газа выше нижней концентрационной границы воспламенения 2 представляет известный практический интерес для печей низкотемпературного отпуска, где необходимые технологические температуры при сжигании природного газа можно поддерживать только при = 2,5 – 3,0. Кроме того, коэффициенты 2 поддерживают при сжигании природного газа в радиационных трубах с диффузионными горелками для подавления процессов сажеобразования.
Существуют также физико-химические процессы, при которых указанные способы расширения концентрационных границ горения уже не действуют. Практический интерес представляют такие процессы, при которых 0,45 – 0,55, так как в результате получают так называемые эндогазовые контролируемые атмосферы, не содержащие окислительных компонентов. Их реализуют, подводя в зону горения дополнительное тепло и используя катализаторы, например, марок «ГИАП» в виде колец Рашига. С практической точки зрения наибольший интерес представляет процесс получения эндогаза, который реализуется в специальных установках – эндогенераторах и описывается физико-химическим уравнением
t, k
СН4 + 0,5О2 + 1,88N2 CО + 2Н2 + 1,88N2 + 370 ккал/м3
(1549,2 кДж/м3); = 0,5/2 = 0,25. (52)
Количество теплоты, выделяемой в результате реакции (52), было рассчитано аналогично реакции (43):
Q=0,6 = 8550 – 3020 – 2 2580 = 370 ккал/м3 (1549,2 кДж/м3).
Из реакции (52) следует, что, строго говоря, она является экзотермической, так как в результате сжигания метана при = 0,25 все же выделяется небольшое количество тепла. По очевидным причинам физико-химическую реакцию (52) без дополнительного подвода теплоты и наличия катализаторов реализовать невозможно, поэтому получаемую в результате этой реакции атмосферу принято называть эндогазом. Продукты неполного сгорании реакции содержат 20,5 % оксида углерода, 41 % водорода и 38,5 % азота. Таким образом, эндогаз обладает сильными восстановительными свойствами по восстановлению химически чистого железа и углеродного потенциала на поверхности металлопродукции.
Существует и другой способ получения контролируемой ат-мосферы с указанными положительными свойствами – конверсия природного газа водяным паром, протекающая по физико-химической реакции
СН4 + Н2О СО + 3Н2. (53)
Из реакции (53) следует, что ее продукты содержат 25 % оксида углерода и 75 % водорода, т.е. восстановительные свойства этой атмосферы выше даже, чем у эндогаза. Это обусловлено не только тем, что продукты реакции (53), в отличие от реакции (52), не содержат балласта в виде азота, но и результатами самой реакции. Действительно, при получении эндогаза по реакции (52) из одной молекулы метана образуется одна молекула оксида углерода и две молекулы водорода, а по реакции (53) – также одна молекула оксида углерода, но три молекулы водорода. В отличие от реакции (52), в реакции (53) над стрелкой не поставлен индекс температуры, так как температуру в реакции поддерживает непосредственно один из компонентов – водяной пар.
5. ФИЗИКО-ХИМИЧЕСКИЙ МЕХАНИЗМ ЦЕПНЫХ РЕ-АКЦИЙ ГОРЕНИЯ
5.1. Предпосылки к разработке теории разветвленных цепных реакций горения, получение формальдегида при горении метана
Все приведенные выше уравнения следует рассматривать лишь как итоговые выражения совокупных процессов, по которым, например, можно рассчитать объемы кислорода и воздуха, расходуемые на горение, установить объемы образующихся продуктов сгорания и т.д.
Эти уравнения не отражают физико-химической сущности совокупного процесса, несравненно более сложного и обусловленного следующими факторами. Во-первых, реакции горения (17)–(19), протекающие по указанным уравнениям, являются трехмолекулярными. Здесь следует иметь в виду, что итоговые уравнения (17)–(18), соответственно, для оксида углерода и водорода записаны в формальной форме, как полуторамолекулярные, хотя являются трехмолекулярными. Это свойство требует соударения трех реагирующих молекул. Вероятность таких реакций ничтожно мала по сравнению с двухмолекулярными реакциями, осуществляемыми при реагировании лишь двух взаимодействующих частиц.
Во-вторых, указанные реакции протекают с огромным расходом энергии на разрыв связей между атомами и молекулами газов, т.е. на преодоление высокого энергетического барьера, поэтому механизм горения газов существенно отличается от уравнений, описывающих итоговый процесс. Причем, азот в реакциях горения не участвует, а является балластом, который вносится с воздухом, подаваемым на горение. В связи с этим, а также для упрощения анализа механизма горения в дальнейшем при описании физико-химических процессов, в отличие от итоговых, представлены реакции горения газов в кислороде.
Процесс горения метана намного сложнее реакции по уравнению (19) и может протекать в две стадии. На первой стадии его можно затормозить и получить муравьиный альдегид, более известный как формальдегид, который является сырьем для получения различных продуктов, например формалина, используемого для производства анатомических препаратов и дубления кожи:
СН4 + О2 НСОН + Н2О; (54)
НСОН + О2 СО2 + Н2О. (55)
Формальдегид – НСОН – имеет следующую структурную формулу:

(56)
Суммируя уравнения (54), (55), получим уравнение (57), которое полностью соответствует уравнению (19):
СН4 + 2О2 = СО2 + 2Н2О. (57)
Приведенные уравнения, промежуточным продуктом которых является формальдегид, – характерный пример более сложного механизма физико-химических реакций горения, чем их описание итоговыми уравнениями.
5.2. Физико-химический механизм цепной реакции горения водорода
Для осуществления процесса горения необходимо преодолеть высокий энергетический барьер. Это связано с тем, что в действительности реакции горения только начинаются с соударения молекул, в результате которых образуются атомарные газы и осколки молекул, например гидроксил (ОН) и метил (СН3). В дальнейшем процесс горения протекает при участии именно этих частиц. На образование из одной молекулы водорода двух атомов необходимо затратить 103 000 ккал (431 261 кДж), а расход энергии на диссоциацию 0,5 молекулы кислорода, необходимой для сжигания одной молекулы водорода по уравнению (18), составляет 59 000 ккал (247 033 кДж). Процессы диссоциации молекул описываются следующими реакциями:
Н2 2Н+ – 103 000 ккал (431 261 кДж); (58)
0,5О2 О – – 59 000 ккал (247 033 кДж). (59)
Сумма энергетических затрат при горении водорода на образование атомов водорода и кислорода составляет 162 000 ккал (678 294 кДж). При взаимодействии атомарного водорода с атомарным кислородом выделяется около 220 000 ккал (921 140 кДж). Реакция протекает следующим образом:
2Н + О Н2О + 220 000 ккал (921 140 кДж). (60)
Теплота сгорания молекулярного водорода составляет 58 000 ккал (242 846 кДж). Указанные значения теплоты являются составляющими теплового баланса горения молекулярного водорода. Свидетельством правильности его составления является то, что суммы приходных и расходных статей одинаковы: 162000 + 58 = = 220 000 ккал (921 140 кДж). Следовательно, теплота сгорания молекулярного водорода в молекулярном кислороде составляет
(58 000/220 000) 100 = 26,4 %.
Таким образом, чтобы выделить 26,4 % тепла, необходимо преодолеть энергетический барьер, равный 73,6 % реакций дис-социации молекулярных газов. Очевидно, что энергетический барьер преодолевается с большей легкостью при наличии в реагирующей системе атомарных газов и осколков молекул. Для понимания возможности преодоления энергетического барьера необходимо рассмотреть механизм цепных реакций, влияние активных молекул и осколков молекул, воздействие катализаторов.
Теория разветвленных цепных процессов разработана академиком Н.Н. Семеновым [13], доказавшим возможность реализации лавинообразного процесса образования активных осколков моле-кул – атомов водорода и кислорода, гидроксилов и метила при наличии в системе ограниченного количества атомарных газов. Так, атом водорода, взаимодействуя с молекулой кислорода, образует два активных осколка – атомарный кислород и гидроксил:
Н+ + О2 О – + ОН – . (61)
При взаимодействии образовавшегося атома кислорода с молекулой водорода образуется еще один гидроксил и атом водорода:
О– + Н2 ОН– + Н+. (62)
Таким образом, в системе появляются уже три активные частицы – два гидроксила и атом водорода. При взаимодействии гидроксила с молекулярным водородом образуются водяной пар и атомарный водород:
Н2 + ОН– Н2О + Н+. (63)
Реакция (63) повторяется дважды, так как гидроксил образуется как в реакции (61), так и в реакции (62). Суммируя реакции (61), (62) и дважды (63), получим:
Н+ + О2 + 3Н2 3Н+ + 2Н2О. (64)
Следовательно, число атомов водорода в результате цепной реакции на каждой стадии увеличивается в три раза, что подтверждает лавинообразность процесса горения. В данном случае число «3» является знаменателем геометрической прогрессии, характерной для горения водорода. Разветвленный цепной процесс горения водорода иллюстрируется схемой, представленной на рис. 1.
O–
+ H2
H+
ОН–
+ Н2
Н+
Н+
+ О2
Н2О
Н2О
ОН–
+ Н2
Н+







Рис. 1. Схема цепной реакции горения водорода
Проведенный анализ позволяет ответить на многие теоретические вопросы, на которые невозможно получить ответ, рассматривая итоговые уравнения. Так, в приведенной системе уравнений отсутствуют трехмолекулярные реакции, а в итоговых уравнениях реакций горения оксида углерода, водорода и метана (17)–(19) реакции горения являются трехмолекулярными. Ранее отмечалось, что вероятность синхронного соударения трех молекул ничтожно мала. Теория нобелевского лауреата Н.Н. Семенова дает однозначный ответ на этот вопрос, утверждая, что при горении трехмолекулярных реакций нет.
Вторая особенность цепных реакций заключается в том, что из двух реагирующих частиц одна является молекулой, а вторая активным центром; при горении водорода это его атом, или гидроксил. В соответствии с этим энергетический барьер, необходимый для преодоления, в каждом случае не превышает 18 000 ккал (75 366 кДж).
Таким образом, итоговые физико-химические реакции горения позволяют рассчитывать основные теплотехнические параметры процесса, но не объясняют его механизм. Эту задачу в полной мере решает теория цепных реакций горения топлива [4], [5], [13].
5.3. Горение метана
При горении метана по многим причинам требуется преодолеть еще больший энергетический барьер, чем при горении водорода, в частности из-за того, что крекинг метана с образованием молекулярного водорода и углерода – процесс эндотермический и требует, согласно закону Гесса, затрат около 18 000 ккал на молекулу метана:
СН4 С+ + 2Н2 – 18 000 ккал (75 366 кДж). (65)
Затем следует уже рассмотренный процесс диссоциации молекулярного водорода на атомы по уравнению (58), но для двух молекул. Тогда затраты на диссоциацию водорода составят 103 000 2 = = 206 000 ккал (862 522 кДж), а на очень сильный эндотермический процесс сублимации углерода с затратами на один атом – 169 000 ккал (707 603 кДж). Кроме того, согласно уравнению (19), для сгорания одной молекулы метана требуется подать на горение две молекулы кислорода, тогда как для водорода, по уравнению (18), только 0,5 молекулы, поэтому диссоциация кислорода протекает по уравнению (59), но для четырех молекул. Для ее реализации требуется преодолеть энергетический барьер в 236 000 ккал (988 132 кДж). Тогда суммарный энергетический барьер составит
Q = – (18 000 + 206 000 + 169 000 + 236 000) =
= – 629 000 ккал (– 263 3623 кДж).
Суммарная теплота сгорания одной молекулы метана составляет 821 000 ккал (3 437 527 кДж). Тогда располагаемая теплота сгорания метана составит 821 000 – 629 000 = 192 000 ккал (803 904 кДж). Эта величина равна 23,4 % от суммарной теплоты. Следовательно, чтобы выделить при сгорании метана в молекулярном кислороде только 23,4 % теплоты, необходимо преодолеть энергетический барьер, равный 76,6 % теплоты реакции взаимодействия атомов метана и кислорода.
При сгорании метана возможен следующий механизм процесса. При нагреве до высокой температуры происходит диссоциация молекул метана с образованием метильных радикалов СН3 и атомарного водорода:
СН4 СН3+ + Н+. (66)
Образование СН3 возможно с большей легкостью при наличии в реагирующей системе активных центров, например атомарного водорода или гидроксила. При наличии атомарного водорода протекает реакция (54), а при наличии гидроксила – реакция
СН4 + ОН– СН3+ + Н2О. (67)
Метильный радикал, взаимодействуя с кислородом, образует формальдегид и гидроксил:
СН3+ + О2 НСОН + ОН–. (68)
Формальдегид может разлагаться с образованием оксида углерода и атомарного водорода:
НСОН СО + 2 Н+. (69)
При сравнительно невысокой температуре, в так называемых «холодных пламенах» процесс горения можно локализовать и остановить с получением формальдегида в качестве товарного продукта для производства пластических масс и применения в других технологиях химической промышленности. При более высоких температурах формальдегид сгорает до диоксида углерода и водяных паров с конечным результатом по реакции (55). Подробный разбор возможных вариантов горения метана дан в монографии академика Н.В. Лаврова [5].
Наиболее распространенный вариант – полное сжигание для нагрева и термической обработки продукции. При этом варианте первой стадией горения, как и для водорода, является взаимодействие атомарного водорода молекулярного кислорода по реакции (61). Второй стадией процесса горения является реакция
СН4 + О – ОН – + СН3+. (70)
Третьей стадией процесса горения метана по этому варианту является реакция (67). Суммируя реакции (61), (67), (70), получим:
Н+ + О2 + 3СН4 2Н2О + 3СН3+. (71)
Сопоставление цепных реакций горения водорода (64) и метана (71) позволяет сделать следующие выводы: во-первых, как при сгорании водорода, так и при сгорании метана образуются две молекулы водяных паров и три активных центра; во-вторых, при сгорании водорода активным центром является водород, а при сгорании метана – осколок его молекулы метил; в-третьих, цепные реакции горения водорода и метана протекают по геометрической прогрессии со знаменателем, равным трем.
Главное отличие реакций горения водорода и метана состоит в том, что для водорода горение после реакции (64) продолжается по той же схеме с геометрической прогрессией, знаменатель которой равен трем. Конечные продукты физико-химических реакций горения водорода по физико-химическому составу качественно не изменяются. Для метана реакция (71) с образованием части водяного пара и метила является промежуточной, а сам метил является промежуточным продуктом общей реакции. Для метана на следующей стадии реакция протекает в так называемых «горячих пламенах» по уравнению (68) с утроением всех компонентов реакции, так как при реакции (71) образуются три метильных радикала. Следующей стадией процесса является реакция (54), которая также протекает с утроением всех ее компонентов, так как на предыдущей стадии образуются три молекулы формальдегида. Суммируя три указанные реакции, получим:
3СН3+ + 6О2 3Н2О + 3СО2 + 3ОН –. (72)
Суммируя реакции (71), (72), получим:
Н+ + 3СН4 + 7О2 5Н2О + 3СО2 + 3ОН –. (73)
Важно отметить, что введение в метановоздушную смесь атомарного водорода или гидроксила обуславливает резкое увеличение скорости горения. Установлено, что введение одного атома водорода в эту смесь позволяет увеличить скорость распространения пламени с 0,35 до 2,5 м/c. Влияние атомарного водорода на процесс горения газов хорошо иллюстрируется горением оксида углерода.
5.4. Горение оксида углерода (СО), особенности цепных реакций горения СО при наличии в реагирующей смеси влаги, активных центров и катализаторов
Оксид углерода (СО) не горит и не взрывается в абсолютно сухом воздухе, т.е. горения СО по уравнению (14) в этих условиях не происходит. Для осуществления реакции необходимо ввести в систему хотя бы небольшие дозы водорода или водяного пара. Тогда в неосушенном воздухе, содержащем влагу, которая превращается при горении в водяной пар, реакция (14) пойдет до конца. Ускоряющее действие водяных паров при горении оксида углерода является следствием реакции, легко протекающей при сравнительно невысоких температурах 500–800 С:
Н2О + СО СО2 + Н2.
В результате этой реакции одновременно с образованием диоксида углерода (СО2) появляется молекула водорода (Н2), которая при соударении с окислителем способна расщепляться до атомарного водорода, давая начало цепной реакции горения по схемам, представленным на рис. 2.
На рис. 2 представлены четыре варианта цепных реакций горения углерода. Первые стадии для всех вариантов полностью совпадают и соответствуют первой стадии горения атомарного водорода в молекулярном кислороде, представленной на рис. 1. В результате их реагирования образуются две активные отрицательно заряженные частицы: гидроксил (ОН–) и атомарный кислород (О–). Следующие стадии цепных реакций для всех вариантов отличаются.
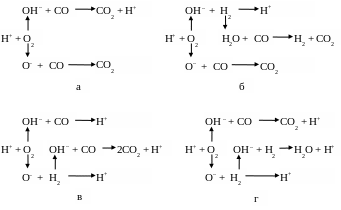
Рис. 2. Цепные реакции горения оксида углерода
Для первого варианта, представленного на рис. 2а, на следующих стадиях гидроксил и атомарный водород вступают в реакцию с двумя молекулами оксида углерода с образованием двух молекул диоксида углерода и одного атома водорода. Итоговая линейная цепная реакция горения оксида углерода по варианту рис. 2а имеет вид
Н+ + О2 + 2СО 2СО2 + Н+.
Для варианта рис. 2б:
Н+ + О2 + 2СО + Н2 2СО2 + Н2 + Н+.
Анализ результатов горения оксида углерода по первым двум вариантам показывает, что реализация приведенных цепных реакций возможна, но маловероятна, так как атомарный водород в результате реакции только восстанавливается. При этом нарушается принцип лавинообразного роста скорости реакций по геометрической прогрессии. Значительно более вероятный механизм горения представлен на схеме реакции по варианту рис. 2в. Итоговый результат этой цепной реакции описывается уравнением
Н+ + О2 + 2СО + Н2 2СО2 + 3Н+.
Н.Н. Семенов и Я.Б. Зельдович [13], [4] предложили следующий механизм горения оксида углерода:
Н+ + О2 ОН– + О–, О– + Н2 ОН– + Н+,
ОН– + СО СО2 + Н+, ОН– + Н2 Н2О + Н+. (74)
Суммируя реакции (74), получим:
Н+ + О2 + СО + 2Н2 СО2 + Н2О + 3Н+. (75)
Анализ результатов горения оксида углерода по схемам 2в,г и итоговым уравнениям показывает, что эти цепные реакции протекают лавинообразно по геометрической прогрессии со знаменателем «3», так как сопровождаются увеличением атомов водорода в три раза. Кроме того, в результате реакции по рис. 2в образуются две молекулы диоксида углерода, а по рис. 2г – одна молекула диоксида углерода и одна молекула водяных паров.
Д.И. Менделеев считал, что существование свободных атомов, т.е. образование атомарных газов в процессе горения, происходит следующим путем: при соединении Н2 и О2 сначала образуется Н2О2, а затем в результате экзотермического разложения перекиси водорода образуется водяной пар и атомарный кислород [7], [8]:
Н2О2 Н2О + О–. (76)
Атомарные кислород и водород также образуются в реагирующей смеси газа и воздуха. Их присутствие инициирует цепную реакцию, например, по схеме (74), которая усиливается при наличии в системе катализатора, например никеля:
2Ni + Н2 2NiН 2Ni + 2Н+. (77)
Каталитическое горение легче всего осуществить при сжигании водорода или газов с высоким содержанием молекулярного водорода, обладающего высокой реакционной способностью. У водорода при наличии катализаторов существенно повышается активность реагирования. Далее следуют углеводороды, содержащие в молекуле не менее двух атомов углерода. В этом аспекте природный газ имеет низкую реакционную способность, так как его основной составляющей, как показано выше, является метан, молекула которого содержит только один атом углерода. Помимо метана природный газ также содержит его гомологи и непредельные углеводороды, в которых содержание атомов углерода не менее двух. Это несколько облегчает организацию сжигания природного газа.
В заключение следует отметить, что при сжигании топлива в зоне горения находятся активные частицы. Это атомарные газы, гидроксил, метил и др. В исходной холодной смеси газа и воздуха они отсутствуют. Между тем их стимулирующая роль особенно велика в начальной стадии процесса для обеспечения начала цепной реакции и устойчивого зажигания.
Для активации смеси газа и воздуха имеются различные пути, например подогрев воздуха. Для этого создают зоны рециркуляции продуктов сгорания, обеспечивающие их поступление так, чтобы высокотемпературные продукты горения топлива, содержащие активные частицы, подмешивались к зажигаемой смеси газа и воздуха. При этом происходит ее первичный разогрев и активация. Ускорению начала реакции также способствует наличие в материале горелочных камней, образующих горелочные туннели, таких химических элементов, как никель, которые обладают каталитическими свойствами.
Итак, газогорелочные устройства конструируют таким образом, чтобы осуществить эффективную рециркуляцию продуктов горения, подмешивая их к зажигаемой смеси. Положительный эффект влияния катализаторов на процесс горения используют в каталитических нагревателях.
