
- •21. Механические и конформационные свойства мембран. Фазовые переходы.
- •Раздел 5. Транспорт веществ и биоэлектрогенез
- •22. Транспорт неэлектролитов через мембраны. Диффузия: движущая сила. Закон Фика. Понятие об облегчённой диффузии.
- •23. Транспорт ионов через мембрану. Механизмы и движущая сила пассивного транспорта. Уравнение электрохимического потенциала.
- •24. Энергия иона и причины её понижения при транспорте через биомембраны.
- •26. Электродиффузная теория транспорта ионов через мембрану. Уравнение Нерста-Планка для потока ионов через мембрану. Уравнение Гольдмана.
- •27. Индуцированный ионный тран-т через мембрану.Затраты энерг. По формуле Борна.
- •25. Электрические свойства биомембран и транспорт ионов. Понятие о двойном электрическом слое. Плотность распределения ионов в зависимости от расстояния. Электрокинетический потенциал мембраны.
- •29. Ионный транспорт в каналах. Понятие об энергетическом профиле канала. Уравнение силы тока, переносимого ионами.
- •30. Зависимость энергетического профиля ионного канала от заполнения канала, от биоэлектрических процессов. Селективность каналов.
- •31. Общие свойства ионных каналов нервных волокон. Na-канал, к-канал, их селективность.
- •32. Функционирование ионных каналов в зависимости от от внешнего электрического потенциала, понятие воротного устройства.
- •33. Активный транспорт ионов. Перенос ионов за счет энергии атф. Схема работы каналов.
- •34. Сопряжение ионообменных процессов с гидролитическим расщеплением молекулы атф. Конформационные переходы Na, k- атФазы.
- •35. Транспорт протонов в энергосберегающих мембранах. Образование градиента электрохимических потенциалов в биомембранах.
- •36. Потенциал покоя. Формула Нерста для мембранного потенциала. Уравнение Томаса.
- •37. Потенциал действия. Мембранный потенциал и изменение ионной проницаемости мембраны. Описание ионных токов в модели Ходжкина-Хаксли.
- •38. Образование воротных токов в мембранах нервных волокон. Распространение электрического импульса в нервных волокнах.
- •39.Фотопревращение бактериородопсина. Строение бактериородопсина, конформационные переходы молекулы при поглощении кванта света. Внутримолекулярный перенос протона.
- •40. Фотоизомеризация родопсина в фоторецептурной мембране зрительных клеток позвоночных. Проницаемость мембраны и светоиндуцированный электрический сигнал
- •Фоторегуляторные и фотодеструкционные процессы Фоторегуляторные реакции
- •41. Ультрафиолетовое излучение и фотодеструкционные процессы в днк: фотоизомеризация, фотогидротация, образование пиримидиновых аддукатов. Механизмы фотореактивации.
- •42.Действие ультрафиолетового излучения на белки, на биомембраны.
33. Активный транспорт ионов. Перенос ионов за счет энергии атф. Схема работы каналов.
Для Na+ оба пассивных потока – по градиенту концентрации и в направлении электрического поля – направлены внутрь клетки. Для поддержания низкой неравновесной концентрации Na+ в клетке существует механизм активного выведения в среду.
Активный транспорт обеспечивается переносом ионов против электрохимического градиента за счет энергии АТФ (рис. 5.12), так работают Na+ -насос плазматических мембран, Са2+- насос мембран саркоплазматического ретикулума. Или активный транспорт обеспечивается энергией окислительно-восстановительных реакций, так устроены Н+-насос митохондрий, хлоропластов и др. энергосопрягающих мембран.
Энергия, добытая из внешнего источника, запасается в виде «высоко энергетических связей» между фосфатными группами. АТФ весьма охотно отдает свои фосфатные группы либо воде, либо другим молекулам, поэтому он незаменимый посредник для переноса химической энергии.
Активный транспорт Na+ в нервных волокнах осуществляется Na+ , К+-АТФазой.
При гидролизе одной молекулы АТФ происходит транспорт двух К+ внутрь клетки и выделение 3 Na+ из клетки.
Транспорт против градиента электрохимических потенциалов происходит за счет сопряжения ионообменных процессов с гидролитическим расщеплением молекулы АТФ Mg2+ -зависимой Na+, К+ -стимулируемой АТФазой.
Na+, К+ -АТФаза-фермент состоит из двух полипептидных цепей с молекулярной массой 84000 и 5700, которые формируют большую и малую субединицы.
Схема работы натрий-калиевого насоса (рис. 5.13):
На внутренней стороне мембраны в присутствии Na+и Mg-АТФ происходит фосфорилирование белка. В результате конформация белка изменяется так, что Na+переходит на внешнюю сторону мембраны.
Изменяется сродство фермента к ионам и связывается К+.
К+ переносится вовнутрь, белок дефосфорилируется и возвращается к исходному конформационному состоянию.
За счет энергии гидролиза АТФ индуцируются конформационные переходы АТФазы.
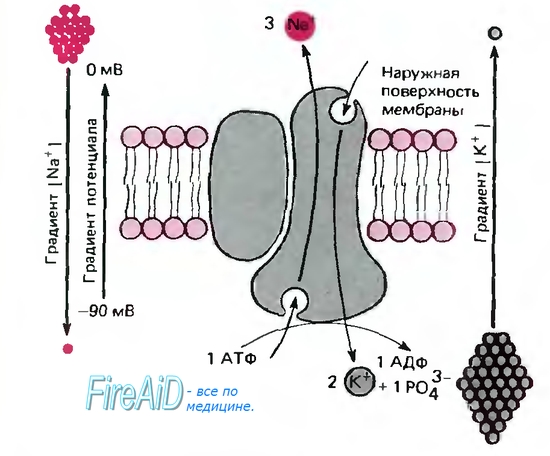
Рис. 5.13. Схема работы натрий-калиевого насоса
34. Сопряжение ионообменных процессов с гидролитическим расщеплением молекулы атф. Конформационные переходы Na, k- атФазы.
Гипотетическая схема обмена (рис. 5.14).
Ионообменная полость открывается с внутренней поверхности мембраны, внешний вход в канал закрыт гидрофобным контактом липидов и белков.
Гидролитический центр расположен на большой субъединице с внутренней стороны мембраны. α- полипептид пронизывает мембрану, а малая субъединица расположена на наружной стороне.
Ионообменные полости заполняются ионами из примембранных слоев, они вмещают три иона Na и два иона К.
Присоединение АТФ индуцирует конформационные изменения и сродство большой субъединицы к Na возрастает. Из-за близко расположенной фосфатной группы увеличивается отрицательный заряд полости.
Конформационные перестройки приводят к замыканию ионов Na в ионообменной полости большой субединицы. В результате сродство ее к Na понижается, а к К возрастает.
У субъединиц в результате тепловых флуктуаций могут совмещаться полости, в фосфорилированном состоянии обмен катионами энергетически выгоден.
Замена трех Na на два К в большой субъединице приводит к конформационным перестройкам. Уменьшение числа положительных зарядов сопровождается исчезновением большого активационного барьера, препятствующего дефосфорилированию фермента и отщеплению отрицательно заряженной фосфатной группы.
Полость большой субединицы открывается во внутриклеточную среду.
После диссоциации АДФ и фосфатного остатка фермент возвращается в исходное состояние.
Изменение сродства ион-связывающих центров обусловлено изменением геометрии (конформационные перестройки белка) при связывании АТФ, а также при фосфорилировании и дефосфорилировании фермента. Катионы, находясь в ион-связывающих полостях образуют координационные связи с кислородсодержащими группами полипептидных цепей. При перестройке анионного окружения катионов происходит замещение одного иона на другой.
Четыре атома О могут образовать Na+ -специфическую ячейку, а шесть атомов О - К+ -специфическую. Переход между этими состояниями, т.е. перегруппировка лигандов – основной энергозависимый процесс, а само перемещение субъединиц осуществляется уже за счет тепловых колебаний.
Активный транспорт кальция. Са -зависимая АТФаза, сопряженная с мощным Са -насосом, локализована в мембранах саркоплазматической сети и имеет некоторые сходные черты с Na , К+- АТФазой. Са -АТФаза состоит из одной полипептидной цепи с молекулярной массой около 100 000 и относительно высоким содержанием гидрофобных аминокислот (аминокислоты с неполярными боковыми цепями). Для работы Са2+-зависимой АТФазы также необходимо присутствие фосфолипидов.
Стадии транспорта при участии Са -зависимой АТФазы можно представить следующим образом:
Са2+ и АТФ связываются с разными центрами фермента на внешней поверхности мембранного пузырька.
АТФ гидролизуется и образуется фосфорилированный фермент.
Преобразуется пространственная структура белка (конформационная перестройка).
При этом изменяется сродство Са2+ - связывающих центров к Са2+ и изменяется характер связи фосфатной группы с ферментом. Т.о. энергия фосфатной связи АТФ расходуется на изменение константы связывания ионов с ферментом.
Из-за изменения пространственной структуры белка (происходит изменение положения полярных групп, образующих координационные связи с кальцием) Са2+ получает доступ во внутреннее пространство мембранных пузырьков. Энергии гидролиза АТФ (40кДж/моль) достаточно для переноса двух ионов кальция.
Десорбция иона кальция с фермента уменьшает суммарный положительный заряд в ион-связывающей полости, что облегчает десорбцию фосфата. Фермент возвращается в исходное состояние.
Электрогенный транспорт ионов.
Если количество зарядов, переносимых в одном направлении не компенсируется переносом зарядов в другом, то создается дополнительная разность потенциалов на мембране. Например в электрогенном режиме работает натриевый насос: три Na+ на два К+.
Во многих эпителиальных тканях обнаружена система активного электрогенного транспорта ионов Cl-. У растительных клеток мембранный потенциал выше, чем в клетках животных: в гифах грибов достигает -200 мВ, в клетках ряски - - 250-270 мВ. Считается, что высокий потенциал мембран поддерживается АТФ-зависимой системой активного электрогенного транспорта Н+ из цитоплазмы в наружную среду.
Предполагают также существование в плазмолемме цепи переноса электронов, функционирование которой сопряжено с поглощением Н+ из цитоплазмы и выделение в наружную среду.
Функциональная роль электрогенного Н+ -насоса растительной клетки состоит в регуляции рН цитоцлазмы. Кроме того, градиент рН, создаваемый на мембране способствует процессам накопления сахаров и аминокислот при сопряжении этих процессов с пассивным потоком Н+.
