
- •1.Предмет физическая химия. Общеприкладное значение физической и коллоидной химии.
- •2.Газообразное состояние. Газ как рабочее тело, его параметры состояния. Идеальный газ.
- •3.Газовые законы, их математическое и графическое выражение. Закон
- •4.Уравнение состояния идеального газа (уравнение Клапейрона - Менделеева). Универсальная газовая постоянная, её физический смысл, численное значение и размерность
- •5. Отклонения реальных газов от идеальных. Причины этих отклонений. Уравнение состояния реальных газов.
- •6. Критическое состояние. Коэффициент сжимаемости. Сжижение газов.
- •7. Газовые смеси, способы выражения состава смесей. Закон Дальтона. Правило аддитивности.
- •8. Общая характеристика жидкого состояния. Современные взгляды на структуру жидкостей. Ассоциация.
- •9.Вязкость. Ее физическая сущность, зависимость от различных факторов. Формула Ньютона. Роль вязкости в химической технологии .
- •10. Измерение вязкости жидкостей с помощью вискозиметра.
- •11. Поверхностное натяжение жидкостей. Поверхностно-активные и поверхностно-неактивные вещества, их практическое значение.
- •12. Измерение поверхностного натяжения жидкостей с помощью сталагмометра.
- •12. Процессы парообразования и испарения. Мольная теплота испарения
- •13. Твердое состояние. Тела кристаллические и аморфные. Общая характеристика кристаллического состояния.
- •15. Плазма: общая характеристика.
- •16. Предмет термодинамики, ее основные понятия и определения. Значение термодинамики в химико-технологических процессах.
- •Частные случаи первого закона термодинамики для изопроцессов
- •18 Аналитическое выражение первого закона термодинамики, в том числе для изобарных и изохорных процессов.
- •20. Теплоемкость: ее общая характеристика. Виды теплоемкости, их взаимосвязь, зависимость от различных факторов.
- •21. Работа расширения в термодинамических процессах. Связь работы расширения и первого закона термодинамики.
- •22. Термохимия. Тепловой эффект химической реакции. Изохорный и изобарный тепловой эффект. Взаимосвязь между ними.
- •23. Термохимические уравнения. Теплоты образования (разложения), сгорания. Закон Гесса и следствия из него. Значение закона Гесса
- •24. Определение теплоты растворения соли.
- •25. Недостаточность первого закона термодинамики. Качественная неэквивалентность теплоты и работы.
- •26. Содержание и формулировки второго закона термодинамики, его физическая сущность.
- •27. Основной термодинамический цикл - цикл Карно, его кпд
- •28. Энтропия: физический смысл, значение, характеристика.
- •29. Свободная энергия системы. Изобарно-изотермический и изохорно-изотермический потенциалы (энергии Гиббса и Гельмгольца). Пределы протекания самопроизвольных процессов в изолированных системах.
- •30. Характеристика влажного, сухого насыщенного и перегретого паров
- •31. Скорость химической реакции. Графическая зависимость скорости реакции от времени. Основной закон химической кинетики - закон действия масс.
- •Факторы, влияющие на скорость химических реакций.
- •1. Природа реагирующих веществ
- •32. Константа скорости реакции, ее физический смысл.
- •33. Факторы, влияющие на скорость реакции. Правило Вант-Гоффа.
- •34. Классификация реакций по молекулярности и порядку реакции. Период полураспада.
- •35. Вывести кинетическое уравнение реакции 1 порядка.
- •36. Энергия активации и её физический смысл (привести рисунок и пояснить).
- •37. Что такое активация? Методы активации молекул.
- •38. Уравнение Аррениуса и его практическое применение.
- •39. Цепные реакции, их особенности, характеристика.
- •40. Механизм цепной неразветвленной реакции.
- •41. Поверхностные явления и адсорбция. Количественная характеристика адсорбции, её виды.
- •42. Адсорбция на поверхности твердого тела. Изотерма адсорбции.
- •43. Уравнение Фрейндлиха и Ленгмюра.
- •44. Построение изотермы адсорбции по экспериментальным данным
- •45 Катализ и автокатализ. Положительный и отрицательный катализ.
- •46.Гомогенный и гетерогенный катализ. Специфичность каталитических реакций.
- •47. Химическое равновесие. Обратимые и необратимые реакции. Закон действующих масс.
- •48. Вывести константу равновесия Кс и Кр для гомогенной реакции. Константа равновесия реакций в гетерогенных системах
- •49. Сформулировать принцип Ле Шателье и пояснить его на конкретных примерах.
- •50. Химическое сродство. Уравнение изотермы химической реакции и его практическое применение для определения направления процесса.
- •51. Уравнение изохоры, изобары и его практическое применение для определения смещения равновесия при изменении внешних условий.
- •52. Фаза, компонент, число степеней свободы. Правило фаз Гиббса.
- •53. Термический анализ, построение диаграммы плавкости по кривым охлаждения
- •54. Привести диаграмму состояния воды и разобрать её с точки зрения правила фаз.
- •56. Гидратная теория растворов Менделеева
- •57. Осмос. Закон Вант-Гоффа для неэлектролитов и электролитов.
- •58. Равновесие в системе "раствор-пар". Первый закон Рауля.
- •59. Условия кипения и замерзания растворов. Второй закон Рауля.
- •60. Определение молекулярной массы вещества криоскопичечским методом
- •61. Взаимная растворимость жидкостей. Идеальные смеси. Закон Рауля-Дальтона. Диаграмма «Давление насыщенного пара – состав жидкости»
- •62. Первый закон Коновалова, его графическое изображение .Перегонка жидких смесей, подчиняющихся этому закону.
- •63. Второй закон Коновалова, его графическое изображение. Перегонка жидких смесей, подчиняющихся этому закону.
- •64. Что такое азеотроп и как его разделить.
- •65. Закон распределения. Экстракция из растворов /привести формулу и пояснить/.
- •66. Взаимные превращения электрической и химической энергий. Электрохимия, её прикладное значение.
- •67 Электрическая проводимость растворов. Измерение электропроводности растворов.
- •68. Удельная и эквивалентная электропроводности. Их взаимосвязь.
- •69. Электродные процессы. Скачок потенциала на границе металл - раствор. Электродный потенциал. Формула Нернста.
- •70. Электрохимический ряд напряжений. Эдс и принцип работы гальванического элемента
- •71. Водородный электрод.
- •72. Определение эдс элемента компенсационным методом
- •74. Методы получения коллоидных растворов
- •75. Строение коллоидных мицелл.
- •76. Устойчивость коллоидных растворов. Коагуляция.
- •77. Оптические свойства коллоидных растворов.
- •78. Кинетические и электрокинетические свойства коллоидных растворов.
- •79. Эмульсии. Получение эмульсий, их типы. Обращение фаз эмульсий. Деэмульгирование.
- •80 Пены, аэрозоли.
- •81 Общая характеристика растворов вмс. Определение молекулярной массы вмс.
1.Предмет физическая химия. Общеприкладное значение физической и коллоидной химии.
Физи́ческая хи́мия — изучает вещества и закономерность связанное с их превращениями на основе физических законов.
Основные разделы: Учение о строении вещества- учение о строении атомов и молекул и учение об агрегатных состояниях вещества.
Химическая термодинамика - изучает связь между изменением теплоты и др. видов энергии, происходящих при химических реакциях, с одной стороны и направление реакции с другой.
Учение о растворах рассматривает процессы образования растворов, их внутреннюю структуру и важнейшие свойства, зависимость структуры и свойств от природы компонентов раствора.
Электрохимия изучает особенности свойств растворов электролитов, явления электропроводности, электролиза, коррозии, работу гальванических элементов.
Химическая кинетика. В этом разделе физической химии изучается скорость и механизм протекания химических процессов в различных средах при различных условиях.
Коллоидная химия изучает поверхностные явления и свойства мелкодисперсных гетерогенных систем.
История возникновения физической химии как научной дисциплины (середине 18 века) Михаил Васильевич Ломоносов (1711-1765)
2.Газообразное состояние. Газ как рабочее тело, его параметры состояния. Идеальный газ.
Рабочее тело- тело, совершающее круговой процесс и обменивающееся.
Термин идеальный газ ввел немец. физик Р. Клаузис ( сер. 19 в)
Идеальный газ-это система состоящия из материальных точек, ед. форма взаимодействия которых явл. прямое столкновение.
З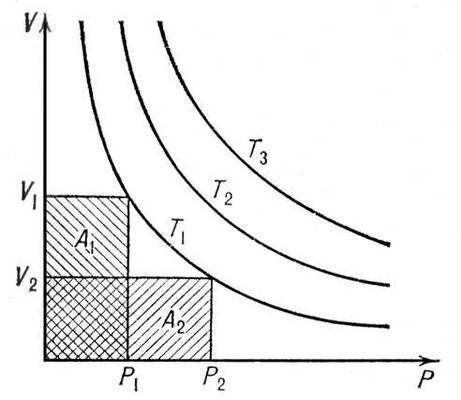 акон
Бо́йля —
Марио́тта (1661,1676
) при Т=const,
PV=K
.
акон
Бо́йля —
Марио́тта (1661,1676
) при Т=const,
PV=K
.
Для одной и той же массы газа при постоянной температуре произведение давления на оббьем явл. величиной постоянной Р. Р1V1 = Р2V2 (изотерма)
Закон Гей-Люссака (1802), при Р= const, V=KT.
Д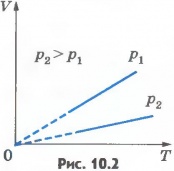 ля
одной и той же массы газа при постоянном
давлении, объем прямо пропорционально
температуре.K=V/T,
ля
одной и той же массы газа при постоянном
давлении, объем прямо пропорционально
температуре.K=V/T,
![]() (изобара)
(изобара)
Закон Шарля( 1787) при V= const, P=TK
Д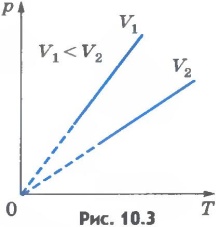 ля
одной и той же массы газа при постоянном
объеме давления прямо пропорционально
температуре.( изохора)
ля
одной и той же массы газа при постоянном
объеме давления прямо пропорционально
температуре.( изохора)
Закон А.Авогадро ( 1811). При одинаковом давлении и одинак. температ. одинаковые объемы разных газов содержит одинаковое число молекул.
Следствие: В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm
Уравнение состояния идеального газа (Менделеева — Клапейрона) РV= nRT ,
R= 8,314-универсал. газ. постоянная.
Привести газ к норм. услов.(н.у.) это значит определить объем V0 который будет занимать данное кол-во газа при Р0 и Т0. Р0 V0 / Т0 = Р1 V1/ Т1.
3.Газовые законы, их математическое и графическое выражение. Закон
Б о́йля — Марио́тта (1661,1676 ) при Т=const, PV=K .
Для одной и той же массы газа при постоянной температуре произведение давления на оббьем явл. величиной постоянной Р. Р1V1 = Р2V2 (изотерма)
Закон Гей-Люссака (1802), при Р= const, V=KT.
Д ля одной и той же массы газа при постоянном давлении, объем прямо пропорционально температуре.K=V/T, (изобара)
Закон Шарля( 1787) при V= const, P=TK
Д ля одной и той же массы газа при постоянном объеме давления прямо пропорционально температуре.( изохора)
Закон А.Авогадро ( 1811). При одинаковом давлении и одинак. температ. одинаковые объемы разных газов содержит одинаковое число молекул.
Следствие: В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm
Уравнение состояния идеального газа (Менделеева — Клапейрона) РV= nRT ,
R= 8,314-универсал. газ. постоянная.
Привести газ к норм. услов.(н.у.) это значит определить объем V0 который будет занимать данное кол-во газа при Р0 и Т0. Р0 V0 / Т0 = Р1 V1/ Т1.
