
- •Лабораторная работа № 1 получение дисперсных систем.
- •2.1. Химическая конденсация
- •2.2 Физическая конденсация
- •2.3. Пептизация
- •Лабораторная работа № 2 определение размера частиц коллоидных систем, подчиняющихся уравнению рэлея, турбидиметрическим методом.
- •2.1. Порядок выполнения работы
- •Лабораторная работа №3. Определение размера частиц дисперсных систем, не подчиняющихся уравнению рэлея, тубидиметрическим методом
- •2.1. Определение среднего радиуса частиц по характеристической мутности
- •2.2. Определение среднего радиуса частиц по зависимости мутности от длины волны
- •Лабораторная работа № 4 седиментационный анализ дисперсных систем.
- •Графический метод построения кривых распределения
- •2.Экспериментальная часть
- •2.1. Порядок выполнения работы
- •2.2. Обработка данных седиментационного анализа
- •Лабораторная работа № 5 определение размера частиц концентрированных суспензий.
- •Содержание.
- •117571 Москва, пр. Вернадского 86.
Введение.
Для объектов коллоидной химии характерны два общих признака: гетерогенность и дисперсность. Все особые свойства, характерные для объектов коллоидной химии, являются функциями или следствием гетерогенности и дисперсности.
Гетерогенность или многофазность, выступает в коллоидной химии как признак, указывающий на наличие межфазной поверхности, т.е. поверхностного слоя основного объекта этой науки. Именно этот признак, определяющий наличие поверхностей раздела, обуславливает характерные свойства объектов коллоидной химии.
Дисперсность (раздробленность) второй признак объектов коллоидной химии. Она определяется размерами и геометрией тела. Размеры частиц в коллоидных системах лежат в интервале от 10-9 до 10-7м. Дисперсность придает новые свойства не только отдельным элементам дисперсной системы, но и всей дисперсной системе. С ростом дисперсности повышается роль поверхностных явлений в системе, т.к. увеличивается удельная поверхность. Однако если гетерогенность является универсальным признаком, т.к. объектом коллоидной химии в принципе может быть любая многофазная система, то одна только дисперсность без гетерогенности не может определить принадлежность конкретного объекта к коллоидной химии.
Сопоставляя два основных признака объектов коллоидной химии, необходимо отметить, что дисперсность является чисто количественным параметром, характеризующим степень раздробленности, размер межфазной поверхности; гетерогенность же в первую очередь указывает на качественную характеристику объектов, что более важно при установлении отличительных особенностей объектов той или иной науки.
Объекты коллоидной химии можно охарактеризовать и определенным видом энергии, которым они обладают, исходя из тех же основных признаков. Гетерогенность количественно определяется поверхностным натяжением величиной, характеризующей энергию единицы поверхности и являющейся фактором интенсивности. Поверхностное натяжение определяет как бы степень гетерогенности, резкость перехода от одной фазы к другой, различие между соприкасающимися фазами. Чем сильнее выражена гетерогенность и чем более резко различаются по природе сопряженные фазы, тем больше поверхностное натяжение. Второй признак дисперсность определяется величиной поверхности (фактор емкости). Произведение поверхностного натяжения на величину поверхности S равно поверхностной энергии Гиббса:
![]() (1)
(1)
Таким образом, объекты коллоидной химии обладают поверхностной энергией.
В настоящем пособии будут рассматриваться методы получения лиофобных систем и методы определения размеров фазовых частиц, основанные на изучении их оптических и молекулярнокинетических свойств.
Лабораторная работа № 1 получение дисперсных систем.
Цель работы
Получение гидрозолей различными методами; наблюдение их опалесценции и определения знака заряда частиц.
1. Теоретическая часть.
Поскольку дисперсные системы занимают промежуточное положение между макроскопическими гетерогенными системами и молекулярными растворами - гомогенными системами, известны два способа получения дисперсных систем: диспергированием (измельчением) макроскопических фаз (диспергационный путь образования) и конденсацией из истинных растворов (конденсационное образование).
Диспергационные методы широко используются для получения микрогетерогенных и грубодисперсных систем суспензий, эмульсий, порошков. Хрупкие материалы предпочитают измельчать ударом, вязкие истиранием. К диспергирующим устройствам относятся шаровые и стержневые мельницы, вальцы, краскотерки, коллоидные мельницы. При сухом помоле обычно получают частицы размером 60 мкм. Коллоидные мельницы обеспечивают возможность получения суспензий с размерами частиц не более 1 мкм. Высокой дисперсности можно также достичь ультразвуковым диспергированием. К диспергационным методам относится и метод физико-химического дробления осадков (пептизация).
Пептизацией (физикохимическим дроблением осадков) называют расщепление на первичные частицы под действием внешней среды агрегатов, возникающих в результате обратимой коагуляции дисперсных систем. Существуют три способа перевода осадка в коллоидный раствор.
Адсорбционная конденсация. В этом случае отталкивание частиц друг от друга вызывается ДЭС, образующимся на поверхности частиц при адсорбции ионов добавляемого электролитастабилизатора.
Пептизация путем поверхностной диссоциации. Связана с образованием ДЭС методом поверхностной модификации. Пептизатор здесь способствует процессу диссоциации с поверхности, вызывая образование растворимых соединений на поверхности частиц.
Пептизация путем промывания осадка. Применяется в том случае, когда на поверхности частиц в осадке есть двойные электрические слои, но они сжаты вследствие большой концентрации электролита. При промывании такого осадка водой концентрация электролита в нем уменьшается, двойные слои увеличивают свою толщину; силы электростатического отталкивания между частицами будут действовать на более далеких расстояниях и вызовут коллоидное растворение осадка.
Пептизация протекает с определенной скоростью, которая как правило, возрастает с повышением температуры. Пептизация имеет большое значение в технике при изготовлении суспензий глин, цементов, в препаративной коллоидной химии при получении золей. Однако в ряде производств пептизация может играть и отрицательную роль, так, например, при извлечении сахара возможна нежелательная пептизация пектина и других веществ, содержащихся в растительных тканях.
Конденсационные методы, как указывалось выше, позволяют получать дисперсные системы из гомогенных сред. Конденсация – это образование устойчивой свободнодисперсной системы в результате ассоциации молекул, атомов или йонов в агрегате. В основе конденсационных методов лежат два процесса: 1) возникновение зародышей, являющихся минимальным скоплением новой фазы и находящихся в равновесии с окружающей средой, и 2) рост зародышей, приводящий к образованию частиц дисперсной фазы. Размер критического зародыша:
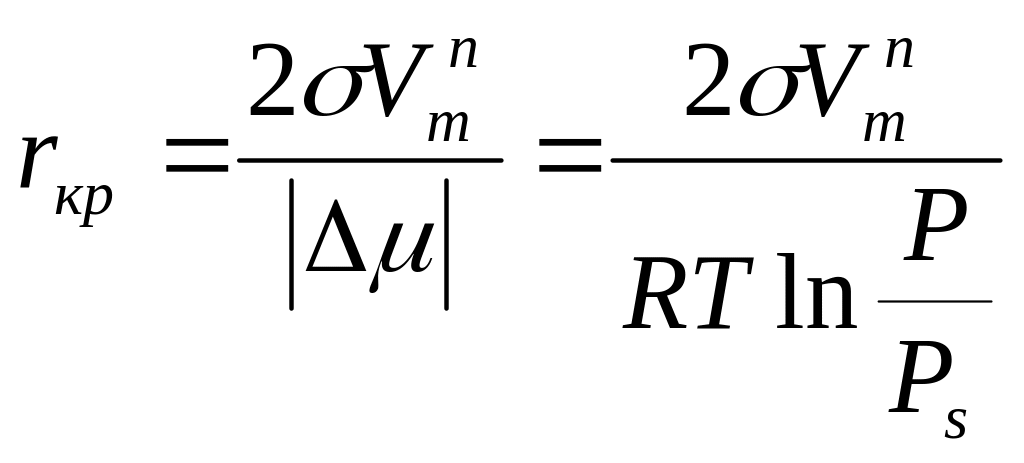
где
![]() -молярный
объем новой фазы,
-молярный
объем новой фазы,
![]() разность
химических потенциалов
разность
химических потенциалов
р/рs – степень пересыщения
Процесс образования коллоидных частиц представляет собой не что иное, как переход метастабильной фазы в стабильную, сопровождающийся уменьшением свободной энергии системы. Этот процесс самопроизвольный за исключением стадии образования зародышей, поскольку эта стадия сопровождается увеличением свободной поверхностной энергии вследствие образования новой поверхности. После того как зародыши, образующиеся в системе, достигнут определенного размера переход совершается самопроизвольно.
Известны два механизма образования зародышей:
гомогенный, при котором новая фаза зарождается в однородной старой фазе. Образование зародышей при этом обьясняется местным повышением концентраций в результате теплового движения молекул (флуктуации концентраций). Для самопроизвольного возникновения новой фазы в этом случае необходимо заметное пересыщение.
![]()
гетерогенный, при котором зарождение происходит в местах неоднородной фазы. Центрами конденсации в этом случае могут быть какие-либо поверхности (например, стенки сосудов или посторонние включения), избирательно смачиваемые новой фазой в присутствии старой. Термодинамические расчеты, проведенные Юж. У. Гиббсом и М. Фольмером, показывают, что работа, затраченная на образование равновесного зародыша по гетерогенному механизму, меньше, чем по гомогенному, что связано с наличием готовых центров конденсации при гетерогенном образовании. Этот вывод подтверждается экспериментально.
Скорость роста зародышей определяется разностью действующей концентрации вещества в растворе и его равновесной концентрацией при той же температуре. Чем больше разность, тем быстрее растут зародыши. Для того, чтобы получить системы высокой дисперсности нужно, чтобы скорость возникновения зародышей была большой, а скорость их роста маленькой.
Появление новой фазы происходит при пересыщении среды. Факторы, приводящие к появлению пересыщения (метастабильности) исходной системы можно разделить на две группы: физические и химические. Физические методы это изменение давления или температуры, например, прямая конденсация, а также замена растворителя.
Конденсация паров. Сущность метода заключается в том, что в газообразной системе при изменении температуры давление пара может стать выше равновесного давления пара над жидкостью или твердым телом и в газовой фазе возникает новая жидкая или твердая фаза. Система становится гетерогенной, образуются аэрозоли (туман, дым).
Замена растворителя. Метод основан на изменении состава среды таким образом, что химический потенциал компонента в дисперсной среде становится выше равновесного и тенденция к переходу в равновесное состояние приводит к образованию новой фазы.
Так может быть получен золь канифоли. Если насыщенный раствор канифоли в этиловом спирте влить в большой объем воды, то полученный раствор в спиртоводной среде оказывается пересыщенным. Пересыщение приводит к агрегированию частиц канифоли, система становится гетерогенной, образуется коллоидная система золь канифоли.
Таким путем могут быть получены гидрозоли серы, фосфора, мышьяка и многих органических веществ.
Химические методы создания пересыщения черезвычайно разнообразны. Любая реакция, приводящая к образованию нерастворимого, а в случае конденсированных фаз и летучего продукта (или, наоборот, нелетучего при взаимодействии газов), может использоваться для получения коллоидной системы. К образованию золей приводят различные химические реакции: окисления-восстановления, обмена, гидролиза и др. Эти реакции рассматриваются ниже.
Реакция обмена. С помощью реакции обмена можно получить различные золи. Этим способом получают золи галогенидов, сульфидов оксидов и гидроксидов металлов. Характерным примером синтеза золей с использованием реакции обмена является получение гидрозолей серебра. Эти золи часто служат моделями при изучении различных коллоидных процессов.
AgNO3 + K Ag + KNO3.
Реакции восстановления. Эти реакции лежат в основе многочисленных методов получения золей золота и серебра при взаимодействии солей этих металлов с различными восстановителями: фосфором (Фарадей), таннином (Оствальд), формальдегидом (Зигмонди), ацетоном (Девис), например:
2KauO2 + 3HCHO + K2CO3 2Au +
+ 3HCOOK + RHCO3 + H2O.
Реакции окисления. Они широко распространены в природе. Примером таких процессов является образование золя при взаимодействии сероводорода, растворенного в гидротермальных водах, с кислородом
2H2S + O2 2S + 2H2O.
Гидролиз солей. Процессы гидролиза солей широко распространены в природе и имеют важное значение в технике. Эти процессы применяются для очистки сточных вод. Высокая удельная поверхность образующихся при гидролизе коллоидных гидроксидов позволяет эффективно адсорбировать примеси. Примером является реакция гидролиза хлорного железа.
F
1000C
Строение мицелл различных золей.
Мицелла это отдельная частица дисперсной фазы коллоидной системы с жидкой дисперсионной средой, состоящая из кристаллического или аморфного ядра и поверхностного слоя, включающего сольватно связанные молекулы окружающей жидкости.
Рассмотрим образование мицеллы на примере реакции хлорида бария с сульфатом натрия
Na2SO4 + BaCI2 BaSO4 + 2NaCI.
И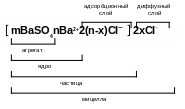 збыток
одного из компонентов действует как
стабилизатор лиозоля.
збыток
одного из компонентов действует как
стабилизатор лиозоля.
Пусть в избытке находится BaCI2.
Схематическое
строение мицеллы выглядит так:
CI-
CI-
CI-
CI-
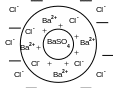
На поверхности кристалла BaSO4 имеются вакантные места, которые занимают ионы Ba2+. Вследствие избирательной ионной адсорбции эти ионы достраивают кристаллическую решетку. Они придают положительный заряд поверхности ядра и называются потенциалопределяющими иона-ми (ПО ионами). Ионы CI-, образовавшиеся при диссоциации BaCI2, имеют заряд, противоположный заряду поверхности и называются противоионами. Под действием электростатических сил противоионы притягиваются к ядру, нейтрализуя его заряд.
П
+
Типы потенциалопределяющих ионов
Потенциалопределяющим ионом может быть любой ион, способный достраивать кристаллическую решетку нерастворимого соединения. Различают три типа потенциалопределяющих ионов:
и
mFePO4nPO43-3(n-x)Na+ 3xNa+ ;
оны, одноименные с ионами агрегатаизоморфные ионы (т.е. ионы, имеющие близкое строение по отношению к ионам кристаллической решетки)
mAgnCI-(n-x)K+
xK+
(иону
изоморфны
ионы галоидов CI-,
Br-);
органические ионы большого размера, обладающие высокой адсорбционной способностью, например, соли жирных кислот, являющиеся стабилизаторами латексов:
mПnRCOO-(n-x)Na+
xNa+
Принципы построения мицелл
Агрегат мицеллы должен быть нерастворимым соединением.
Потенциалопределяющими ионами могут быть ионы, образующие дисперсную фазу, изоморфные им ионы и органические ионы с высокой адсорбционной способностью.
Противоионы образуют с потенциалопределяющим ионом растворимое соединение.
Мицелла в целом электронейтральна.
2.Экспериментальная часть.
Оборудование и реактивы:
Конические колбы; химический стакан
Бюретки
Пипетки
Кювета с плоско параллельными стенками
Проекционный фонарь для наблюдения конуса Тиндаля
Прибор для определения знака заряда коллоидных частиц гидрозоля
Исходные растворы для получения коллоидных систем
Перед проведением работы студенту необходимо выяснить у преподавателя, какие именно золи он будет получать.
