
- •Мкт.Понятия и определения.
- •Основные допущения мкт
- •Закон Бойля-Мариотта. Законы Гей-Люсакка
- •5. Уравнение Клапейрона. Уравнение Менделеева-Клапейрона.
- •6. Основное уравнение мкт идеальных газов
- •7.Закон максвелла о распределении скоростей идеального газа по скоростям
- •8.Закон максвелла о распределении молекул идеального газа по энергии теплового движения
- •11.Среднее число столкновений и средняя длина свободного пробега молекул
- •12. Основы термодинамики. Внутренняя энергия. Число степеней свободы.
- •17. Адиабатический процесс. Уравнения адиабатического процесса.
- •18 Политропные процессы
- •21 Энтропия и термодинамическая вероятность. Формула больцмана
- •24. Цикл Карно. Реальные газы. Энергия взаимодействия между молекулами.
- •25. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса: теоретические и экспериментальные. Диаграмма состояний.
24. Цикл Карно. Реальные газы. Энергия взаимодействия между молекулами.
Цикл Карно.
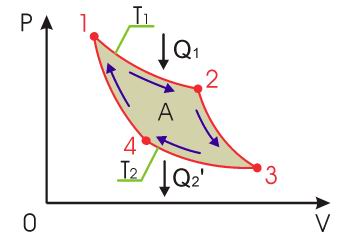
При первом изотермическом процессе 1-2 происходит передача рабочему телу теплоты Q1, причем эта теплота передается бесконечно медленно, при практически нулевой разнице температуры между нагревателем и рабочим телом. Далее рабочее тело подвергается адиабатическому расширению без теплообмена с окружающей средой (процесс 2-3). При последующем изотермическом процессе 3-4 холодильник забирает у рабочего тела теплоту Q2. Процесс 4-1 представляет собой адиабатическое сжатие, переводящее рабочее тело в первоначальное состояние.
1-2 – изотермическое расширение
2-3 – адиабатическое расширение
3-4 – изотермическое сжатие
4-1 – адиабатическое сжатие
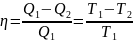
Отсюда видно, что КПД цикла Карно с идеальным газом зависит только от температуры награвателя (T1) и холодильника (Т2).
Из уравнения следуют выводы:
1. Для повышения КПД тепловой машины нужно увеличить температуру нагревателя и уменьшить температуру холодильника;
2. КПД тепловой машины всегда меньше 1.
Цикл Карно обратим, так как все его составные части являются равновесными процессами.
Термодинамическая шкала температур.
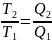
Для сравнения температур необходимо осуществить обратный цикл Карно
Реальные газы.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
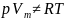
Реальные газы описываются уравнением состояния идеального газа только приближенно, и отклонения от идеального поведения становятся заметными при высоких давлениях и низких температурах, особенно когда газ близок к конденсации. Реальные газы могут быть переведены в жидкое и даже в твёрдое состояние, а идеальные — не могут.
Энергия взаимодействия между молекулами.
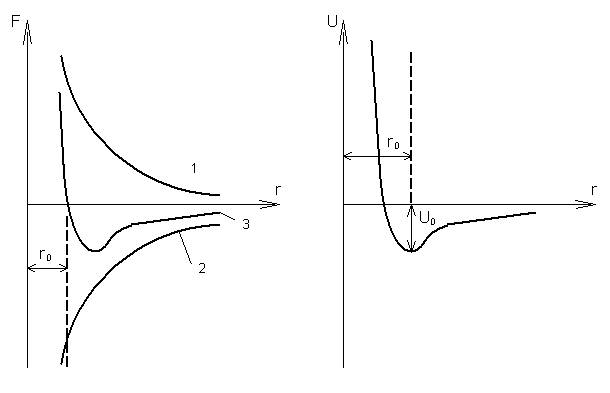
r0 – расстояние, при котором молекулы при отсутствии теплового движения находились в состоянии равновесия.
На малых расстояниях (r<r0) молекулы отталкиваются, на больших – притягиваются.
25. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса: теоретические и экспериментальные. Диаграмма состояний.
Уравнение Ван-дер-Ваальса.
Уравнение Ван-дер-Ваальса учитывает конечные размеры всех молекул (учет собственного объема молекул), что существенно при больших давлениях, а так же взаимодействие (притяжение) молекул.
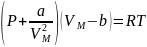
a, b – постоянные Ван-дер-Ваальса
Изотермы Ван-дер-Ваальса.
Теоретические изотермы
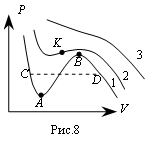
Экспериментальные
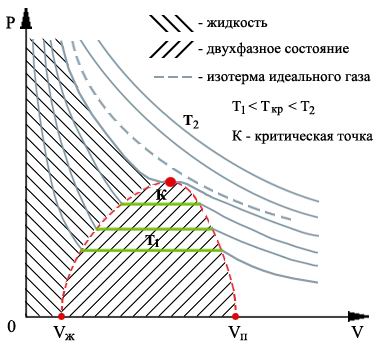
Если газ сжимать, то он переходит в двухфазные состояния.
Диаграмма состояний.
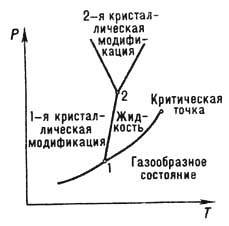
Границами соприкасающихся фаз являются кривые сублимации, испарения и плавления, характеризующие двухфазные равновесные состояния. В точке 1 три фары находятся в равновесии (тройная точка)
