
- •Мкт.Понятия и определения.
- •Основные допущения мкт
- •Закон Бойля-Мариотта. Законы Гей-Люсакка
- •5. Уравнение Клапейрона. Уравнение Менделеева-Клапейрона.
- •6. Основное уравнение мкт идеальных газов
- •7.Закон максвелла о распределении скоростей идеального газа по скоростям
- •8.Закон максвелла о распределении молекул идеального газа по энергии теплового движения
- •11.Среднее число столкновений и средняя длина свободного пробега молекул
- •12. Основы термодинамики. Внутренняя энергия. Число степеней свободы.
- •17. Адиабатический процесс. Уравнения адиабатического процесса.
- •18 Политропные процессы
- •21 Энтропия и термодинамическая вероятность. Формула больцмана
- •24. Цикл Карно. Реальные газы. Энергия взаимодействия между молекулами.
- •25. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса: теоретические и экспериментальные. Диаграмма состояний.
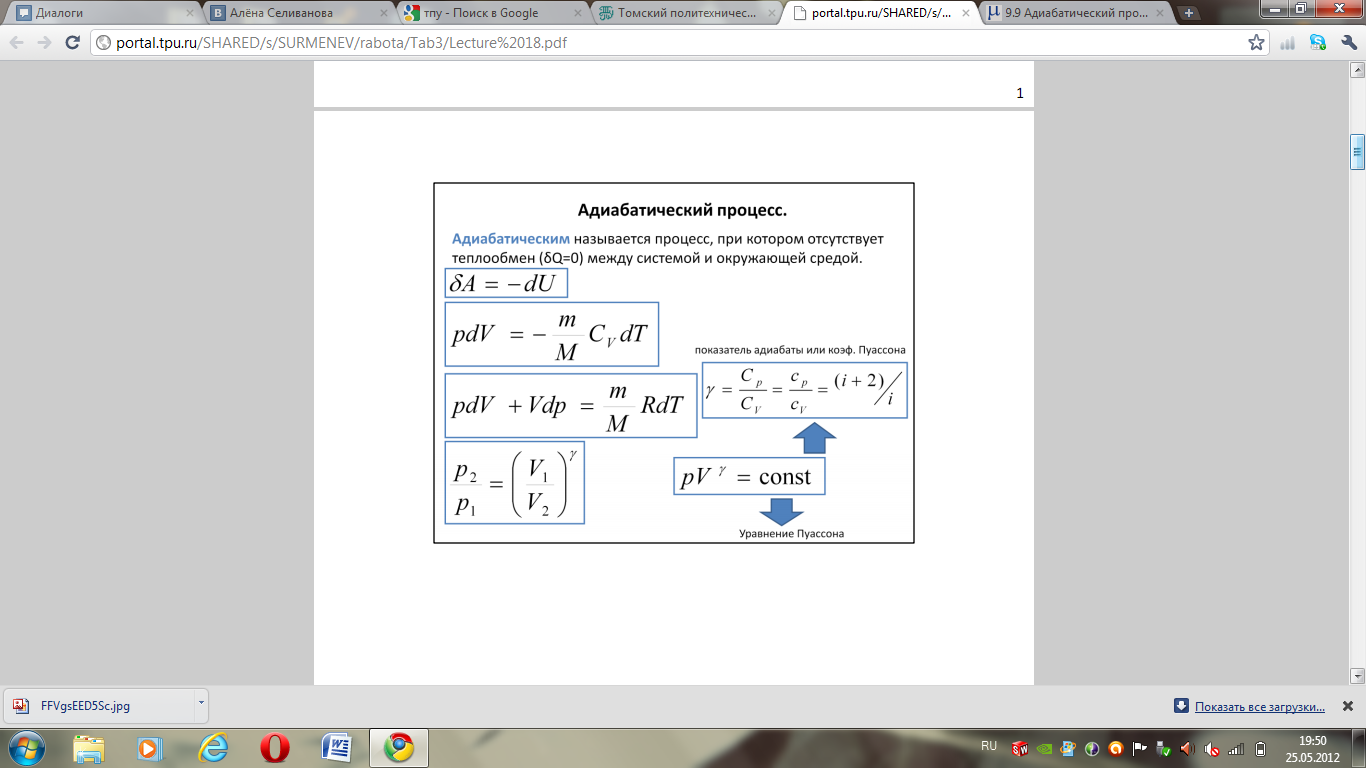
17. Адиабатический процесс. Уравнения адиабатического процесса.
Адиабатическим называется процесс, при котором отсутствует теплообмен между системой и окр. средой.

18 Политропные процессы
До сих пор рассматривались процессы, у которых имелись вполне определенные признаки: изохорный процесс осуществлялся при постоянном объеме; изобарный — при постоянном давлении; изотермический — при постоянной температуре; адиабатный— при отсутствии теплообмена между рабочим телом и внешней средой. Наряду с этими процессами можно представить еще бесконечное множество процессов, у которых имеются другие постоянные признаки.
Условились всякий процесс идеального газа, в котором удельная теплоемкость является постоянной величиной, называть политропным процессом, а линию процесса — политропой.
Из определения политропного процесса следует, что основные термодинамические процессы — изохорный, изобарный, изотермический и адиабатный,— если они протекают при постоянной удельной теплоемкости, являются частными случаями политропного процесса. Итак, политропный процесс проходит при постоянной теплоемкости.
Если теплоемкость зависит от температуры, то нужно найти среднюю теплоемкость, чтобы процесс стал политропным.
(Не знаю как тут все сократить )=((
Уравнение процесса
Для исследования процесса и расчета слагаемых I закона термодинамики нужно установить связь между параметрами состояния в политропном процессе. Эта функция называется уравнением политропы. Запишем уравнение I закона термодинамики, преобразуем
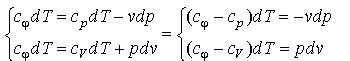
и поделим почленно
![]()
Так
как ![]() = const в
процессе, то левая часть
= const в
процессе, то левая часть ![]() = const и
называется показатель политропы:
= const и
называется показатель политропы:
n =
, ![]()
При этом, каждому значению n соответствует некоторый конкретный процесс.
Получили дифференциальное уравнение:
n=![]()
Разделяем переменные
![]()
и интегрируем в пределах процесса
![]()
Потенцируем
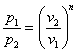 или
или ![]()
Это выражение выполняется не только для крайних точек процесса, но и для всех промежуточных. Оно называется уравнением политропы:
![]()
Запишем это уравнение через другие параметры P-T и V-T:
![]()
![]()
![]()
![]()
![]()
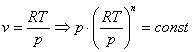
![]()
![]()
![]()
19
20 Неравенство Клаузиуса:Количество теплоты, полученное системой при любом круговом процессе, делённое на абсолютную температуру, при которой оно было получено (приведённое количество теплоты), не положительно.
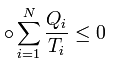
Подведённое количество теплоты, квазистатически полученное системой, не зависит от пути перехода (определяется лишь начальным и конечным состояниями системы) - для квазистатических процессов неравенство Клаузиуса обращается в равенство.
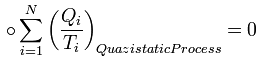
Энтропи́я (от др.-греч. ἐντροπία - поворот, превращение) — в естественных науках мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния; в теории информации — мера неопределённости какого-либо опыта (испытания), который может иметь разные исходы, а значит, и количество информации; в исторической науке, для экспликации феномена альтернативности истории (инвариантности и вариативности исторического процесса).
Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
![]()
где
![]() —
приращение энтропии;
—
приращение энтропии;![]() — минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса;
— минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса;
