
- •Мкт.Понятия и определения.
- •Основные допущения мкт
- •Закон Бойля-Мариотта. Законы Гей-Люсакка
- •5. Уравнение Клапейрона. Уравнение Менделеева-Клапейрона.
- •6. Основное уравнение мкт идеальных газов
- •7.Закон максвелла о распределении скоростей идеального газа по скоростям
- •8.Закон максвелла о распределении молекул идеального газа по энергии теплового движения
- •11.Среднее число столкновений и средняя длина свободного пробега молекул
- •12. Основы термодинамики. Внутренняя энергия. Число степеней свободы.
- •17. Адиабатический процесс. Уравнения адиабатического процесса.
- •18 Политропные процессы
- •21 Энтропия и термодинамическая вероятность. Формула больцмана
- •24. Цикл Карно. Реальные газы. Энергия взаимодействия между молекулами.
- •25. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса: теоретические и экспериментальные. Диаграмма состояний.
12. Основы термодинамики. Внутренняя энергия. Число степеней свободы.
Важной характеристикой термодинамической системы является ее внутренняя энергия U — энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т. д.) и энергия взаимодействия этих частиц. Из этого определения следует, что к внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
Внутренняя энергия — однозначная функция термодинамического состояния системы, т.е. в каждом состоянии система обладает вполне определенной внутренней энергией (она не зависит от того, как система пришла в данное состояние). Это означает, что при переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода.
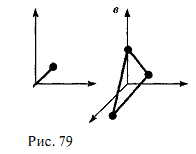
В § 1 было введено понятие числа степеней свободы: это число независимых величин, полностью определяющих положение системы в пространстве. В ряде задач молекулу одноатомного газа (рис. 79, а) рассматривают как материальную точку, которой приписывают три степени свободы поступательного движения. При этом энергию вращательного движения можно не учитывать
![]()
В классической механике молекула двухатомного газа в первом приближении рассматривается как совокупность двух материальных точек, жестко связанных недеформируемой связью (рис.79, б). Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Вращение вокруг третьей оси (оси, проходящей через оба атома) лишено смысла. Таким образом, двухатомный газ обладает пятью степенями свободы (i = 5).
Трехатомная (рис. 79, в) и многоатомная нелинейные молекулы имеют шесть степеней свободы: три поступательных и три вращательных. Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения.
Независимо от общего
числа степеней свободы молекул три
степени свободы всегда поступательные.
Ни одна из поступательных степеней
свободы не имеет преимущества перед
другими, поэтому на каждую из них
приходится в среднем одинаковая энергия,
равная l/3 значения (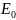 )
в (43.8):
)
в (43.8):
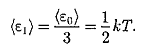
В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная — кТ, а на каждую колебательную степень свободы — в среднем энергия, равная кТ.
Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы
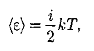
где i — сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы:
![]()
В классической теории рассматривают молекулы с жесткой связью между атомами; для них I совпадает с числом степеней свободы молекулы.
Следует отметить, что закон Больцмана является приближенным (получен на основе классических представлений о характере движения молекул) и пересмотрен в квантовой статистике.
Так как в идеальном
газе взаимная потенциальная энергия
молекул равна нулю (молекулы между собой
не взаимодействуют), то внутренняя
энергия, отнесенная к 1 моль газа, будет
равна сумме кинетических энергий
 молекул:
молекул:
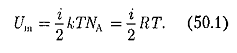
Внутренняя энергия для произвольной массы газа
![]()
где М — молярная масса;
v =
 — количество вещества.
— количество вещества.
13. Основы термодинамики в 12-ом вопросе.
Работа при изменении объема газа
Адиабатный процесс
График адиабатного процесса
Работа при изобарном расширении газа. Одним из основных термодинамических процессов, совершающихся в большинстве тепловых машин, является процесс расширения газа с совершением работы. Легко определить работу, совершаемую при изобарном расширении газа.
Если при изобарном расширении газа от объема V1 до объема V2 происходит перемещение поршня в цилиндре на расстояние l (рис. 106), то работа A', совершенная газом, равна
где p — давление газа, — изменение его объема.
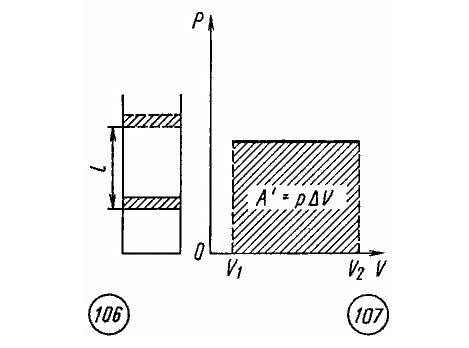
Как видно из рисунка 107, при изображении изобарного процесса расширения газа в координатных осях p , V площадь фигуры, ограниченной графиком процесса, кординатами V1 и V2, осью абсцисс, пропорциональна работе газа A'.
Работа при произвольном процессе расширения газа. Произвольный процесс расширения газа от объема V1 до объема V2 можно представить как совокупность чередующихся изобарных и изохорных процессов.
При изохорных процессах работа равна нулю, так как поршень в цилиндре не перемещается. Работа при изобарных процессах пропорциональна площади фигуры на диаграмме p, V под соответствующим участком изобары (рис. 108).
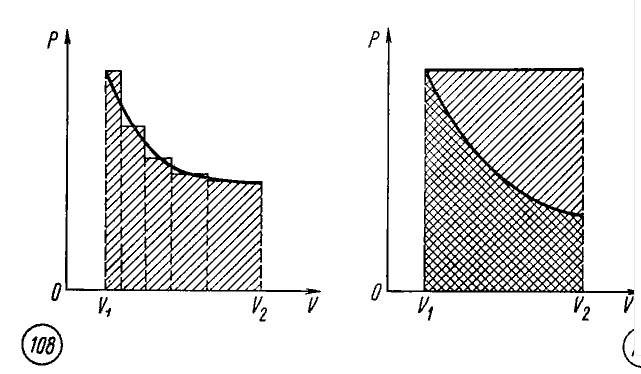
Следовательно, работа при произвольном процессе расширения газа прямо пропорциональна площади фигуры под соответствующим участком графика процесса на диаграмме p, V.
Работа при изотермическом расширении газа. Сравнивая площади фигур под участками изотермы и изобары (рис. 109), можно сделать вывод, что расширение газа от объема V1 до объема V2 при одинаковом начальном значении давления газа сопровождается в случае изобарного расширения совершением большей работы.
Работа при сжатии газа. При расширении газа направление вектора силы давления газа совпадает с направлением вектора перемещения, поэтому работа A', совершенная газом, положительна (A' > 0), а работа А внешних сил отрицательна: A = -A' < 0.
При сжатии газа направление вектора внешней силы совпадает с направлением перемещения, поэтому работа А внешних сил положительна (A > 0), а работа A', совершенная газом, отрицательна (A' < 0).
Адиабатный процесс. Кроме изобарного, изохорного и изотермического процессов, в термодинамике часто рассматриваются адиабатные процессы.
Адиабатным процессом называется процесс, происходящий в термодинамической системе при отсутствии теплообмена с окружающими телами, т. е. при условии Q = 0.
Отсутствие теплообмена с окружающей средой может быть обеспечено хорошей теплоизоляцией газа. Быстрые процессы расширения или сжатия газа могут быть близкими к адиабатному и при отсутствии теплоизоляции, если время, за которое происходит изменение объема газа, значительно меньше времени, необходимого для установления теплового равновесия газа с окружающими телами.
Примерами адиабатных процессов могут служить процессы сжатия воздуха в цилиндре воздушного огнива, в цилиндре двигателя внутреннего сгорания. В соответствии с первым законом термодинамики, при адиабатном сжатии изменение внутренней энергии газа равно работе внешних сил А:
Так как работа внешних сил при сжатии положительна, внутренняя энергия газа при адиабатном сжатии увеличивается, его температура повышается.
При адиабатном расширении газ совершает работу A' за счет уменьшения своей внутренней энергии:
поэтому температура газа при адиабатном расширении понижается. Это можно обнаружить в следующем опыте. Если в бутылку, содержащую насыщенный водяной пар, накачивать с помощью насоса воздух, то пробка вылетает (рис. 110).
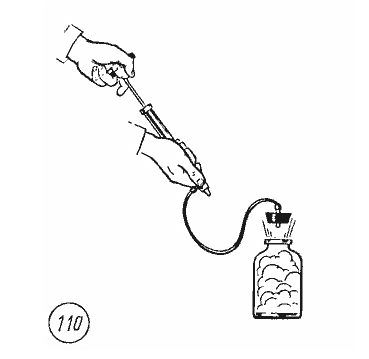
Работа A' по выталкиванию пробки совершается воздухом за счет уменьшения его внутренней энергии, так как расширение воздуха происходит за очень короткое время и теплообмен с окружающей средой не успевает произойти. Образование капель тумана доказывает, что при адиабатном расширении воздуха его температура понизилась и опустилась ниже точки росы.
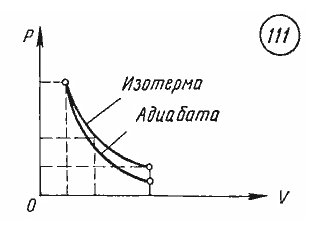
График адиабатного процесса. Поскольку при адиабатном сжатии температура газа повышается, то давление газа с уменьшением объема растет быстрее, чем при изотермическом процессе. Понижение температуры газа при адиабатном расширении приводит к тому, что давление газа убывает быстрее, чем при изотермическом расширении.
График адиабатного процесса в координатных осях p, V представлен на рисунке 111. На том же рисунке для сравнения приведен график изотермического процесса.
14. Теплоёмкость тела (обозначается C) — физическая величина, определяющая отношение бесконечно малого количества теплоты ΔQ, полученного телом, к соответствующему приращению его температуры ΔT:
Единица измерения теплоёмкости в системе СИ — Дж/К.
Удельная теплоёмкость вещества — теплоёмкость единицы массы данного вещества. Единицы измерения — Дж/(кг К).
Молярная теплоёмкость вещества — теплоёмкость 1 моля данного вещества. Единицы измерения — Дж/(моль К).
Если же говорить про теплоёмкость произвольной системы, то ее уместно формулировать в терминах термодинамических потенциалов — теплоёмкость есть отношение малого приращения количества теплоты Q к малому изменению температуры T:
Понятие теплоёмкости определено как для веществ в различных агрегатных состояниях (твёрдых тел, жидкостей, газов), так и для ансамблей частиц и квазичастиц (в физике металлов, например, говорят о теплоёмкости электронного газа). Если речь идёт не о каком-либо теле, а о некотором веществе как таковом, то различают удельную теплоёмкость — теплоёмкость единицы массы этого вещества и молярную — теплоёмкость одного моля его.
Для примера, в молекулярно-кинетической теории газов показывается, что молярная теплоёмкость идеального газа с i степенями свободы при постоянном объеме равна:
R = 8.31 Дж/(моль К) — универсальная газовая постоянная.
А при постоянном давлении
Удельные теплоёмкости многих веществ приведены в справочниках обычно для процесса при постоянном давлении. К примеру, удельная теплоемкость жидкой воды при нормальных условиях — 4200 Дж/(кг К). Льда — 2100 Дж/(кг К)
Существует несколько теорий теплоёмкости твердого тела:
Закон Дюлонга-Пти и закон Джоуля-Коппа. Оба закона выведены из классических представлений и с определенной точностью справедливы лишь для нормальных температур (примерно от 15°C до 100°C).
Квантовая теория теплоёмкостей Эйнштейна. Первая весьма удачная попытка применения квантовых законов к описанию теплоемкости.
Квантовая теория теплоёмкостей Дебая. Содержит наиболее полное описание и хорошо согласуется с экспериментом.
Теплоёмкость системы невзаимодействующих частиц (например, газа) определяется числом степеней свободы частиц.
Среди равновесных процессов, которые происходят с термодинамическими системами, отдельно рассматриваются изопроцессы, при которых один из основных параметров состояния остается постоянным.
Применение первого начала термодинамики к изопроцессам.
Среди равновесных процессов, которые происходят с термодинамическими системами, отдельно рассматриваются изопроцессы, при которых один из основных параметров состояния остается постоянным.
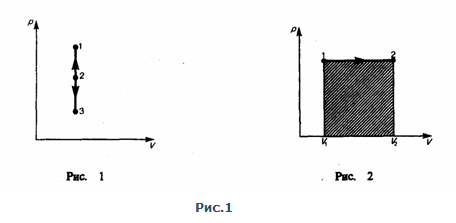
Изохорный процесс (V=const). Диаграмма этого процесса (изохора) в координатах р, V изображается прямой, параллельной оси ординат (рис. 1), где процесс 1—2 есть изохорное нагревание, а 1—3 — изохорное охлаждение. При изохорном процессе газ не совершает работы над внешними телами, т. е.
![]()
Из первого начала термодинамики (δQ=dU+δA) для изохорного процесса следует, что вся теплота, которая сообщается газу, идет на увеличение его внутренней энергии:
![]()
т.к. CV=dUm/dt,
![]()
Тогда для произвольной массы газа получим
![]()
Изобарный процесс (p=const). Диаграмма этого процесса (изобара) в координатах р, V изображается прямой, которая параллельна оси V. При изобарном процессе работа газа при увеличения объема от V1 до V2 равна
![]()
и равна площади заштрихованного прямоугольника (рис. 2). Если использовать уравнение Менделеева-Клапейрона для выбранных нами двух состояний, то
![]()
Откуда
![]()
Тогда выражение (2) для работы изобарного расширения примет вид
![]()
Из этого выражения вытекает физический смысл молярной газовой постоянной R: если T2 —T1 = 1К, то для 1 моль газа R=A, т. е. R численно равна работе изобарного расширения 1 моль идеального газа при нагревании его на 1 К.
В изобарном процессе при сообщении газу массой m количества теплоты
![]()
его внутренняя энергия возрастает на величину (т.к. CV=dUm/dt)
![]()
При этом газ совершит работу, определяемую выражением (3).
Изотермический процесс (T=const). Изотермический процесс описывается законом Бойля—Мариотта:
![]()
Диаграмма этого процесса (изотерма) в координатах р, V представляет собой гиперболу, которая расположена на диаграмме тем выше, чем выше температура, при которой происходит процесс. Исходя из формул для работы газа и уравнения Менделеева-Клайперона найдем работу изотермического расширения газа:
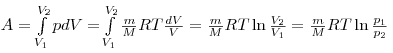
Так как при Т=const внутренняя энергия идеального газа не изменяется:
![]()
то из первого начала термодинамики (δQ=dU+δA) следует, что для изотермического процесса
![]()
т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:
![]()
Значит, для того чтобы при расширении газа температура не становилась меньше, к газу в течение изотермического процесса необходимо подводить количество теплоты, равное внешней работе расширения.
15. Применение первого начала термодинамики к изопроцессам: Изобарный процесс (р=const).
изобарный процесс — термодинамический процесс, происходящий в системе при постоянном давлении и постоянной массе идеального газа.
Согласно закону Гей-Люссака, при изобарном процессе в идеальном газе .
Работа, совершаемая газом при расширении или сжатии газа, равна .
Количество теплоты, получаемое или отдаваемое газом, характеризуется изменением энтальпии: .
16. Применение первого начала термодинамики к изопроцессам Изотермический процесс (Т=соnst).
Изотермический процесс — термодинамический процесс, происходящий в физической системе при постоянной температуре.
Для осуществления изотермического процесса систему обычно помещают в термостат (массивное тело, находящееся в тепловом равновесии), теплопроводность которого велика, так что теплообмен с системой происходит достаточно быстро по сравнению со скоростью протекания процесса, и, температура системы в любой момент практически не отличается от температуры термостата. Можно осуществить изотермический процесс иначе — с применением источников или стоков тепла, контролируя постоянство температуры с помощью термометров. К изотермическим процессам относятся, например, кипение жидкости или плавление твёрдого тела при постоянном давлении. Графиком изотермического процесса является изотерма.
В идеальном
газе при изотермическом процессе
произведение давления на объём постоянно
(закон
Бойля-Мариотта). Изотермы идеального
газа в координатах ![]() —
гиперболы, расположенные на графике
тем выше, чем выше температура, при
которой происходит процесс
—
гиперболы, расположенные на графике
тем выше, чем выше температура, при
которой происходит процесс
При изотермическом процессе системе, сообщается определённое количество теплоты (или она отдаёт теплоту) и совершается внешняя работа.
Работа,
совершенная идеальным газом в
изотермическом процессе, равна ![]() ,
где
,
где ![]() —
число частиц газа,
—
число частиц газа, ![]() —
температура,
—
температура, ![]() и
и ![]() —
объём газа в начале и конце
процесса,
—
объём газа в начале и конце
процесса, ![]() — постоянная
Больцмана .
— постоянная
Больцмана .
В твёрдом теле и большинстве жидкостей изотермические процессы очень мало изменяют объём тела, если только не происходит фазовый переход.
Первый закон термодинамики для изотермического процесса записывается в виде:
![]()
![]()
