
- •Мкт.Понятия и определения.
- •Основные допущения мкт
- •Закон Бойля-Мариотта. Законы Гей-Люсакка
- •5. Уравнение Клапейрона. Уравнение Менделеева-Клапейрона.
- •6. Основное уравнение мкт идеальных газов
- •7.Закон максвелла о распределении скоростей идеального газа по скоростям
- •8.Закон максвелла о распределении молекул идеального газа по энергии теплового движения
- •11.Среднее число столкновений и средняя длина свободного пробега молекул
- •12. Основы термодинамики. Внутренняя энергия. Число степеней свободы.
- •17. Адиабатический процесс. Уравнения адиабатического процесса.
- •18 Политропные процессы
- •21 Энтропия и термодинамическая вероятность. Формула больцмана
- •24. Цикл Карно. Реальные газы. Энергия взаимодействия между молекулами.
- •25. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса: теоретические и экспериментальные. Диаграмма состояний.
Мкт.Понятия и определения.
Термодинамика- раздел физики изучающий общие свойства макроскопических систем находящихся в состоянии термодинамического равновесия и процессы перехода между этими состояниями.
Термодинамическая система состоит из тел, обменивающихся энергией.
Чтобы описать термод. Систему существуют след. Характеристики:
P
V
T – основные ( если спросит какие еще то это энтальпия S и U внут.энергия)
Температура- физическая величина которая характеризует состояние термодинамического равновесия макроскопической системы.
ШКАЛЫ
Термодинамическая шкала Международная практическая шкала
Един.из=К(Кельвин) С (цельсий)
В Америке температура измеряется по Фаренгейту.
Реперные точки- 0С и 100С ( соответственно замерзания и кипения)
Н.У(норм.условия)
НОРМАЛЬНЫЕ УСЛОВИЯ - физические условия, определяемые давлением p = 101325 Па и температурой 273,15 К при которых объем 1 моля идеального газа V0 = 22.4 л\моль
Основные допущения мкт
Собственный объем молекул газа пренебрижимо мал по сравнению с объемом сосуда.
Между молекулами газа отсутствуют силы взаимодействия
Столкновения молекул газа между собой и стенками сосуда абсолютно упругие
______________________________________________(если все эти 3 пункта выполняются то газ идеальный)
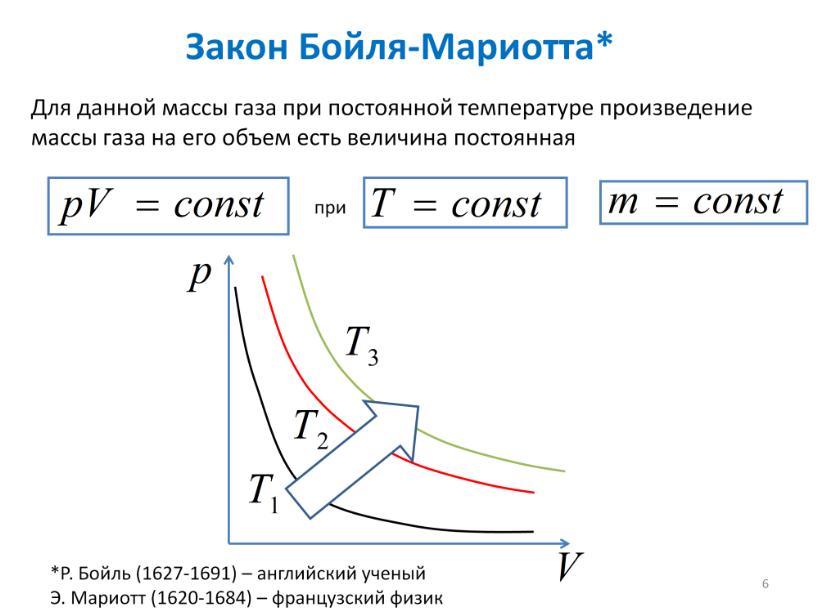
Закон Бойля-Мариотта. Законы Гей-Люсакка
Закон Бойля-Мариотта
Закон Гея-Люсакка

3
Изобарный процесс—термодинамический процесс, происходящий в системе при постоянном давлении и постоянной массе идеального газа.
Согласно закону
Гей-Люссака,
при изобарном процессе в идеальном
газе ![]() .Работа,
совершаемая газом при расширении или
сжатии газа, равна
.Работа,
совершаемая газом при расширении или
сжатии газа, равна ![]() .Количество
теплоты, получаемое или отдаваемое
газом, характеризуется изменением
энтальпии:
.Количество
теплоты, получаемое или отдаваемое
газом, характеризуется изменением
энтальпии: ![]() .
.
Изохорный процесс (от др.-греч. ἴσος «равный» и χώρος «место») —термодинамический процесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма.
При
изохорическом процессе давление идеального
газа прямо
пропорционально еготемпературе (см. Закон
Шарля).
В реальных газах закон Шарля не
выполняется. Из определения работы следует,
что изменение работы при изохорном
процессе равно:![]() Чтобы
определить полную
работу процесса проинтегрируем
данное выражение. Поскольку объем
неизменен, то:
Чтобы
определить полную
работу процесса проинтегрируем
данное выражение. Поскольку объем
неизменен, то:![]() ,Но
такой интеграл равен
нулю. Итак, при
изохорном процессе газ работы не
совершает:
,Но
такой интеграл равен
нулю. Итак, при
изохорном процессе газ работы не
совершает:![]() .
.
4
Закон Авогадро
Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём.
В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощьюуравнения Менделеева-Клапейрона:
![]() .
.
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.
Закон Дальтона
Закон о суммарном давлении смеси газов
Давление смеси химически не
взаимодействующих идеальных
газов равно
сумме парциальных
давлений.![]()
Закон о растворимости компонентов газовой смеси
При постоянной температуре растворимость в
данной жидкости каждого из компонентов
газовой смеси, находящейся над жидкостью,
пропорциональна их парциальному
давлению.![]()
Пределы применимости
Оба закона Дальтона строго выполняются для идеальных газов. Для реальных газов эти законы применимы при условии, если их растворимость невелика, а поведение близко к поведению идеального газа.
Парциальное давление
Парциальное давление газа измеряется как термодинамическая активность молекул газа. Газы всегда будут вытекать из области с высоким парциальным давлением в область с более низким давлением; и чем больше разница, тем быстрее будет поток. Газы растворяются, диффундируют и реагируют соответственно их парциальному давлению и не обязательно зависимы от концентрации в газовой смеси.
Законы Дальтона парциального давления
Парциальное давление идеального газа в смеси равно давлению, которое будет оказываться, если он занимает тот же объём при той же температуре. Причина этого в том, что молекулы идеального газа настолько далеки одна от другой, что не взаимодействуют друг с другом. Реально существующие газы очень близко подходят к этому идеалу. Следствием этого является то, что общее давление смеси идеальных газов равно сумме парциальных давлений каждого газа в смеси, как это формулирует закон Дальтона.[2] Например, дана смесь идеального газа из азота (N2), водорода (H2) и аммиака (NH3):
![]() ,
где:
,
где:
![]() =
общему давлению в газовой смеси
=
общему давлению в газовой смеси
![]() =
парциальному давлению азота (N2)
=
парциальному давлению азота (N2)
![]() =
парциальному давлению водорода (H2)
=
парциальному давлению водорода (H2)
![]() =
парциальному давлению аммиака (NH3)
=
парциальному давлению аммиака (NH3)
