
Определение алюминия в сплавах, минералах, в горных породах
химическими и физико-химическими методами.
Аналитические реакции, используемые в качественном анализе для открытия Al (III)
а). Реакция со щелочами:
А13+ + 3 ОН- -► А1(ОН)3 (белый)
А1(ОН)3 + 3 ОН- -> [А1(ОН)6]3-
После растворения гидроксида алюминия и образования гидроксокомплексов алюминия к раствору прибавляют несколько кристаллов соли аммония (NH4C1). Смесь нагревают. Гидроксокомплексы разрушаются выпадает осадок А1(ОН)3:
[А1(ОН)6]3- + 3 NH4+ -> А1(ОН)3 + 3 NH3 + 3 Н2О
Наиболее полное осаждение гидроксида алюминия происходит при рН- 5-6. Осадок А1(ОН)3 растворяется в кислотах, но не растворяется в аммиаке.
б). Реакция с аммиаком.
А13+ + 3 NHrH2O -> А1(ОН)31 (белый аморфный) + 3 NH4+
в). Реакция с нитратом кобальта - образование -тенаровой сини- (фармакопейная).
-Тенаровая синь- - смешанный оксид алюминия и кобальта синего цвета.
A12(SO4)3 + 2 Co(NO3)2 —tT-> 2 Со(А1О2)2 + 4 NO2 + 6 SO3 + O2.
г). Реакция с алюминоном
Катионы А13+ при взаимодействии с алюминоном – аммонийной солью ауринтрикарбоновой кислоты (для кратности NH4L) образуют в уксуснокислой или аммиачной среде комплекс красного цвета (по-видимому, состав A1(ОН)2 L. Точное строение комплекса неизвестно. Выпадает красный хлопьевидный осадок. Мешают катионы Са2+, Cr3+, Fe3+
д) Реакция с ализарином (1,2 - диоксиантрахинон).
Катионы А13+ с ализарином и его производными в аммиачной среде образует комплексы ярко красного цвета называемые -алюминиевыми лаками-.
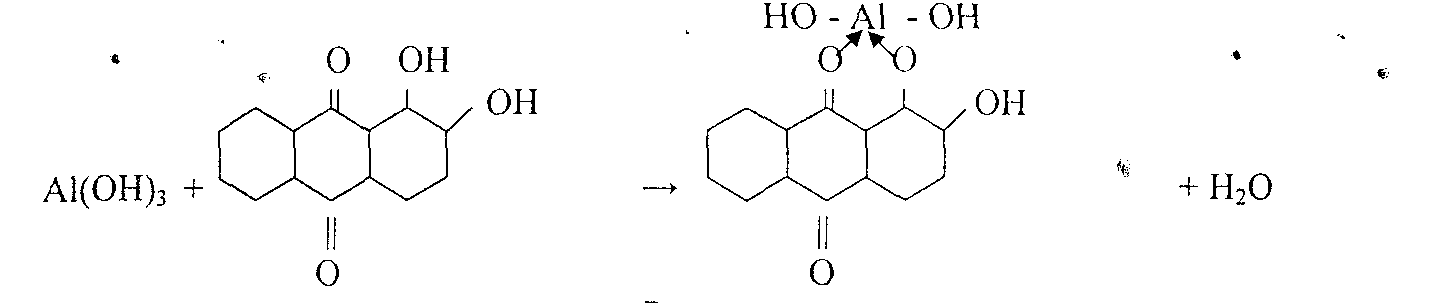
Комплекс устойчив в уксусной среде. Реакция высокочувствительна: предел обнаружения 0,5 мкг. Мешают катионы: Zn2+, Sn(II), Cr3+, Mn2+, Fe3+ и др.
Ализарин - C14H6O2(OH)2, образует с Al(OH)3 внутрикомплексную соль красного цвета (алюминиевый лак).
Выполнение реакции: взять кусочек фильтровальной бумаги и нанести на него пипеткой 1 каплю раствора соли алюминия. Подержать бумагу в течение 1-2 мин. над открытой склянкой с концентрированным (25%) раствором NH3. На бумаге образуется Al(OH)3. В центр влажного пятна нанести каплю ализарина и еще 1-2 мин. подержать фильтровальную бумагу над склянкой с концентрированным раствором NH3. Подсушить фильтровальную бумагу над пламенем газовой горелки. При этом исчезает фиолетовая окраска ализарина, а красное пятно алюминиевого лака остается.
ж) Другие реакции катиона алюминия А13+.
Катионы А13+ образуют также осадки при реакциях в растворах: с Na2HPO4 - белый А13РО4, с CH3COONa- белый СН3СООА1(ОН)2, с оксихинолином (кратко Нох) - желто-зеленый [А1(О)3] и др.
Гравиметрические методы определения Al (III)
Гравиметрический анализ основан на определении массы вещества. В ходе гравиметрического анализа определяемое вещество или отгоняется в виде какого-либо летучего соединения (метод отгонки), или осаждается из раствора в виде малорастворимого соединения (метод осаждения).
Одним из наиболее точных методов определения алюминия является осаждение бензоатом. При этом образуется основной бензоат алюминия. Осадок легко фильтруется и промывается. Для полного осаждения алюминия необходимо поддерживать рН не ниже 3,5. Одним из часто используемых гравиметрических методов определения алюминия является осаждение его в виде гидроксида с последующим прокаливанием осадка до оксида. Добавление подходящего основания (NH3,S2O32-, и т.п.) смещают равновесие в растворах солей алюминия в сторону выделения гидроксида:
[Al(H2O)6]3+ + H2O = [Al(OH)(H2O)5]2+ + H2O
[Al(OH)(H2O)5]2+ + H2O = [Al(OH)2(H2O)4]+ + H2O
[Al(OH)2(H2O)4]+ + H2O = [Al(OH)3(H3O)3]+ + H2O
При осаждении гидроксида алюминия нужно иметь в виду его амфотерность и вести осаждение при контролируемом значении рН. Осадок Al(OH)3, а вернее, Al2O3*nH2O теряет воду и становится негигроскопичным только при прокаливании при температуре 12000С и выше гравиметрической формой является Al2O3, гравиметрический фактор FAl= 0,592.
Алюминий в слабокислой среде может образовывать труднорастворимую соль AlPO4. Осаждаемая форма не имеет постоянного состава, а зависит от условий осаждения главным образом от рН и отношения концентраций Al и Р2О5, который нелегко удаляется при промывании. Обычно промывание осадка производят горячим 5% раствором NH4NO3, при помывании осадка водой возможно его частичное растворение и гидролиз.
Осаждение проводят при рН 5,0-6,0. Прокаливание осадка производят при 12000С, при более высоких температурах начинается его разложение.
На образовании труднорастворимого комплекса алюминия Na3[AlF6] основан наиболее ценный фторидный метод определения алюминия. Он очень селективен и позволяет просто и сравнительно быстро определить алюминий в различных образцах. Комплекс Na3[AlF6] образуется в избытке NаF (1,4% избытка). Криолит заметно растворим в воде, растворимость его заметно понижается при избытке NаF. Фториды молибдена, вольфрама, ванадия, циркония, титана и железа обладают гораздо большей растворимостью по сравнению с растворимостью криолита, поэтому они остаются в растворе. Для удержания некоторых металлов в растворе применяется маскирование с помощью оксалата аммония и цитрата аммония. Лучше всего применять смесь насыщенного оксалата аммония и 40%-ного раствора цитрата аммония. В присутствии комплексона III фторид натрия количественно осаждает алюминий из слабокислого раствора, при этом медь, железо, кобальт, никель, цинк, сурьма, висмут и марганец остаются а растворе. Осаждение криолита нужно проводить из соляно-кислых растворов. При этом наблюдается соосаждение титана, железа и ванадия. Поэтому анализируемые растворы предварительно выпаривают серной кислотой до выделения паров SO3. Криолитовый метод считается стандартным при анализе легированных сталей, некоторых ферросплавов и металлов. Определение железа и алюминия. При анализе силикатов, известняков, некоторых руд и других горных пород эти элементы часто определяют гравиметрическим методом в смеси с титаном, марганцем и фосфатом как сумму так называемых полуторных оксидов. Обычно после отделения кремниевой кислоты в кислом растворе проводят осаждение сульфидов (меди и других элементов) и в фильтрате после удаления сероводорода осаждают сумму полуторных оксидов аммиаком в аммиачном буферном растворе. Осадок гидроксидов промывают декантацией и переосаждают, после чего фильтруют, промывают и прокаливают. Прокаленный осадок содержит оксиды Fe2O3, A12O3, TiO2, MnO2. Иногда анализ на этом заканчивается, так как бывает достаточным определить только сумму оксидов и не требуется устанавливать содержание каждого компонента. Наиболее существенным достоинством гравиметрического метода является высокая точность анализа. Обычная погрешность гравиметрического определения составляет 0,1—0,2%. При анализе пробы сложного состава погрешность возрастает до нескольких процентов за счет несовершенства методов разделения и выделения анализируемого компонента. К числу достоинств гравиметрического метода относится также отсутствие каких-либо стандартизации или градуировок по стандартным образцам, необходимых почти в любом другом аналитическом методе. Для расчета результатов гравиметрического анализа требуется знание лишь молярных масс и стехиометрических соотношений. Существенным недостатком гравиметрического метода является длительность определений. Это практически исключает применение гравиметрического анализа, например, для текущего технологического контроля производства и там, где быстрота выполнения анализа имеет решающее значение.
III. Физико-химические методы определения алюминия.
Спектрофотометрический метод определения Al(III).
Фотометрический анализ относится к абсорбционным методам, т.е. основан на измерении поглощения света веществом. Он включает спектрофотометрию, фотоколориметрию и визуальную фотометрию, которую обычно называют колориметрией.
Каждое вещество поглощает излучение с определенными (характерные только для него) длинами волн, т.е. длина волны поглощаемого излучения индивидуальна для каждого вещества, и на этом основан качественный анализ по светопоглошению.
Основой количественного анализа является закон Бугера-Ламберта-Бера:
А = l c
где А = –lg (I / I0) = –lg T – оптическая плотность;
I0 и I – интенсивность потока света, направленного на поглощающий раствор и прошедшего через него;
с – концентрация вещества, моль/л;
l – толщина светопоглощающего слоя;
- молярный коэффициент светопоглощения;
T - коэффициент пропускания.
Для определения концентрации анализируемого вещества наиболее часто используют следующие методы: 1) молярного коэффициента светопоглощения; 2) градуировочного графика; 3) добавок; 4) дифференциальной фотометрии; 5) фотометрического титрования.
Метод молярного коэффициента поглощения. При работе по этому методу определяют оптическую плотность нескольких стандартных растворов Аст, для каждого раствора рассчитывают = Аст / (lсст) и полученное значение усредняют. Затем измеряют оптическую плотность анализируемого раствора Ах и рассчитывают концентрацию сх по формуле
сх = Ах /(l).
Ограничением метода является обязательное подчинение анализируемой системы закону Бугера-Ламберта-Бера, по крайней мере, в области исследуемых концентраций.
Метод градуировочного графика. Готовят серию разведений стандартного раствора, измеряют их поглощение, строят график в координатах Аст – Сст. Затем измеряют поглощение анализируемого раствора и по графику определяют его концентрацию.
Метод добавок. Этот метод применяют при анализе растворов сложного состава, так как он позволяет автоматически учесть влияние «третьих» компонентов. Сущность его заключается в следующем. Сначала определяют оптическую плотность Ах анализируемого раствора, содержащего определяемый компонент неизвестной концентрации сх, а затем в анализируемый раствор добавляют известное количество определяемого компонента (сст) и вновь измеряют оптическую плотность Ах+ст.
Оптическая плотность Ах анализируемого раствора равна
Ах = l cх,
а оптическая плотность анализируемого раствора с добавкой стандартного
Ах+ст = l (cх + сст).
Концентрацию анализируемого раствора находим по формуле:
сх = сст Ах / (Ах+ст – Ах).
Метод дифференциальной фотометрии. Если в обычной фотометрии сравнивается интенсивность света, прошедшего через анализируемый раствор неизвестной концентрации, с интенсивностью света, прошедшего через растворитель, то в дифференциальной фотометрии второй луч света проходит не через растворитель, а через окрашенный раствор известной концентрации – так называемый раствор сравнения.
Фотометрическим методом можно определять также компоненты смеси двух и более веществ. Эти определения основаны на свойстве аддитивности оптической плотности:
Асм = А1 + А2 + …+ Аn
где Асм - оптическая плотность смеси; А1 , А2, Аn – оптические плотности для различных компонентов смеси.
Фотометрические методы анализа применяются для контроля разнообразных производственных процессов. Эти методы могут быть применены для анализа больших и малых содержаний, но особенно ценной их особенностью является возможность определения примесей (до 10-5...10-6%). Методы абсорбционной спектроскопии используют в химической, металлургической, фармацевтической и других отраслях, а также в медицине и сельскохозяйственном производстве.
Промышленностью выпускаются приборы для абсорбционной спектроскопии: колориметры, фотометры, фотоэлектроколориметры, спектрофотометры и т. д., в которых используют различные комбинации осветителей, монохроматоров и приемников света.
