Кінетика коагуляції
Швидкість коагуляції, це зменшення кількості частинок в одиниці об’єму за одиницю часу:
де -поріг коагуляції;
V=-d/dt, [кількість частинок/м3]
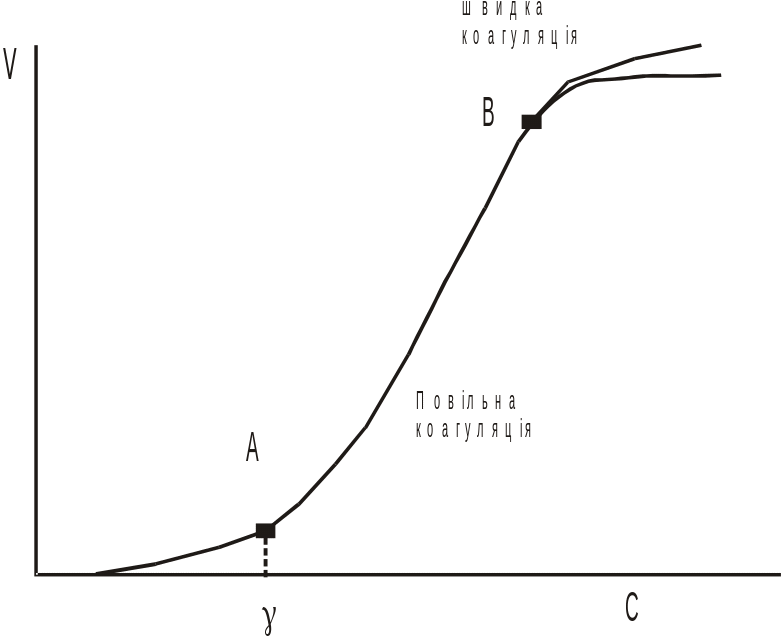
При додавання коагуляції електроліту, починаючи з концентрації, яка відповідає порогу коагуляції, при с > γ швидко зменшується величина енергетичного бар’єру Umах (оскільки стрімко зменшується потенціал), тому швидкість коагуляції сильно зростає, що відповідає прямолінійній ділянці АВ. При зникненні енергетичного бар’єру (Umах), кожне зіткнення частинок стає ефективним, і коагуляція протікає з постійною, максимальною швидкістю, яка залежить лише від загального числа зіткнень частинок (горизонтальна ділянка) – відбувається швидка коагуляція.
Таким чином область швидкої коагуляції – область в якій всі зіткнення ефективні. Обчислення швидкості коагуляції для цієї області зводиться до певного числа зіткнень. Це завдання було розв’язане польським вченим Смолуховським.
Теорія швидкої коагуляції Смолуховського
Основні положення:
1.Швидкість швидкої коагуляції, тобто зміна чисельної концентрації частинок за одиницю часу залежить від:
-чисельної концентрації золю (ν)
-інтенсивності броунівського руху, який характеризується коефіцієнтом дифузії D
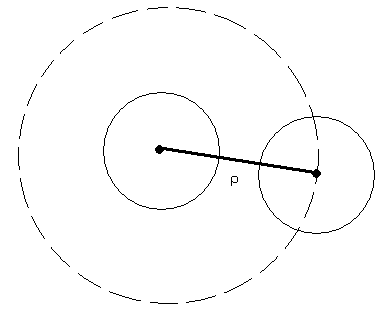
-критичної відстані ρ, на яку повинні наблизитись один до одного центри двох частинок, щоб відбулося злипання частинок. Відстань ρ може перевищувати діаметр колоїдних частинок, і відповідає радіусу сфери поглинання (пунктирна лінія). Коли центр другої частинки доторкнеться поверхні сфери поглинання, відбудеться злипання.
2.При швидкій коагуляції агрегація, відповідно до Смолуховського, відбувається так, що спочатку одинарні частинки стикаються одна з одною утворюючи подвійні частинки (двійники), потім подвійні зіштовхуються з одинарними утворюючи потрійні (трійники) і т.д. Можливі зіткнення між собою та більш складних частинок. Одночасне зіткнення трьох і більше частинок малоймовірно, тому теорія цього не враховує.
Позначимо через ν1, ν2, ν3 …концентрації частинок різного порядку (одинарні, подвійні, потрійні і т.д.). Спочатку, коли час τ=0
ν1= ν0 і ν2= ν3 =…νn=0
де ν0 – початкова концентрація частинок (ще всі частинки одинарні). До моменту часу τ концентрація частинок дорівнює:
ντ = ν1+ ν2 + ν3 +… νn
Пи цьому звичайно ντ < ν0 (тобто кількість частинок зменшилась).
Смолуховський вважав, що формально процес коагуляції частинок можна прирівняти до реакції другого порядку (в елементарному акті приймають участь лише дві частинки). Відповідно, швидкість процесу другого порядку дорівнює:
![]()
Де k- константа швидкості коагуляції.
Знак мінус перед похідною dν/dτ стоїть тому. Що протягом часу τ чисельна концентрація ν падає).
По Смолуховському константа швидкості визначається:
k = 4πρD
Розділивши змінні:
-dν/ ν2 = kdτ
І проінтегрувавши в межах від ν0 до ν ; від 0 до τ матимемо:
1/ν- 1/ ν0 = kτ
Звідки чисельна концентрація золю в момент τ дорівнює:
1/ν- 1/ ν0 = kτ = 1+kν0τ/ ν0
Рівняння Смолуховського:
![]()
Якщо ввести час половинної коагуляції θ, при якому кількість частинок зменшиться вдвоє:
ν = ν0/2
Підставивши в рівняння Смолуховського одержимо:
ν0/2 = ν0/1+kν0 θ
ν0 + kν02θ = 2 ν0 |: ν0
kν0 θ =1 або k = 1/ν0 θ
Підставивши це значення в рівняння Смолуховського:

Таким чином виходячи з кінетичної кривої ν = f(τ) можна одержати час половинної коагуляції θ.

Знаючи час половинної коагуляції θ, легко знайти значення k
![]()
Графічно залежність зміни часткової концентрації можна представити, як:

θ = ctg =1/tg
Теорія Смолуховського пояснює коагуляцію монодисперсних систем. Мюллер розробив аналогічну теорію для пояснення коагуляції полідисперсних систем. Він показав, що частинки різних розмірів агрегуються завжди швидше ніж однакові за величиною частинки. При цьому великі частинки відіграють роль “зародків” центрів коагуляції. Уявлення Мюллера пояснюють автокаталітичний характер коагуляції, яка має місце в багатьох випадках, коли швидкість коагуляції поступово зростає з часом ( за рахунок укрупнення частинок утворюється все більше зародків)
Мюллер також показав, що коагуляція прискорюється, якщо частинки мають видовжену форму, оскільки поряд з поступовим рухом частинки, відбувається ще й обертальний рух частинки, що збільшує ймовірність зіткнення частинок.
Визначення розмірів дисперсних систем.
Для визначення розміру колоїдних частинок можна скористатись різними методами, визначаючи електрокінетичні чи оптичні властивості колоїдних систем. При цьому ми можемо говорити лише про середній розмір частинок дисперсної фази. Цього достатньо для колоїдного ступеню дисперсності, коли мова іде про золі, оскільки в даному випадку частинки не сильно відрізняються одна від одної за своїми розмірами, і визначення середнього розміру частинок повністю достатньо.
Д ля
грубодисперсних систем, коли розмір
частинок змінюється в широких межах
досягаючи величини близько 1мм, визначення
середнього розміру частинок немає
змісту. У цьому випадку аналіз і розділення
частинок проводять за допомогою набору
сит – ситовий аналіз. Набір сит - це
колонка сит з різними отворами розміщеними
одне в одному. Просіваючи полідисперсну
систему через такий набір сит розділяють
дисперсну фазу на кілька фракцій з
відомими розмірами частинок.
ля
грубодисперсних систем, коли розмір
частинок змінюється в широких межах
досягаючи величини близько 1мм, визначення
середнього розміру частинок немає
змісту. У цьому випадку аналіз і розділення
частинок проводять за допомогою набору
сит – ситовий аналіз. Набір сит - це
колонка сит з різними отворами розміщеними
одне в одному. Просіваючи полідисперсну
систему через такий набір сит розділяють
дисперсну фазу на кілька фракцій з
відомими розмірами частинок.
Для дрібніших частинок застосовується седиментаційний аналіз. При цьому про розмір частинок судять за швидкістю їх седиментації (осідання) під дією сили тяжіння.
На сферичну частинку при ї падінні у в’язкому середовищі діють дві протилежно направлені сили:
1. F1 , сила опору середовища, яка за законом Стокса визначається
F1 = 6πηrv
r-радіус частинок
v- швидкість руху частинок
η- в’язкість середовища
F2 , сила тяжіння, під дією якої частинка падає:
F2 = 4/3πr3(ρ-ρ0)g
ρ- густина дисперсної фази
ρ0 – густина дисперсійного середовища
g- прискорення сили тяжіння
Спочатку частинка рухається з прискоренням. З ростом швидкості руху зростає також сила тертя, і коли F1 = F2 швидкість осідання частинок стає постійною. Тоді:
6πηrv= 4/3πr3(ρ-ρ0)g
вирішуючи рівняння відносно радіуса маємо:
![]()
Якщо всі постійні величини в даному рівнянні об’єднати в одну константу
![]()
То рівняння для розрахунку радіуса буде мати вигляд:
![]() ;
;
Коли частинки не мають шароподібної форми, то обчислений радіус не можна вважати реальним радіусом, а він є “ефективним радіусом”, тобто радіусом такої шароподібної частинки, яка осідає з такою ж швидкістю, як і дана, немаюча форми частинка. Седиментаційний аналіз водних суспензій застосовується для частинок радіус яких лежить в межах від 1 до 50 мікрон, оскільки частинки більше 50 мікрон рухаються в воді прискорено, а менше одного мікрона падають дуже повільно.
Якщо система монодисперсна, всі частинки осаджуються з однаковою швидкістю, а ця швидкість осадження може бути визначена за швидкістю зміщення границі суспензії протягом часу (буде спостерігатись різка границя між рідиною, яка посвітліла і суспензією ще не осіла. Відстань “Н” цієї границі від поверхні рідини дорівнює шляху, який пройде частинка за час τ від початку досліду, відповідно швидкість осідання частинок дорівнює
![]()
Підставивши цю швидкість в відому нам формулу визначимо розмір частинок.
Якщо система полідисперсна (що значно частіше спостерігається на практиці) не буде різкої межі поділу, оскільки різні за величиною частинки проходять за один і той самий час різні шляхи. Тому седиментаційний аналіз полідисперсної системи зводиться приводиться до визначення швидкості накопичення осаду – будують сдименентаційну криву, яка являє собою залежність маси частинок що осіли, від часу осідання.
Розглянемо спочатку графік монодисперсної суспензії:
В даному випадку швидкість осідання всіх частинок однакова ОА. До часу τ1 всі частинки осіли і графік осадження проходить паралельно осі часу (відрізок g1 відповідає масі частинок, які осіли). В випадку бідисперсної системи, кожна з двох фракцій повинна дати пряму лінію на кривій седиментації
τ 1 – час осідання більших частинок в кількості g1
τ 2 - час осідання фракції дрібніших частинок в кількості g2
Оскільки, обидві фракції осідають одночасно, гоафік седиментації можна зобразити сумарною лінією. Відрізки на осі ординат відповідають ваглвій кількості першої і другої фракції, звідки може бути обчислений процентний вміст частинок з радіусами r1 i r2:
%r1 =g1/g1+g2 · 100; %r2 = g2/g1+g2 ·100;
С едиментаційний
графік полідисперсної системи має
вигляд плавної кривої. Можливі розміри
частинок суспензії полягають в межах
від rmax до
rmin.
Радіусу rmax
відповідає час τmax
(кінець початкової прямолінійної ділянки
кривої) за яку найбільші частинки осіли
(r1 >
rmax).
Осадження закінчується седиментацією
частинок мінімального розміру (rmin),
за час τmin,
після чого крива переходить в горизонталь.
Після визначення розмірів найбільших
і найменших частинок суспензії:
едиментаційний
графік полідисперсної системи має
вигляд плавної кривої. Можливі розміри
частинок суспензії полягають в межах
від rmax до
rmin.
Радіусу rmax
відповідає час τmax
(кінець початкової прямолінійної ділянки
кривої) за яку найбільші частинки осіли
(r1 >
rmax).
Осадження закінчується седиментацією
частинок мінімального розміру (rmin),
за час τmin,
після чого крива переходить в горизонталь.
Після визначення розмірів найбільших
і найменших частинок суспензії:
Умовно розбивають суспензію на фракції з певними інтервалами радіусів. Для цього ділять вісь τ на цілий ряд ділянок: (τ1, τ2, τ3… ) у відповідних точках на кривій проводять дотичні до перетину з віссю ординат. За значенням τ1, τ2, τ3… вираховують відповідні радіуси фракцій: r1, r2, r3…; відрізки на осі ординат відповідають ваговій кількості фракцій з даним інтервалом радіусів:
ОО1 - всі фракції rmax - r1
О1О2 - всі фракції r1 – r2…
Відповідно графіку седиментації загальна вага суспензії відповідає відрізку ОО4, а відсотковий вміст фракцій може бути порахований:
q1=OO1/OO4100%
За результатами, отриманими при обробці кривої седиментації, як правило будують криву розподілення. Що наочно показує ваговий вміст (g) в суспензії різних фракцій ( з інтервалом радіусів (r). Для цього будують графік залежності g/r = f(r); тоді ваговий вміст кожної фракції (r) буде виражатись площею відповідного прямокутника g/r·r = g.
Побудувавши такі прямокутники для кожного інтервалу радіусів та сполучивши плавною лінією середні точки їх верхніх сторін, отримують криву розподілення – причому площа під кривою відповідає 100% частинок, які осіли.
Фракція, що відповідає максимуму кривої розподілення називається переважаючою фракцією полідисперсної системи, оскільки частинок, які входять цю фракцію найбільше ( на графіку це фракція r2 –r3), а радіус, який відповідає цій фракції називають переважаючим радіусом частинок, його визначають за максимумом кривої розподілу.
Криві розподілу є важливою характеристикою дисперсних систем. Чим вужчий інтервал радіусів кривої розподілу, і чим вищий її максимуму, тим суспензія ближче до монодисперсної, і навпаки, чим крива більш розтягнута, тим більше частинок різного розміру вона містить, тобто полідисперсна.

1 – монодисперсна система;
2- найбільш полідисперсна система;
3 – система, що переважно містить дрібні частинки;
4- система, що містить переважно великі частинки.