
Стійкість та коагуляція колоїдних систем.
Стійкість дисперсійної системи характеризується здатністю зберігати в часі свої основні параметри: дисперсність і рівноважний розподіл дисперсної фази в дисперсному середовищі. Раніше згадувалося що, термодинамічно стійкими є лише ліофільні системи, які здатні утворюватись в результаті самочинного диспергування. Для цього процесу G < 0.
Для систем, що не здатні диспергувати самочинно – ліофобні системи -
G > 0, відповідно вони термодинамічно не стійкі.
Тому надалі ми будемо розглядати стійкість лише ліофобних колоїдних систем, які існують в нестабільному стані.
Поняття стійкості поділяється на 2 групи:
- седиментаційна стійкість;
- агрегативна стійкість.
Седиментаційна стійкість –здатність частинок дисперсійної фази утримуватись в завислому стані, не осаджуючись під дією сили тяжіння, а розподілятьсь в дисперсійному середовищі відповідно до гіпсометричних законів.
Чим менший розмір частинок і чим вища температура, тим стійкіша система ( оскільки інтенсивніший броунівський рух).
Агрегативна стійкість – здатність системи зберігати постійний ступінь дисперсності. Гідрофобні колоїдні системи термодинамічно не стійкі, і значний надлишок вільної поверхневої енергії прагне зменшитись. Цього можна досягти за рахунок зменшення міжфазної поверхні, що супроводжується зменшенням вільної поверхневої енергії, що в свій час призводить до підвищення стійкості системи. Зменшення міжфазної поверхні відбувається за рахунок коагуляції, що є самочинний процес. Коагуляція, або збільшення частинок дисперсної фази може відбуватися двома шляхами:
Рекристалізація: дрібні частинки розчиняються за рахунок чого збільшується розмір більших частинок;
Збільшення частинок за рахунок злипання при зіткненні. Це є основною причиною зменшення міжфазної поверхні.
Таким чином, агрегативна стійкість заперечує коагуляцію. Зростання температури, зменшує агрегативну стійкість, на відміну від седиментаційної стійкості, оскільки збільшується кількість ефективних зіткнень частинок.
Фактори стабілізації колоїдних систем.
1.Існування подвійного електричного шару з частинок. Відповідно, колоїдні частинки однойменно заряджені і електростатично відштовхуються одне від одного – знаходяться у завислому стані.
2.Наявність сольватних оболонок у частинок. Дерягін вважає, що цей фактор стійкості обумовлений тим, що при зближенні колоїдних частинок на близькі відстані, сольватні оболонки здійснюють розклинюючий тиск, що запобігає злипанню частинок.
На думку Ребіндера, сольватні оболонки, мають деяку механічну стійкість, і за короткий час зіткнення частинок, ці сольватні оболонки не встигають витискатись із зазору між частинками, і тому запобігають злипанню частинок (коагуляції).
Таким чином стійкість гідрофобних систем можна збільшити гідрофілізацією поверхні частинок:
-додавання ПАР (за рахунок їх адсорбції), сприяє виникненню гідратної оболонки частинки. Гідрофілізовані частинки не коагулюють навіть за відсутності заряду ξ=0.
3.Структурно-механічний фактор (введений Ребіндер). Стабілізуючу дію мають насичені адсорбційні шари ПАР та ВМС. Ці шари двомірні і утворюють кристалоподібну структуру. Такі шари мають підвищену в’язкість та механічну міцність, і при зіткненні частинок не видавлюються із зазору між частинками - запобігають злипанню частинок. Цей фактор дуже важливий в конденсованих колоїдних системах типу піни, емульсії і суспензії.
Коагуляція в колоїдних системах може бути обумовлена наступними факторами:
- підвищення або пониження температури;
- дія електричного струму;
- механічна дія (перемішування );
- дія світла;
- зміна концентрації золя;
-дія електролітів ( найважливіший фактор).
Теорія коагуляції Дерягіна-Ландау (длфо).
Незалежно від Дерягіна і Ландау, аналогічну теорію розробили Фервей і Овербек, тому сучасна теорія стійкості носить назву ДЛФО.
Дві колоїдні частинки наближуючись одна до одної, знаходяться під дією двох протилежно направлених сил:
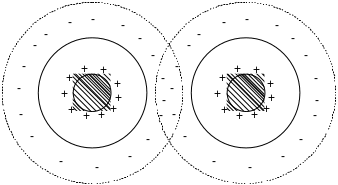
1. Електростатичні сили відштовхування проявляються лише при перекриванні дифузійних шарів колоїдної частинки (оскільки міцели – електронейтральні). В результаті цього, протиіони перерозподіляються: в зоні перекривання концентрація протиіонів зменшується, поза цією зоною - збільшується. Дерягін встановив, що електростатичні сили відштовхування між колоїдними частинками зменшуються з відстанню набагато швидше, ніж випливає із закону Кулона, і в точці “А”, що відповідає початку перекривання дифузних шарів, сила відштовхування дорівнює нулю (крива 1).
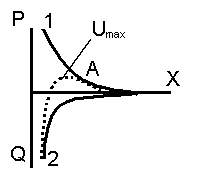
Р-енергія електростатичного відштовхування;
х- відстань між частинками, що наближаються;
Q- енергія притягання сили Ван-дер-Ваальса;
А-відповідає відстані початку перекривання
дифузійних шарів.
2. Сили притягання, сили Ван-дер-Ваальса проявляються на відстанях, порівняних з розмірами частинок і різко зменшуються зі збільшенням відстані між ними (крива 2).
Наведені криві називаються потенціальними кривими. Які розраховуються теоретично. Оскільки при наближенні міцел між ними діють протилежно направлені сили. Ступінь стійкості системи визначається співвідношенням цих сил, тобто сумарною енергією взаємодіі, яка виражається кривою «U». Яка виникає внаслідок геометричного складання потенціальних кривих.
Аналіз U-кривої:
В області малих і великих відстаней переважають сили притягання, на відміну від середніх де переважають сили відштовхування. При наближенні двох частинок вони здатні коагулювати(злипатися) лише за умови подолання енергетичного бар’єру (Umax) за рахунок підвищеної кінетичної енергії.
1. При високому енергетичному бар’єрі енергії броунівського руху недостатньо для його подолання, частинки не злипаються, система агрегативно стійка.
2. При невисокому енергетичному бар’єрі найбільш “гарячі” частинки здатні подолати “Umax” і злипаються. Таким чином не всі зіткнення частинок призводять до злипання, при цьому відбувається так звана повільна коагуляція.
3. При відсутності енергетичного бар’єру всі зіткнення частинок ефективні, в системі відбувається швидка коагуляція.
Таким чином, коагуляцію можна викликати зменшенням або знищенням цього енергетичного бар’єру. Для цього можна скористатися введенням в систему електроліту:
- індиферентного ;
- неіндиферентного;
Індиферентний електроліт не здатний адсорбуватися на поверхні частинки, а тому і не має впливу на величину - потенціалу – викликає зниження ДЕС, відповідно перекривання дифузійних шарів відбувається на менших відстанях міцели – зміщується положення точки ААІ. Крім того відбувається зменшення енергетичного бар’єра UU’, тобто більше зіткнень частинок стає ефективним, коагуляція посилюється.
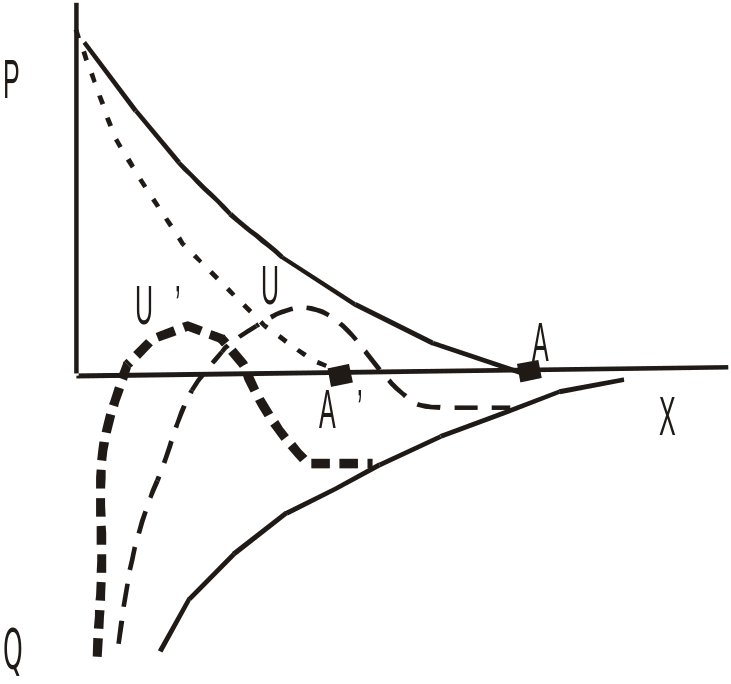
Неіндиферентний електроліт адсорбуючись на поверхні частинки зменшує величину термодинамічного потенціалу (), при чому зменшується максимальна величина сил відштовхування (Р), сили взаємного притягання – як і в попередньому випадку залишаються незмінними. При чому різке зменшується величина потенційного бар’єра UU’, який може навіть ліквідуватися. Це призводить до швидкої коагуляції – всі зіткнення стають ефективними.

Коагуляція індиферентними електролітами називається концентраційною, а неіндиферентними – нейтралізаційною коагуляцією.
В реальних системах відбувається одночасна дія цих двох факторів коагуляції.
Повернемося до кривої потенціалів.
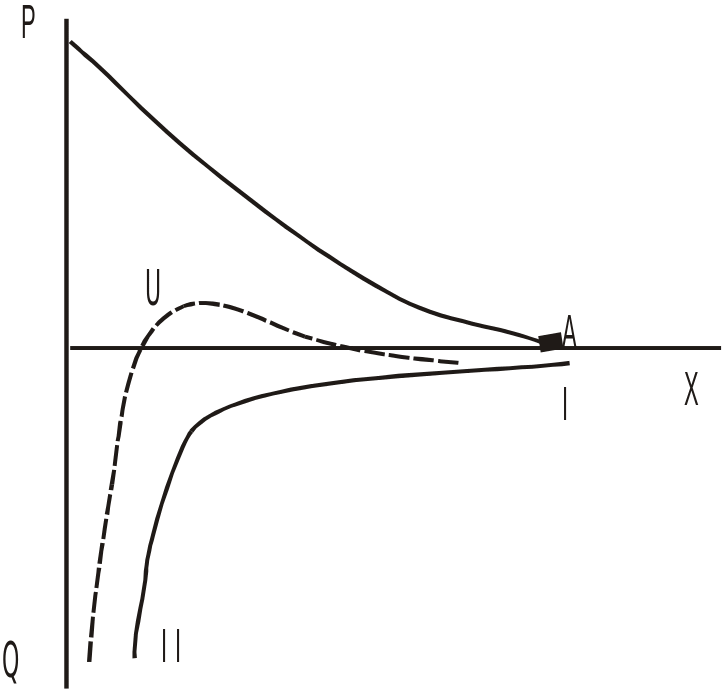
Поруч з максимумом на U- кривій Umax спостерігається ще два мінімуми:
І Від’ємному мінімуму енергії при найбільших відстанях (103 Å) між частинками, коли не відбувається перекривання дифузних шарів, відповідають так звані далеко діючі сили притягання; при цьому частинки не з’єднуються одна з одною, але між ними виникає гнучкий зв’язок, що призводить до деякого упорядкування системи. Існуванням далеко діючих сил пояснюється ряд явищ:
а)Тіксотропія – взаємний перехід золя в гель (в структуровану систему).
б)Здатність бактерій та вірусів втримуватися одне одного утворюючи ланцюжки, зримо не доторкаючись між собою.
ІІ Наявність глибокої ями потенціалу, що відповідає сильній взаємодії між частинками на близьких відстанях, пояснює механічну міцність коагуляту. Частинки на близьких відстанях настільки сильно взаємодіють, що коагулят набуває деяких властивостей твердого тіла.
