
- •1) Основные положения молекулярно-кинетической теории и их опытное обоснование
- •2) Диффузия
- •3) Броуновское движение
- •4) Масса молекул
- •5) Количество вещества. Постоянная Авогадро
- •6) Размеры молекул
- •7) Идеальный газ
- •8) Скорости молекул газов
- •9) Основное уравнение мкт идеального газа
- •10) Температура и тепловое равновесие системы
- •11) Измерение температуры
- •12)Абсолютная температурная шкала. Абсолютный нуль.
- •13)Уравнение состояния идеального газа
- •14)Частые случаи уравн. Состояния идеал. Газа
- •15) Термодинамический подход к изучению физических процессов
- •16)Термодинамические параметры состояния тела
- •17) Внутренняя энергия тел
- •18)Измерение внутренней энергии
- •19)Количестао теплоты
- •20)Работа в термодинамике
- •21) Первый закон термодинамики
- •22)Применение 1-го закона термодинамики к различным тепловым процессам.
- •23)Адиобатный процесс
- •24) Теплоемкости при постоянном давлении и постоянном объеме
- •25) Обратимые и необратимые процессы. Необратимость тепловых процессов.
- •26)Тепловые двигатели. Принцип их действия.
- •27) Кпд теплавого двигателя.
- •28) Роль тепловых двигателей в развитии теплоэнергетики и транспорта. Тепловые двигатели и охрана природы
- •29) Испарение и конденсация
- •30) Насыщенные и ненасыщенные пары и их свойства
- •31) Кипение жидкостей. Зависимость температуры кипения от давления
- •32) Влажность воздуха. Точка росы. Психрометр. Гигрометр
- •33) Свойства жидкостей
- •34) Поверхностная энергия
- •35) Поверхностное натяжение
- •36) Смачивание. Капиллярные явления
19)Количестао теплоты
Мерой изменения Wмех является А работа сил, приложенных к системе.ΔWмех=А. При теплообмене происходит изменения внутренней энергии тела.Мера изменения внутр. энергии –является
количеством теплоты.Количества теплоты- мера изменения внутр. энерг. которое тело получает в процессе теплообмена Q=ΔU.[Q]=1Дж
Количество теплоты необходимое для нагревания тела массой m от темп. Т1 до Т2,рассчитывается по форм.:Q=cm(T2-T1)=cmΔT. C-удел. теплоемкость вещества. с=Q/m(T2-T1). [c]=1дж/кг*К.
Удельная теплоемкость-равна колич.теплоты которое неоходимо сообщить телу m 1кг, чтобы нагреть его на 1Кл.Теплоемкость тела-
Ст=Q/(T2-T1)=cm.[C]=Дж/Кл.Для превращения жидкость в пар при T=const необходимо затр. Q=rm.r-уделю теплота парообразования.
При конденсации пара выдел. тоже кол. теплоты Q=-rm.
Для расплавления тела массой m при Т плав.неоходимо сообщ.телу Q
λ-удел. теплота плав. Q, которое выделяется при полном сгорании топлива =: Q=qm. q-удельная теплота сгорания.
20)Работа в термодинамике
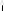
F Газ с темп. Т1 нагрев. до Т2.Газ изобарически

 2
расширяется и поршень переместится
из
2
расширяется и поршень переместится
из
 полож.
1 в 2.Газ совершает А против
полож.
1 в 2.Газ совершает А против
F внешней F.Так как Р=const, то F=pS тоже

 1
соnst.
А рассчитывается: A=FΔL=pSΔL=pΔV=
1
соnst.
А рассчитывается: A=FΔL=pSΔL=pΔV=
 L1
L2
;
=p(V2-V1).Газ
выполняет А в процессе
L1
L2
;
=p(V2-V1).Газ
выполняет А в процессе
изменения V причем газ расшир. и А>0,
ΔV>0.При зжатии газ V<0,A<0.
Уравн. Миндилеева-Клаперона:pV/T=m/M*R; pV1= m/M*R*T1;
pV2= m/M*R*T2; pV2-pV1= m/M*R*T2- m/M*R*T1; pΔV= m/M*R*ΔT.
A=pΔV;A= m/M*R*ΔT.Если m=M=1, ΔT=1К,то A=R.
21) Первый закон термодинамики
Первый закон термодинамики — это закон сохранения и превращения энергии в применении к тепловым процессам.
Если механическая энергия системы не изменяется, а система не замкнута и между ней и окружающей средой происходит теплообмен, то изменяется внутренняя энергия.
![]()
Первый закон термодинамики формулируется так:
изменение внутренней энергии при переходе системы из одного состояния в другое равно работе внешних сил плюс количество теплоты, переданное системе в процессе теплообмена.
Если
вместо работы внешних сил Авн
ввести работу
А системы
над внешними телами А
= -Авн, то
запишется:
![]()
Тогда I закон термодинамики можно сформулировать так: количество теплоты, сообщенное системе, идет на изменение ее внутренней энергии и на совершение системой работы против внешних сил.
Из первого закона термодинамики вытекает невозможность создания вечного двигателя первого рода, т.е. такого двигателя, который совершал бы работу без затраты энергии извне.
Действительно, если к системе не подводится энергия Q = 0, то А =-ΔU и работа может быть совершена за счет убыли внутренней энергии системы. После того, как запас энергии окажется исчерпанным, двигатель перестанет работать.
Если система замкнута (Авн=0) и адиабатически изолирована (Q = 0) то первый закон термодинамики будет иметь вид:ΔU=0
Если в такой системе имеются тела с различной температурой, то между ними будет происходить теплообмен: тела, у которых температура выше, будут отдавать энергию и охлаждаться, а тела с меньшей температурой будут получать энергию и нагреваться. Это будет происходить до тех пор, пока температуры у всех тел не станут одинаковыми. При этом ΔU1+ΔU2+…ΔUn=0 или Q1+Q2+…+Qn=0
Первый закон термодинамики для незамкнутой и адиабатически изолированной системы называют уравнением теплового баланса.
