
- •1) Основные положения молекулярно-кинетической теории и их опытное обоснование
- •2) Диффузия
- •3) Броуновское движение
- •4) Масса молекул
- •5) Количество вещества. Постоянная Авогадро
- •6) Размеры молекул
- •7) Идеальный газ
- •8) Скорости молекул газов
- •9) Основное уравнение мкт идеального газа
- •10) Температура и тепловое равновесие системы
- •11) Измерение температуры
- •12)Абсолютная температурная шкала. Абсолютный нуль.
- •13)Уравнение состояния идеального газа
- •14)Частые случаи уравн. Состояния идеал. Газа
- •15) Термодинамический подход к изучению физических процессов
- •16)Термодинамические параметры состояния тела
- •17) Внутренняя энергия тел
- •18)Измерение внутренней энергии
- •19)Количестао теплоты
- •20)Работа в термодинамике
- •21) Первый закон термодинамики
- •22)Применение 1-го закона термодинамики к различным тепловым процессам.
- •23)Адиобатный процесс
- •24) Теплоемкости при постоянном давлении и постоянном объеме
- •25) Обратимые и необратимые процессы. Необратимость тепловых процессов.
- •26)Тепловые двигатели. Принцип их действия.
- •27) Кпд теплавого двигателя.
- •28) Роль тепловых двигателей в развитии теплоэнергетики и транспорта. Тепловые двигатели и охрана природы
- •29) Испарение и конденсация
- •30) Насыщенные и ненасыщенные пары и их свойства
- •31) Кипение жидкостей. Зависимость температуры кипения от давления
- •32) Влажность воздуха. Точка росы. Психрометр. Гигрометр
- •33) Свойства жидкостей
- •34) Поверхностная энергия
- •35) Поверхностное натяжение
- •36) Смачивание. Капиллярные явления
6) Размеры молекул
Размер молекулы является величиной условной. Между молекулами наряду с силами притяжения действуют и силы отталкивания, поэтому молекулы могут сближаться лишь до некоторого расстояния.
Расстояние предельного сближения центров двух молекул называют эффективным диаметром молекулы d (при этом считают, что молекулы имеют сферическую форму).
Метод определения размеров малек:
В твердых и жидких телах молекулы расположены очень близко одна к другой, почти вплотную. Поэтому можно считать, что V, занимаемый телом некоторой массы т, приблизительно = сумме объемов всех его молекул.V1=V/N; N=m/M*Na;V1=VM/mNa;
ρ=m/V-плотность тела. малекула—шар, то d=2r; V1=4/3πr^3=πd^3/6;
d=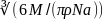 ;
Размеры молекул очень малы.
;
Размеры молекул очень малы.
7) Идеальный газ
Форму и объем тела определяет совместное действие двух факторов: 1) взаимодействие молекул, которое стремится удержать молекулы на определенных расстояниях друг от друга; 2) хаотическое движение молекул, которое разбрасывает их по всему объему.
Молекулы газа разлетаются по всему предоставленному для него объему. Следовательно, главную роль в поведении газа играет хаотическое движение молекул, а силы взаимодействия малы, и ими можно пренебречь. Это означает, что молекулы газа движутся равномерно и прямолинейно, пока не столкнутся с другими молекулами. При столкновении изменяется величина и направление скорости движения молекулы, и она снова движется равномерно прямолинейно до следующего столкновения. Длина свободного пробега (расстояние между двумя последовательными столкновениями молекулы) X ~ 10~7 м. При такой длине свободного пробега только 0,04% пространства, занятого газом, приходится на собственный объем его молекул. Это дает право воспользоваться моделью идеального газа.
Идеальный газ — это газ с достаточно простыми свойствами:
1) молекулы его исчезающе малы и их собственным объемом можно пренебречь, по сравнению с объемом сосуда, в котором находится газ;
2) между молекулами идеального газа нет сил взаимодействия;
3) молекулы идеального газа ведут себя при столкновениях как абсолютно упругие шарики.
При небольших давлениях и не очень низких температурах реальные газы близки к идеальному газу.При высоких давлениях молекулы газа сближаются, что пренебречь их собственным объемом нельзя и между ними возникают заметные силы притяжения.При низких температурах кинетическая энергия уменьшается и становится сравнимой с потенциальной энергией и пренебречь последней нельзя.
Для описания свойств газов можно пользоваться:1)микроскопическими параметрами (скорость, масса молекулы, ее энергия и др.), которые являются индивидуальными характеристиками молекул и численные значения которых находятся только расчетным путем; 2) макроскопическими параметрами (давление, температура, объем газа), значение которых определяется совместным действием огромного числа молекул. Макропараметры — это параметры газа как физического тела. Численные значения их находят простым измерением с помощью приборов.
Давление газа — это средняя сила ударов молекул о тело (например, о стенки сосуда), отнесенная к единице его поверхности.
Абсолютная температура Т — мера средней кинетической энергии хаотического движения молекул (см. раздел 6.11).
Под объемом газа понимают объем сосуда, в котором находится газ.
