
- •Методические указания к лабораторной работе № 1
- •Новороссийск
- •Председатель методического совета нпи________________ в.В. Дьяченко Содержание
- •Общие правила работы в лабораториях во время занятий с учащимися [1]
- •Требования безопасности при работе с кислотами и щелочами [1]
- •Растворять твердые щелочи следует путем медленного прибавления их небольшими кусочками к воде при непрерывном перемешивании. Кусочки щелочи нужно брать только щипцами.
- •Правила безопасности работы с химической посудой и ампулами [1]
- •Дисперсные системы [2] Основные определения
- •Дисперсность
- •Классификация дисперсных систем [2, 5 – 7] Классификация по дисперсности
- •Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •Классификация, учитывающая различие в форме частиц
- •Классификация по термодинамической устойчивости и характеру образования
- •Получение дисперсных систем [2, 5]
- •Условия образования новой фазы
- •Влияние способа получения на строение порошковых частиц
- •Строение коллоидной мицеллы
- •«Получение золей и их характеристика»
- •Выполнение работы
- •Контрольные вопросы
- •Литература
Строение коллоидной мицеллы
На границе раздела твердая частица – жидкость возникает двойной электрический слой из-за присутствия ионных пар на поверхности. Образование такого слоя возможно двумя путями. Один путь – преимущественная адсорбция одного из присутствующих в растворе иона, входящего в состав твердой фазы или изоморфного с ней. Другой путь образования двойного электрического слоя на границе раздела твердое тело (диэлектрика) – жидкость, т. е. диссоциация поверхностных молекул твердого тела с образованием ионов определенного знака в растворе. Ионы, сообщающие заряд твердой фазе, называются потенциалопределяющими, а ионы, остающиеся в растворе, – противоионами.
Каждая частица дисперсной фазы представляет собой агрегат молекул ультрамикроскопических размеров и называется агрегатом, рисунок 8.
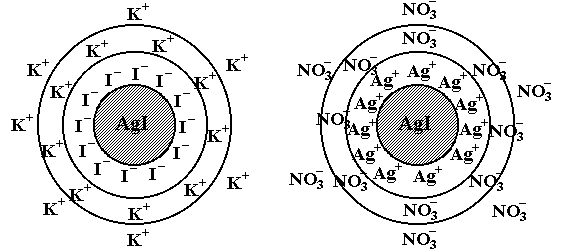
рисунок 8 – Схема строения коллоидной мицеллы золя иодида серебра:
а при избытке KI; б при избытке AgNO3
Агрегат вместе с двойным электрическим слоем из потенциалопределяющих ионов и противоионов образует мицеллу. Часть мицеллы, состоящая из агрегата и потенциалопределяющих ионов, называют ядром мицеллы. Под действием электростатического притяжения противоионы стремятся расположиться возможно ближе к ионам, адсорбированным на поверхности. В предельном случае образуется два слоя ионов, из которых один расположен на твердой поверхности внутренняя обкладка двойного слоя, другой, заряженный противоположно, расположен в растворе на расстоянии ионного диаметра внешняя обкладка его. Такой двойной слой представляет собой как бы плоский конденсатор с толщиной порядка диаметра молекулы. Это двойной электрический слой по Гельмгольцу (рисунок 9).
В результате теплового движения ионы внешней обкладки с большей (кинетической энергией ухолят в объем раствора. Вследствие этого в сильно разбавленных растворах создается объемный заряд, плотность которого убывает с удалением от поверхности раздела. Слой, в котором распределены противоионы, образующие этот заряд, называется диффузным слоем по Гуи (см. рисунок 9). Толщина его 1 т. е. расстояние, на котором еще сказывается влияние заряда поверхности, тем меньше, чем больше концентрация раствора.
В растворах средних концентраций часть противоионов соприкасается с потенциалопределяющими ионами, образуя гельмгольцевский двойной слой.
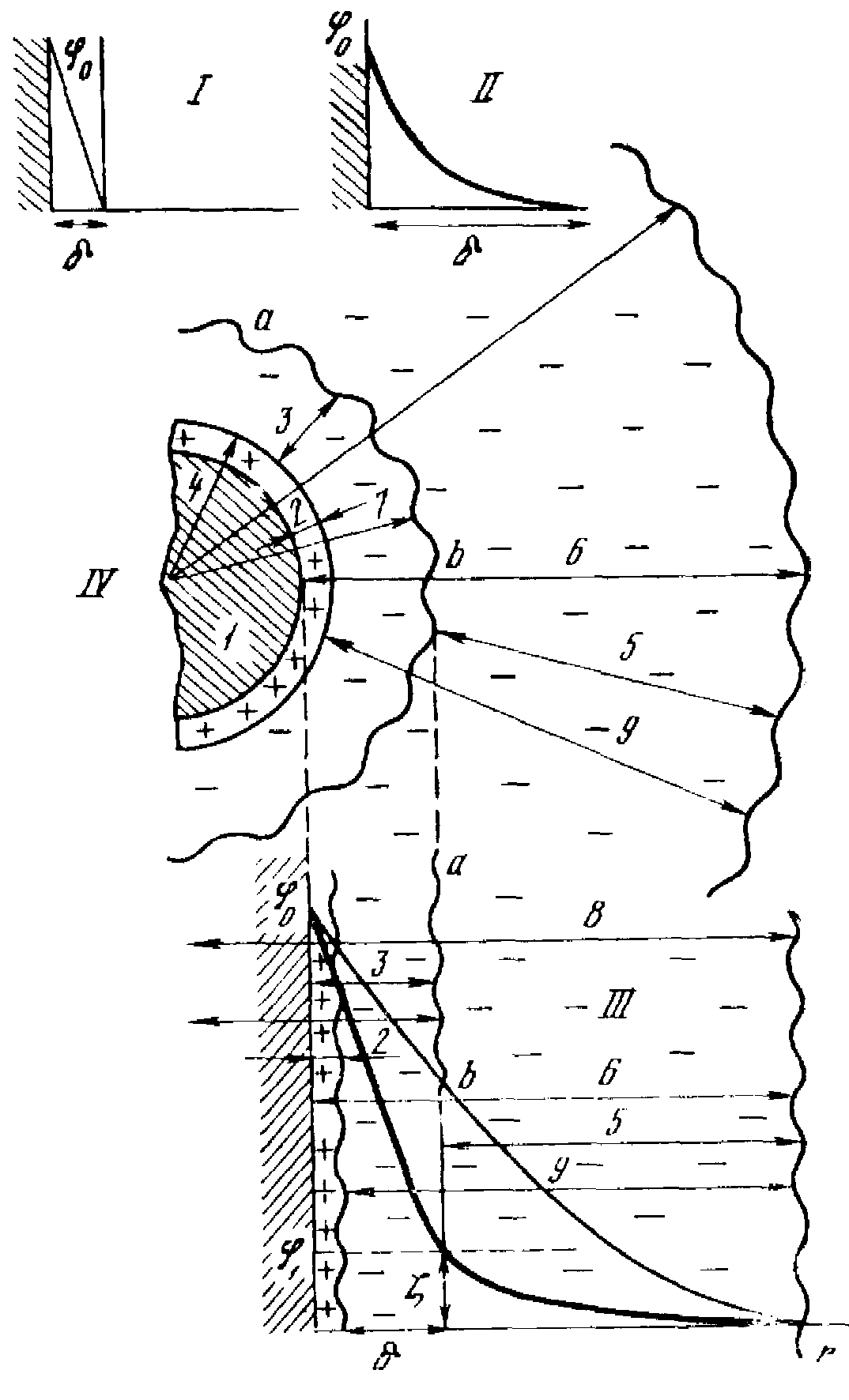
рисунок 9 – Строение двойного электрического слоя:
I – по Гельмгольцу; II – по Гун; III – по Штерну; IV – схема мицеллы; 1 – агрегат; 2 – потенциалопределяющие ионы; 3 – адсорбционный слой противоионов; 4 – ядро; 5 – диффузный слой противоионов; 6 – двойной электрический слой; 7 – частица; 8 – мицелла; 9 – слой противоионов; ab – граница скольжения; 0 – полный скачок потенциала; – электрокинетический потенциал; – толщина двойного слоя
Эти противоионы прочно связаны с ядром мицеллы за счет адсорбционных и электростатических сил и образуют адсорбционный слой противоионов. Они расположены на расстоянии с потенциалом 1. Другая часть противоионов образует диффузный слой противоионов с потенциалом , удерживаемых около ядра только электростатическими силами. Ядро мицеллы вместе с адсорбционным слоем противоионов называется коллоидной частицей. При разбавлении золя структура двойного электрического слоя приближается к структуре слоя Гуи, а при повышении концентрации – к структуре слоя Гельмгольца.
Рассмотрим строение двойного электрического слоя на частице золя AgI в растворе KI; из раствора преимущественно адсорбируют I– ионы, так что частицы несут отрицательный заряд, а противоионы K+ располагаются частично в адсорбционном, а частично в диффузном слое. На основании приведенных представлений можно доставить формулу мицеллы (см. рисунок 4). Для золя иодида серебра она имеет вид:
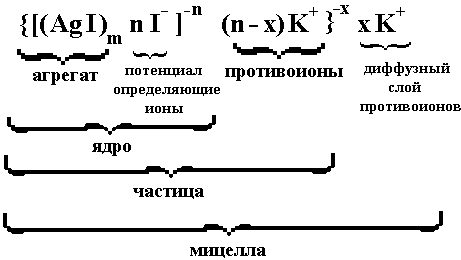
Число ионов, входящих в диффузный слой, определяется из условия электронейтральности мицеллы в целом.
На основании обширного экспериментального материала Ф. Панет и К. Фаянс сформулировали правило: на поверхности твердого вещества предпочтительно адсорбируются ионы, способные достраивать его кристаллическую решетку или образующие с ионами, входящими в состав кристаллической решетки, наиболее трудно растворимые соединения.
Поясним правило Панета – Фаянса следующими примерами. Заряд ядра мицеллы золя иодида серебра, получаемого по реакции AgNO3 с KI при избытке последнего, отрицательный, так как кристаллическую решетку могут достраивать ионы I– (рисунок 8):
{[(AgI)mnI–]xK+} (n – x)K+
При избытке AgNO3 ядро приобретает положительный заряд, поскольку из всех ионов, остающихся в растворе, кристаллическую решетку могут достраивать только ионы Ag+:
{[(AgI)mn Ag+]x NO3–} (n – x) NO3–
В приведенных примерах кристаллическую решетку могут достраивать ионы, входящие в ее состав. Кроме них способностью достраивать кристаллическую решетку обладают ионы, изоморфные с ионами, входящими в состав кристалла.
Экспериментально подтверждены изложенные предположения о строении мицелл. Действительно, при электрофорезе частицы золя иодида калия, полученного при избытке KI, перемещаются к аноду, а частицы, полученные при избытке AgNO3, к катоду.
Лабораторная работа № 1
