
- •Самостійна робота студента № 1
- •Самостійна робота студента № 2
- •Самостійна робота студента № 3
- •Самостійна робота студента № 4
- •Самостійна робота студента № 5
- •Самостійна робота студента № 6
- •Самостійна робота студента № 7
- •Самостійна робота студента № 8
- •Самостійна робота студента № 12
- •Самостійна робота студента № 13
- •Самостійна робота студента № 14
- •Самостійна робота студента № 15
- •Самостійна робота студента № 16
- •Самостійна робота студента №18
- •Самостійна робота студента № 28
- •Самостійна робота студента №30
Самостійна робота студента № 8
з теми «Гомогенний і гетерогенний каталіз»
Ката́лиз (греч. κατάλυσις восходит к καταλύειν — разрушение) — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.
Термин «катализ» был введён в 1835 году шведским учёным Йёнсом Якобом Берцелиусом.
Явление катализа распространено в природе (большинство процессов, происходящих в живых организмах, являются каталитическими) и широко используется в технике (в нефтепереработке и нефтехимии, в производстве серной кислоты, аммиака, азотной кислоты и др.). Большая часть всех промышленных реакций — это каталитические.
Катализ может быть положительным (когда скорость реакции увеличивается) и отрицательным (когда скорость реакции уменьшается). Для обозначения отрицательного катализа часто используют термин ингибирование.
Катализ бывает гомогенным и гетерогенным (контактным). В гомогенном катализе катализатор состоит в той же фазе, что и реактивы реакции, в то время, как гетерогенные катализаторы отличаются фазой.
Гомогенный катализ
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
H2О2 + I → H2О + IO
H2О2 + IO → H2О + О2 + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
Гетерогенный катализ
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
Диффузия реагирующих веществ к поверхности твердого вещества
Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
Химическая реакция между реагирующими молекулами
Десорбция продуктов с поверхности катализатора
Диффузия продукта с поверхности катализатора в общий поток
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод).
Самостійна робота студента № 9
з теми «Гальванічні елементи»
Гальвані́чний елеме́нт — джерело живлення, в якому використовується різниця електродних потенціалів двох металів, занурених у електроліт.
Принцип дії
Найпростішим гальванічним елементом є елемент Вольта, в якому використовуються цинковий і мідний електроди, занурені в розчин сірчаної кислоти. Кожен із електродів зокрема разом із електролітом, в який він занурений, утворює напівелемент.
На поверхні кожного з металів, занурених в електроліт, виникає подвійний електричний шар внаслідок переходу частини атомів металу в розчин у вигляді йонів. Як наслідок, кожен із металів отримує електричний заряд. Якщо з'єднати електроди провідником, то заряд стікатиме від електрода з більшим потенціалом, до електрода з меншим потенціалом, утворюючи електричний струм. При цьому потенціали електродів вирівнюватимуться, що призведе до порушення рівноваги між електродом і електролітом. Це, в свою чергу, викликає перехід нових атомів із електроду в електроліт. В результаті в замкненому колі підтримується електричний струм, який супроводжується розчиненням електродів.
На малюнку праворуч показана схема дещо складнішого але досконалішого елемента, в якому кожен із металів перебуває в окремому електроліті. Електроліти з'єднані між собою соляним мостом.
Активна маса електроду — це суміш, яка складається з речовини, хімічна енергія яких під дією заряду перетворюється на електричну енергію (активна речовина), і речовин, які покращують її провідність і певні физико-хімічні властивості.
Використання
Принцип дії гальванічного елемента використовується в електрохімічних батареях і акумуляторах.
Назва
Своєю назвою гальванічні елементи завдячують італійському фізику Луїджі Гальвані.
Самостійна робота студента № 10 з теми «Корозія»
Коро́зія металів — процес хімічного руйнування металів і сплавів при їх взаємодії з зовнішнім середовищем: повітрям, водою, розчинами електролітів тощо. Розрізняють два види корозії: хімічну і електрохімічну.
Хімічна корозія відбувається в середовищах, які не проводять електричного струму. Вона обумовлюється дією на метали неелектролітів (спирту, бензину, мінеральних масел тощо) і сухих газів (кисню, оксидів азоту, хлору, хлороводню, сірководню і ін.) при високій температурі (так звана газова корозія).
У результаті взаємодії металів із зовнішнім середовищем їх поверхня вкривається тонким шаром (плівкою) різних хімічних сполук (продуктів корозії): оксидів, хлоридів, сульфідів і т. д. Інколи цей шар такий щільний, що крізь нього не може проникати агресивне середовище. В таких випадках з часом швидкість корозії зменшується, а то й зовсім припиняється. Наприклад, алюміній в атмосфері повітря кородує значно повільніше від заліза, хоч за своїми хімічними властивостями він активніший від заліза. Це пояснюється тим, що поверхня алюмінію вкривається суцільною, досить щільною і міцною оксидною плівкою, яка ізолює метал від доступу кисню, а оксидна плівка заліза, навпаки, є крихкою і ламкою, містить багато пор і тріщин, через що кисень повітря крізь неї легко проникає до поверхні заліза, і тим обумовлюється безперервне його руйнування.
Електрохімічна корозія більш поширена і завдає значно більшої шкоди, ніж хімічна. Вона виникає при контакті двох металів у середовищі водних розчинів електролітів. На відміну від хімічної електрохімічна корозія супроводжується переміщенням валентних електронів з одної ділянки металу на іншу, тобто виникненням місцевих електричних струмів внаслідок утворення на кородуючій поверхні так званих гальванічних пар.
При зануренні цинкової пластинки в кислоту атоми цинку з її поверхні поступово переходять у розчин у вигляді іонів Zn2+, а їх валентні електрони залишаються на поверхні металу. Внаслідок цього на границі метал—електроліт утворюється подвійний електричний шар.
Мідь, як відомо, з розведеною сульфатною кислотою не взаємодіє. Тому іони міді не переходять у розчин і на її поверхні не буде надлишків електронів. Але коли обидві пластинки з'єднати мідною дротиною, то концентрація надлишкових електронів, (цинкової пластинки) почне вирівнюватись на обох пластинках і електрони з цинкової пластинки почнуть переміщатися на мідну. Якщо в систему включити гальванометр, то він покаже наявність електричного струму. Однак концентрація електронів, на обох пластинках не може бути однаковою. Це пояснюється тим, що іони водню легше розряджаються (приєднують електрони) на поверхні міді, ніж на поверхні цинку. Через це процес відновлення іонів водню і виділення вільного водню буде відбуватися практично лише на мідній пластинці, а на цинковій; майже зовсім припиниться. Але швидкість розчинення цинку при цьому значно збільшиться, оскільки надлишкові електрони, з поверхні цинку будуть швидко переміщатися на мідну пластинку і там приєднуватися іонами водню.
Процес кородування заліза в контакті з міддю схематично можна зобразити такими рівняннями:
дисоціація води: 2H2O -> 2Н+ + 2ОН-
втрата атомами заліза валентних електронів і перехід іонів у розчин: (Метал) 2е <- Fe0 -> Fe2+ (Розчин)
відновлення катіонів водню (на поверхні міді) і виділення вільного водню: 2Н+ + 2е -> 2Н° —> Н2 ↑;
утворення дигідроксиду заліза: Fe2+ + 2OH- -> Fe(OH)2;
окиснення двовалентного заліза до тривалентного розчиненим киснем повітря: 4Fe(OH)2 + O2 + 2H2O -> 4Fe(OH)3;
часткова втрата води тригідроксидом заліза і перетворення його в гідроксид-оксид заліза:
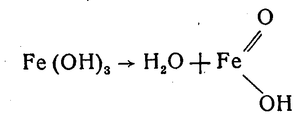
Самостійна робота студента № 11 з теми «Будова молекули та діаграма стану води»
Що ж саме є чиста вода з фізичної точки зору? Як і всі речовини, вона складається із молекул, а молекули із атомів. Атом водню являє собою протонове ядро навкруги якого оберається один електрон, утворюючи сферичну орбиталь на першому енергетичному рівні (1S1). У атома кисню навкруги ядра обертається 8 електронів. На першому енергетичному рівні – 2 електрони, що утворюють сферичну електронну хмару (1S2), на другому – 6 електронів, з яких 2 утворюють сферичну орбіталь (2S2), а 4 – три електронні орбіталі типу “Р” (витягнуті по координатних осях вісімки) (2Р4), причому одну орбіталь – P утворюють два (спарені) електрони з різними спинами, а на двох інших орбіталях обертається по одному електрону (1S2 2S2 2Р4).
Молекула води складається з одного атома кисню та двох атомів водню.
Між цими атомами утворюється ковалентний зв’язок, який є результатом перекриття сферичних електронних орбіталей атомів водню і Р-орбіталей кисню, що утворені незпареними електронами.
P-електронні хмари кисню взаємоперпендикулярні, тому і молекула води має кутову будову. Але завдяки зростанню енергії на кінцях Р-орбіталей із-за ковалентного зв’язку, кут між ними зростає. При цьому, S- електронна хмара 2-го рівня кисню перетворюється в форму “Р”. В результаті молекула води має таку будову.
В центрі розташоване протонове ядро атому кисня. На першому енергетичному рівні обертається два електрони утворюючи сферичну орбіталь, 4-електрони утворюють дві електронні орбіталі з ковалентними зв’язками навкруги ядер кисню і водню, 4 зпарені електрони кисню утворюють орбіталі типу “Р”, витягнуті у протилежному від ядер кисню напрямі і в площині, що перпендикулярна до площі HOH.
Таким чином, модель молекули води має вигляд тетраедру в центрі якого знаходиться ядро кисню. Ядра атомів водню розташовані в двох кутах тетраедру. З ними пов’язані 2 полюси додатніх електричних зарядів.
Центри від’ємних зарядів двох неподілених пар електронів займають два інших кута тетраедру.
Результуючий центр додатніх зарядів розташований між ядрами водню. Результуючий центр від’ємних зарядів – між орбіталями неподілених пар електронів на протилежній частині молекули води.
Молекула води, таким чином, має полярну будову (диполь) із порівняно великою величиною дипольного моменту ( СГСЕ).
Сучасні спектроскопічні та рентгенографічні дослідження будови молекули води дозволили встановити відстань між ядрами кисню та водню (H – O) та кут між ковалентними зв’язками ( HOH ). Відстань Н – О дорівнює 0,957 А, кут HOH у молекули, що пов’язана з іншими молекулами (у твердому стані) дорівнює 109о 30’, а у вільній молекулі (у рідкому стані) – 104o 27’.
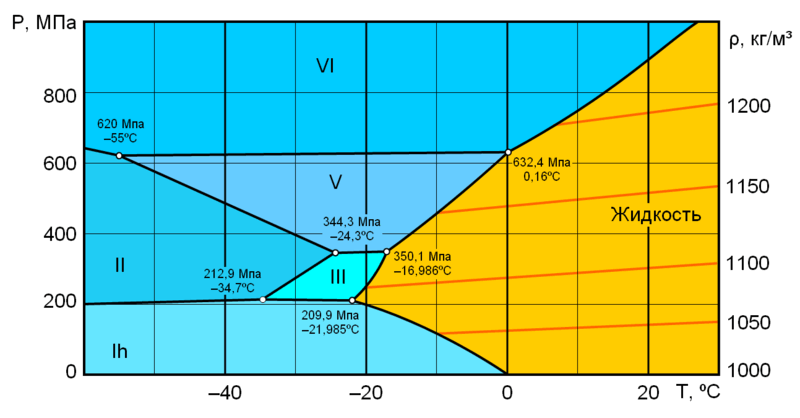
Фазова діаграма води
