
1.4. Метаболизм азота
Все элементы, входящие в состав живых организмов, находятся в состоянии непрерывного обмена между биосферой, т. е. совокупностью всех живых организмов, и средой их обитания — атмосферой, гидросферой, почвами. Однако значение и масштаб этого обмена резко различаются для различных биогенных элементов. Особенно интенсивным этот обмен является в случае углерода, водорода и кислорода, поскольку он лежит в самой основе существования подавляющего большинства современных живых организмов, в том числе всех высших животных и растений. Жизнедеятельность животных неразрывно связана с окислением органических соединений до воды и СО2 атмосферным кислородом. Основой жизнедеятельности растений является фотосинтез, в ходе которого из воды извлекаются атома Н для восстановления СО2 до сложных органических молекул.
Четвертый важнейший биогенный элемент — азот — в этом отношении кардинально отличается от трех предыдущих. Практически весь азот в составе живых организмов находится в степени окисления —3, соответствующей аммиаку или иону аммония, и подавляющее большинство жизненно важных биохимических процессов, в которых участвуют азотсодержащие соединения, происходит без изменения степени окисления азота. Исключение составляют лишь некоторые почвенные бактерии, способные превращать ионы аммония в нитраты и нитриты, которые составляют существенную часть запасов азота в почве. В таком виде азот может усваиваться почвенными бактериями и растениями, которые обладают ферментными системами, катализирующими восстановление нитритов и нитратов до аммонийной формы и обеспечивающими тем самым возможность поступления азота в состав аминокислот, нуклеотидов и других классов азотсодержащих веществ, функционирующих в живых организмах.
Однако часть азота все же ускользает из биосферы, в первую очередь в результате деятельности специальных бактерии, восстанавливающих нитриты до молекулярного азота N2. Поэтому существует необходимость пополнения запасов азота в биосфере. Источником его является фиксация азота некоторыми специальными видами бактерий, которые известны как азотфиксирующие бактерии. Масштаб фиксации атмосферного азота этими бактериями оценивается величиной порядка 107–108 т в год, что на несколько порядков ниже масштаба фиксации СО2, но все же составляет достаточно внушительную величину.
Ввиду огромного практического значения проблемы азотного питания сельскохозяйственных растений ферментная система, обеспечивающая фиксацию N2, является предметом интенсивного исследования. Эта система, известная как нитрогеназа, катализирует шестиэлектронное восстановление N2 до ионов аммония по общему уравнению
![]()
Изученные образцы нитрогеназы состоят из двух основных компонентов — редуктазы и собственно нитрогеназы. Оба компонента имеют в своей основе ферредоксины, содержащие железосерные кластеры, а нитрогеназа, кроме того, содержит молибден. Редуктаза, обеспечивающая подачу на нитрогеназу электронов с высокой восстанавливающей способностью, при своем функционировании расходует АТР. Для бактерий Clostridium pasteu-rianum, из которых она впервые была выделена, расход АТР оценивается в 12 молекул на каждую восстановленную молекулу N2.
Ионы аммония могут вводиться в состав органических молекул непосредственно по реакциям, катализируемым соответствующими ферментами, принадлежащими классу синтетаз. Например, глутамин образуется из глутаминовой кислоты и иона аммония по реакции
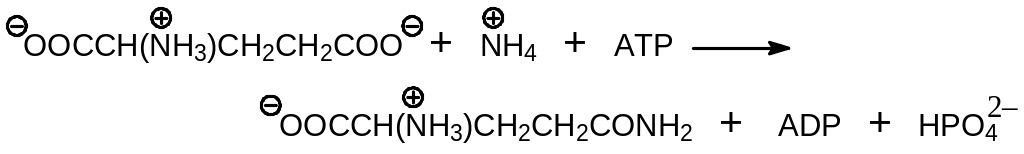
при участии глутамин синтетазы. Однако в большинстве случаев азотсодержащие группы поступают в биологические молекулы с помощью промежуточных переносчиков. К их числу прежде всего относится глутамат, который образуется по реакции
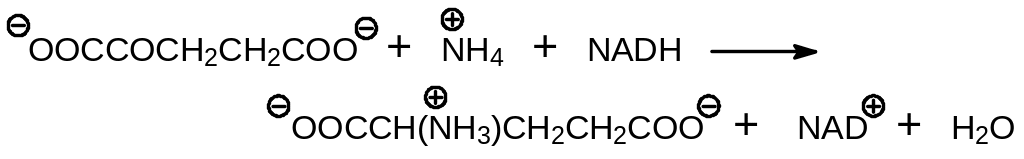
катализируемой глутамат дегидрогеназами, работающими с участием либо NADH, либо NADPH. Глутамат далее участвует в многочисленных реакциях переаминирования с различными кетокислотами.
Вторым важным переносчиком азота является аспартат, который образуется из ионов аммония и фумарата в реакции
![]()
катализируемой аспартат аммиак-лиазой. Кроме того, донором азота в ряде процессов является -NH2-группа глутамина.
Обе приведенные выше реакции реакции являются обратимыми и играют роль не только в образовании азотсодержащих соединений, но и в выводе азота из органических молекул, если они подлежат дальнейшей деструкции в биоэнергетических целях или должны использоваться как сырье для синтеза других, не содержащих атомов N, классов органических молекул. Так, уже говорилось, что аминокислоты в определенных физиологических ситуациях могут использоваться для биосинеза сахаров путем глюконеогенеза. Для этого необходимо удаление аминогрупп, которое достигается путем реакции переаминирования с -кетоглутаратом. Удаление аминогруппы из образующегося глутата может происходить путем обращения глутаматдегидрогеназной реакции.
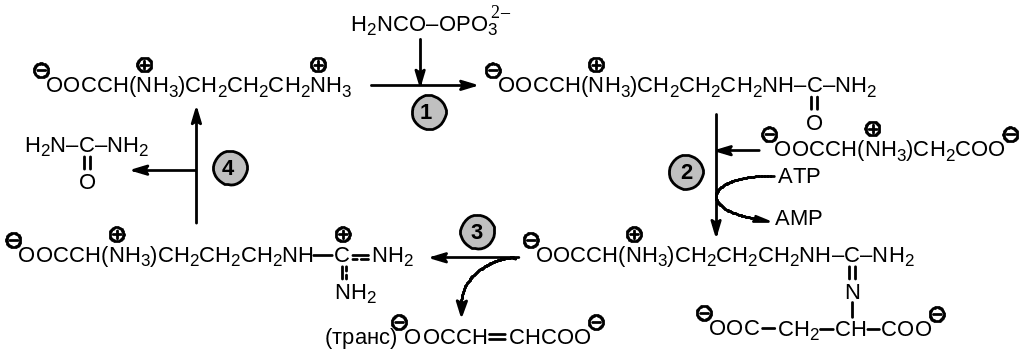
Рис. 9.4. Цикл мочевины (номера стадий соответствуют используемым в тексте)
Происходящее при этих процессах накопление аммиака не может продолжаться неограниченно вследствие токсичности повышенных концентраций ионов аммония. Поэтому в условиях избытка ионов аммония должен существовать путь вывода избыточных солей аммония из организма. У млекопитающих это осуществляется путем превращения их в мочевину в специальном цикле мочевины, схема которого приведена на Рис. 9 .4.
Аммиак в цикл мочевины поступает в виде аминогруппы аспартата и в виде карбамоилфосфата, образующегося по реакции:
![]()
катализируемой карбамоилфосфат синтетазой. В цикле в качестве регенерируемого компонента принимает участие аминокислота орнитин, которая не относится к числу аминокислот, формирующих белки, но является важным компонентом азотного обмена. Цикл состоит из следующих четырех реакций:
1) перенос карбамоильного остатка от карбамоилфосфата на -аминогруппу орнитина с образованием аминокислоты цитруллина, который катализируется ферментом орнитин карбамоилтрансферазой;
2) взаимодействие цитруллина с аспартатом с образованием аргининосукцината, сопряженным с гидролизом АТР до АDP и пирофосфат, которое проходит с участием фермента аргининосукцинат синтетазы;
3) отщепление фумарата от аргининосукцината, катализируемое аргининосукцинат лиазой и приводящее к образованию аргинина:
4) гидролиз аргинина с помощью фермента аргиназы, приводящий к отщеплению мочевины и регенерации орнитина:
Как и в случае цикла трикарбоновых кислот, некоторые из компонентов, функционирующих в цикле мочевины, могут расходоваться в других биохимических превращениях. Очевидно, например, что часть аргинина может использоваться в биосинтезе белков. Поэтому необходимо пополнение запасов компонентов цикла. Основным путем является биосинтез орнитина из глутамата, который проходит в результате трехстадийного превращения:'
1) фосфорилирование -карбоксильной группы глутамата с образованием -глутамил фосфата при участии фермента глутаматкиназы:
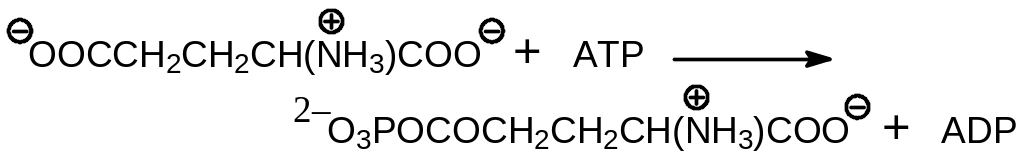
2) восстановление -глутамилфосфата с помощью NADPH при действии фермента глутаматсемиальдегид дегидрогеназы:

3) переаминирование семиальдегида с глутаматом с образованием орнитина, катализируемое орнитин аминотрансферазой:
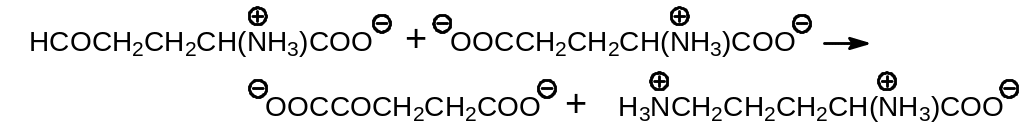
Помимо расходования аргинина из числа процессов, уводящих циклически работающие компоненты, следует упомянуть расходование орнитина на образование группы аминов, принимающих участие в нейтрализации отрицательных зарядов нуклеиновых кислот. Простейший из них — путресцин — образуется путем декарбоксилирования орнитина при действии фермента орнитин декарбоксилазы:
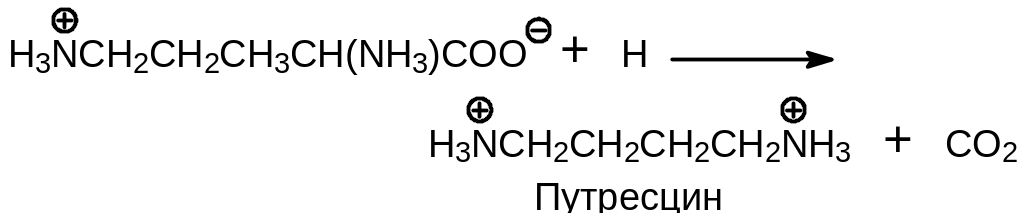
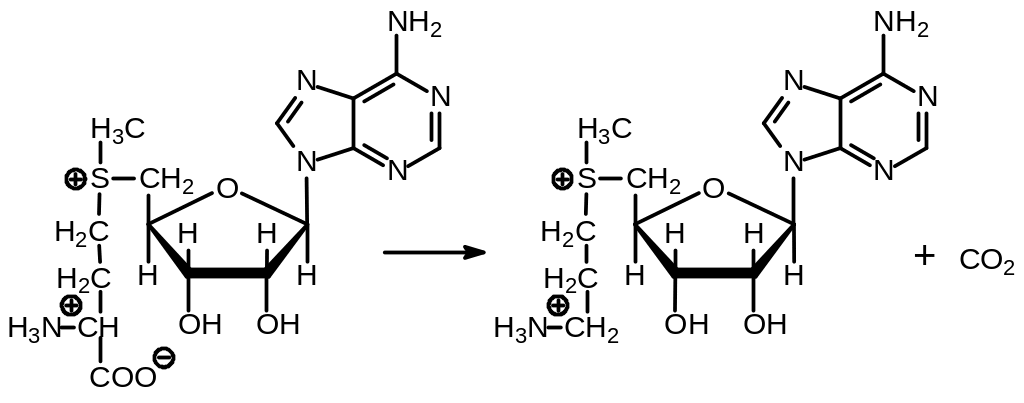
Путресцин может подвергаться алкилированию 3-аминопропильным остатком, донором которого служит 5'-дезокси-5'-аденозил (3-аминопропил)-метилсульфоний, образующийся при действии фермента аденозил-метионин декарбоксилазы на S-аденозилметионин:
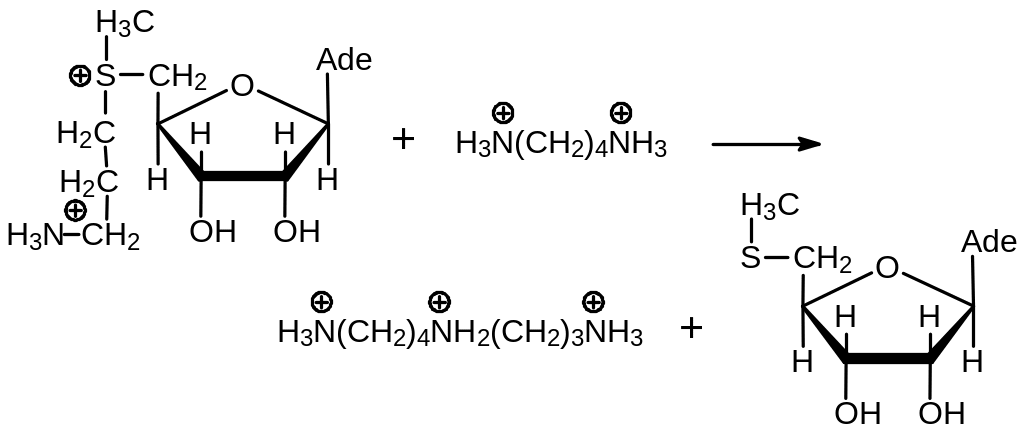
При взаимодействии этого алкилирующего реагента с путресцином, катализируемым спермидин синтазой, образуется спермидин:
а при повторном действии того же агента на спермидин образуется спермин:
![]()
