
- •Глава 1.Биологический катализ. Ферменты
- •1.1.Чем же ферменты отличаются от небиологических катализаторов?
- •1.2.Коферменты и витамины
- •1.2.1.Водорастворимые витамины и соответствующие им коферменты
- •1.2.2.Жирорастворимые витамины
- •1.2.2.1.Витамин е
- •1.2.2.2.Витамин к
- •1.3.Классификация ферментов
- •1.3.1.Оксиредуктазы
- •1.3.2.Трансферазы
- •1.4.1.Модель Михаэлиса-Ментон
- •1.4.2.Зависимость скорости ферментативных реакций от рН
- •1.4.3.Ингибирование ферментов
- •1.5.Пространственное строение активного центра ферментов
- •1.6. Факторы, определяющие каталитическую эффективность ферментов.
- •1.7.Ферменты небелковой природы
1.5.Пространственное строение активного центра ферментов
В настоящее время накоплен достаточно большой экспериментальный материал (в основном данные рентгено-структурного анализа), позволяющий сделать ряд важных выводов об общих закономерностях пространственного строения активного центра ферментов. Но прежде рассмотрим механизм действия и конформацию активного центра двух конкретных ферментов — пищеварительного фермента эластазы (сериновой протеазы), осуществляющего гидролиз полипептидов, и рибонуклеазы А (эндонуклеазы), гидролизующей рибонуклеиновые кислоты. Оба фермента состоят из оной полипептидной цепи и не содержат кофермента.
Эластаза (240 аминокислотных остатков) катализирует реакцию:

В растворе гидролиз амидов проходит как одноступенчатая реакция с прямой атакой воды на карбонильную группу (нуклеофильное присоединение к карбонильной группе, AdN). Для эффективного протекания реакции необходим либо кислый, либо основный катализ. При катализе сериновыми протеазами реакция разбивается на две последовательных стадии (Рис. 5 .35). На первой стадии (Рис. 5 .35) карбонильная группа расщепляемого пептида атакуется кислородом гидроксигруппы серина. Соседство с протонированным имидазольным кольцом гистидина, протонирование которого обеспечивается близким расположением карбоксильной группы остатка аспарагиновой кислоты, существенно повышает стабильность ионизованной формы гидроксила остатка серина (за счет электростатической энергии притяжения зарядов). В значительной части молекул фермента этот гидроксил находится в виде аниона, что резко повышает его нуклеофильную активность. В результате атаки аниона пептидная связь разрывается и одна часть пептида покидает активный центр фермента серинового, а другая переносится на остаток серина с образованием ацилфермента. На второй стадии катализа (Рис. 5 .35) промежуточно образовавшийся сложный эфир гидролизуется при действии воды и активный центр освобождается для проведения следующего акта катализа (Рис. 5 .35).

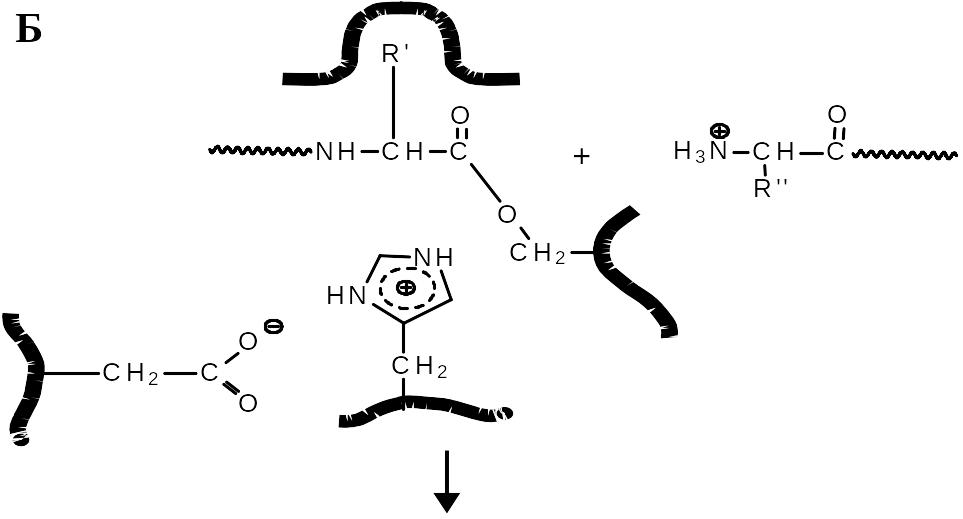

Рис. 5.35. Механизм гидролиза пептидной связи сериновыми протеазами.
Такой тип катализа принято называть нуклеофильным.
Кроме каталитических групп в активеном центре существует “карман” для связывания бокового радикала аминокислотного остатка. Пространственное строение этого кармана определяет специфичность сериновых протеаз к аминокислотной последовательности гидролизуемого полипептида и удерживает этот полипептид в нужной ориентации относительно каталитических групп. Эластаза расщепляет преимущественно пептидную связь между остатком, содержащим в боковом радикале удаленный от ативного центра положительный заряд (этому условию удов-летворяют остатки лизина и аргинина) и следующим аминокислотным остатком (напомню, что выбранным направлением полипептидной цепи является направление от N- к С-концу).
Важно отметить, что активный центр формируется не одним участком полипептидной цепи фермента, а пептидными петлями, принадлежащими совершенно разным участкам белковой молекулы.
В случае эластазы эти участки расположены недалеко от начала (His 57), середины (Asp 102) и конца (Ser 195) полипептидной цепи фермента. Это явление, поначалу кажущееся удивительным, достаточно очевидно из общих соображений. Поскольку конформационные возможности полипептидной цепи весьма ограничены, организация активных центров, пространственно комлементарных тысячам субстратов с совершенно разным очертанием внешней поверхности, практически невозможно. Эту задачу можно решить лишь «блочным» методом, где каждый строительный блок принадлежит разным участкам полипептидной цепи.
Полная третичная структура эластазы приведена на Рис. 5 .36.
Рис.
5.36. Третичная
структура эластазы и «укладка» в ней
модели субстрата — N–глицил-лизил-аланил-глицина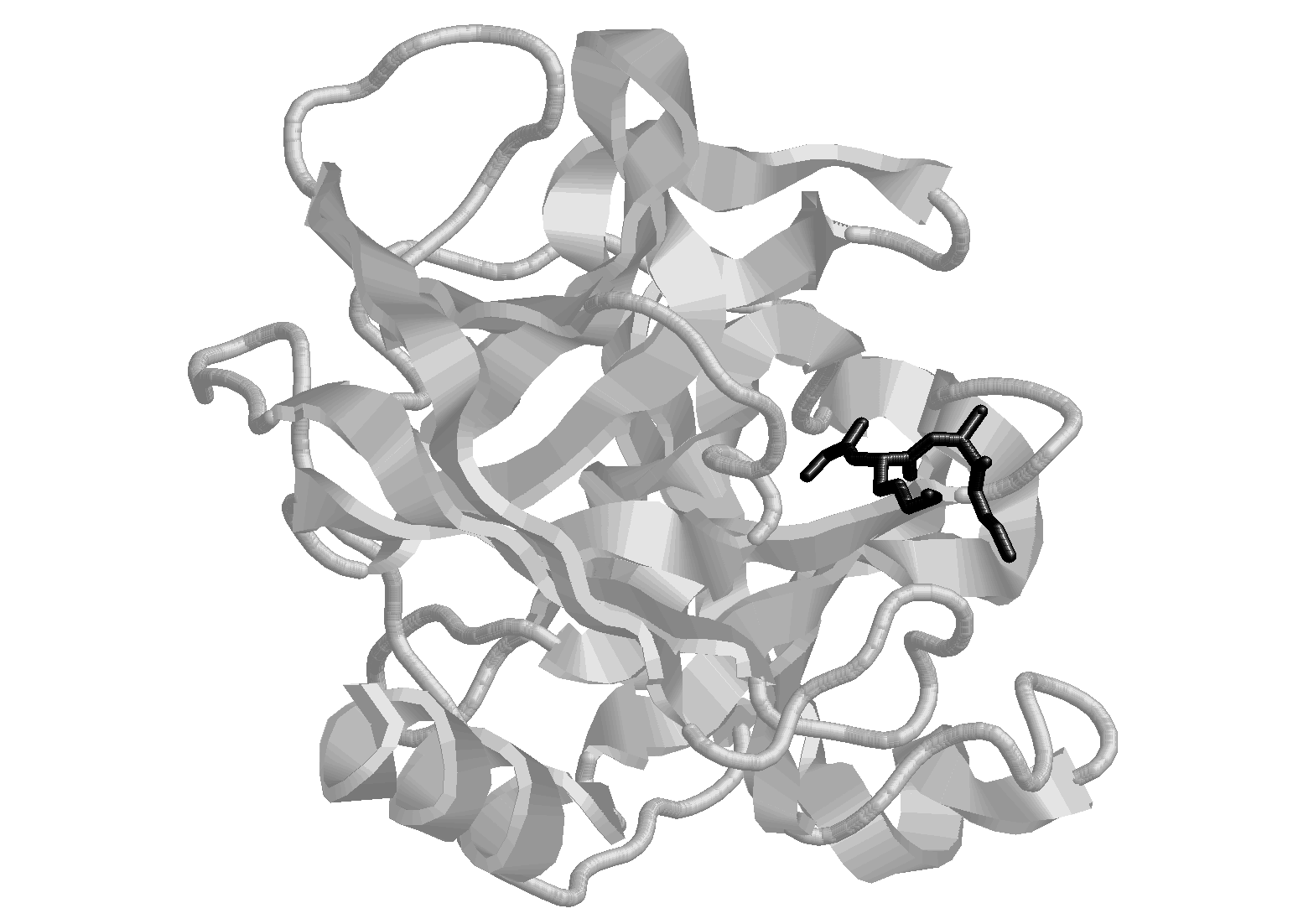
На втором этапе (Рис. 5 .37, внизу) протекает гидролиз промежуточно образующегося циклофосфата. В этом случае нуклеофильным агентом является молекула воды.
Основной катализ осуществляет His 119, а кислый — His 12. По окончании реакции активный центр возвращается к исходному состоянию и после ухода расщепленного субстрата фермент готов к новому каталитическому акту.


Рис. 5.37. Механизм гидролиза межнуклеотидной фосфатной связи рабонуклеазой А
Как плоская схема активного центра выглядит в трехмерном пространстве (по данным рентгено-структурного анализа) показано на Рис. 5 .38.Рис. 5 .38. Трехмерная структура активного центра рибонуклеазы А по данным рентгено-структурного анализа. Для удобства показаны лишь участки полипептидной цепи несущие связывающие и каталитические группы. Полипептидые цепи представлены ходом пептидного остов (темно-серые), связывающие и каталитические группы — палочковыми моделями (светло-серые), модель субстрата [уридилил(35)аденозин] — черной палочковой моделью. Водородные связи обозначены пунктиром. Для удобства приведены лишь участки полипептидной цепи, непосредственно участвующие в построении активного центра. На Рис. 5 .39 видно, как уложена молекула субстрата в третичной структуре белка. Отметим две важные особенности активного центра.
Во-первых, как и в случае эластазы «блочная» топология активного центра. В организации активного центра участвует начало (Gln 11, His 12), середина (Thr 45) и конец (His 119, Phe 120 и Ser 123) полипептидной цепи фермента.
Во-вторых, многоточечное связывание субстрата (в случае рибонуклеазы А — семь точек связывания: шесть водородных связей и гидрофобный контакт урацила с бензольным кольцом фенилаланина).
Рис.
5.38. Трехмерная
структура активного центра рибонуклеазы
А по данным рентгено-структурного
анализа. Для удобства показаны лишь
участки полипептидной цепи несущие
связывающие и каталитические группы.
Полипептидые цепи представлены ходом
пептидного остов (темно-серые), связывающие
и каталитические группы — палочковыми
моделями (светло-серые), модель субстрата
[уридилил(35)аденозин]
— черной палочковой моделью. Водородные
связи обозначены пунктиром.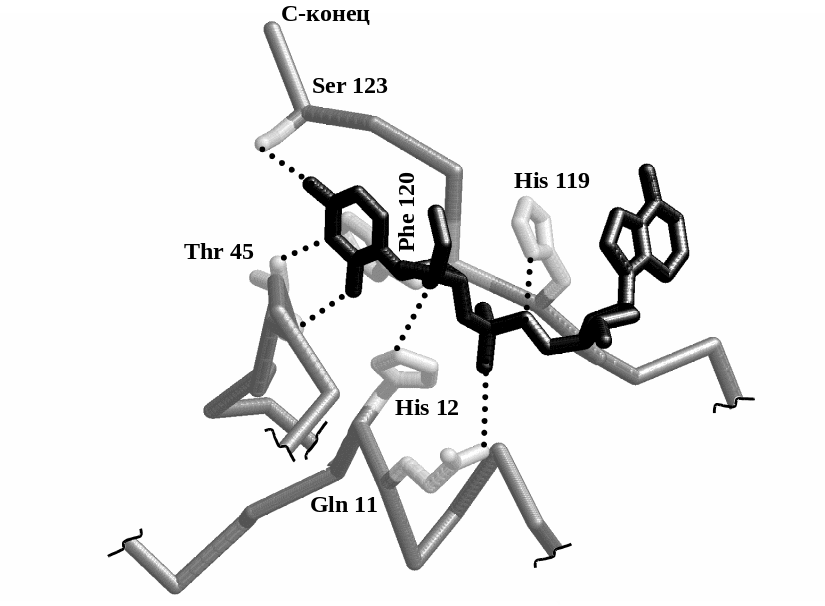
Рис.
5.39. Укладка
субстрата
[аденилил(35)уридилил(35)аденилил(35)
аденозина] в третичной структуре
фермента.
Из общих соображений очевидно, что для проявления стереоселективности необходимо как минимум три точки связывания (закрепление в пространстве трехмерного объекта).
