
- •Глава 1.Биологический катализ. Ферменты
- •1.1.Чем же ферменты отличаются от небиологических катализаторов?
- •1.2.Коферменты и витамины
- •1.2.1.Водорастворимые витамины и соответствующие им коферменты
- •1.2.2.Жирорастворимые витамины
- •1.2.2.1.Витамин е
- •1.2.2.2.Витамин к
- •1.3.Классификация ферментов
- •1.3.1.Оксиредуктазы
- •1.3.2.Трансферазы
- •1.4.1.Модель Михаэлиса-Ментон
- •1.4.2.Зависимость скорости ферментативных реакций от рН
- •1.4.3.Ингибирование ферментов
- •1.5.Пространственное строение активного центра ферментов
- •1.6. Факторы, определяющие каталитическую эффективность ферментов.
- •1.7.Ферменты небелковой природы
1.4.2.Зависимость скорости ферментативных реакций от рН
Рис.
5.29. Зависимость
активности ферментов (для удобства
сравнения приведены активности,
нормированные к единице) от рН. 1
— Пепсин, 2
— рибонуклеаза и 3 —
аргиназа.
1.4.3.Ингибирование ферментов
Кроме обычных факторов (растворитель, температура, рН), на скорость ферментативных процессов влияет присутствие некоторых специфических для данного фермента соединений, которые принято называть либо ингибиторами (если они замедляют течение реакции), либо активаторами (если они ускоряют процесс). Эффекторы ферментативных реакций подразделяют на «обратимые» (связываются с ферментом нековалентно) и «необратимые» (образуют с ферментом ковалентные связи). В свою очередь обратимые эффекторы делят на конкурентные и неконкурентные.
Обратимые эффекторы ферментативных реакций
Конкурентное ингибирование
Основной особенностью конкурентного ингибирования является то, что ингибитор, как и субстрат, связывается в активном центре фермента. Как правило конкурентные ингибиторы представляют собой аналоги субстрата, сохраняющие все (или большинство) функциональных групп, необходимых для связывания с ферментом, но не способные претерпевать ферментативное превращение (отсутствие или модификация реагирующей группы). Таким образом, фермент может образовывать либо фермент-субстратный комплекс, который затем превращается в продукт, либо фермент-ингибиторный комплекс. Связывание с ферментом и субстрата, и ингибитора одновременно невозможно.
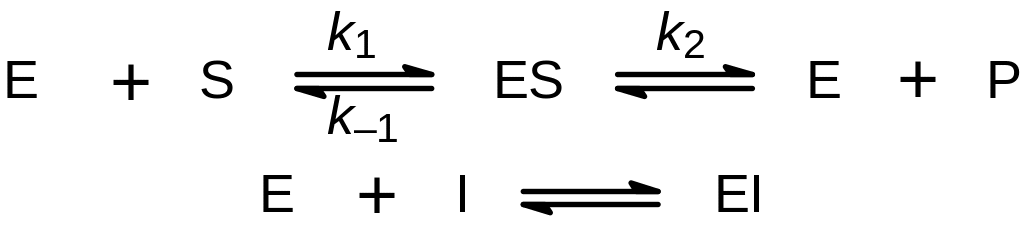
Здесь I — ингибитор, EI — фермент-игибиторный комплекс.
Сродство фермента к ингибитору описывают константой диссоциации фермент-ингибиторного комплекса (чем меньше величина константы, тем стабильнее комплекс):
![]()
( 5.0)
Рис.
5.30. Влияние
увеличения концентрации субстрата на
активность фермента в отсутствие
ингибитора (сплошная линия) и в присутствии
фермента в трех концентрациях ингибитора
(пунктирные линии). Концентрация
ингибитора увеличивается сверху вниз.

( 5.0)
Рис.
5.31. Ферментативная
реакция в отсутствие ингибитора
(сплошная прямая) и в присутствии двух
увеличивающихся (снизу вверх) концентраций
конкурентного ингибитора.
![]()
( 5.0)
В двойных обратных координатах влияние ингибитора на ферментативную активность описывается Уравнением ( 5 .0).
Как видно из Рис. 5 .31 все прямые Лайнуивера-Бэрка пересекаются в одной точке на оси ординат, т.е. конкурентный ингибитор не влияет на максимальную скорость реакции, но увеличивает константу Михаэлиса (понижают сродство фермента к субстрату).
Такой вид графиков в двойных обратных координатах характерен именно для конкурентного ингибирования.
Неконкурентное ингибирование
При неконкурентном ингибировании ингибитор связывается не в активном центре фермента, а в некоем другом центре, расположенном на той же или даже на другой субъединице фермента. Таким образом, кроме комплекса фермент-субстрат и фермент-ингибитор может образовываться тройной комплекс фермент-субстрат-ингибитор.

Если связывание ингибитора с ферментом
не влияет на сродство субстрата к
ферменту, но полностью лишает фермент
активности (за счет вызываемых им
конформационных изменений фермента),
то зависимость активности фермента от
концентрации субстрата будет описываться
следующим выражением:

Рис.
5.32. Ферментативная
реакция в отсутствие ингибитора
(сплошная линия) и в присутствии двух
увеличивающихся концентраций
неконкурентного ингибитора (пунктир).
Как видно из Рис. 5 .33, в случае неконкурентного ингибирования увеличение концентрации субстрата не восстанавливает активность фермента (в области насыщения фермента субстратом кривые идут параллельно).
В двойных обратных координатах выражение для неконкурентного ингибирования приведено ниже:
![]()
Рис.
5.33. Зависимость
активности фермента от концентрации
субстрата в отсутствие ингибитора
(сплошная кривая) и в присутствии трех
концентраций неконкурентного ингибитора
(пунктирные кривые).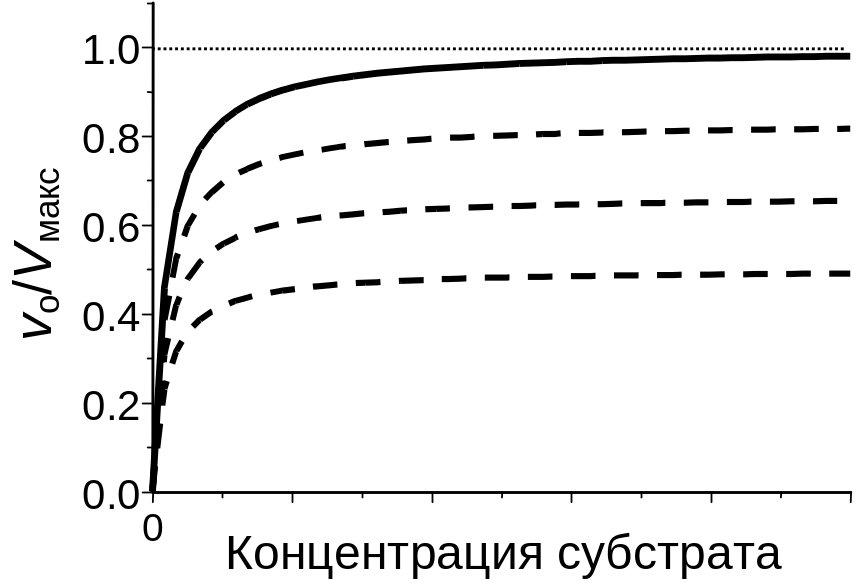
В противоположность конкурентному нгибированию, неконкурентные ингибиторы не влияют на константу Михаэлиса, но уменьшают максимальную скорость ферментативного процесса (Рис. 5 .32).
Аллостерические эффекторы ферментативной активности
Аллостерические эффекторы играют роль регуляторов ферментативной активности. Также как неконкурентный ингибитор аллостерический эффектор связывается в специальном месте связывания, расположенном, как правило, достаточно далеко от активного центра (часто на другой субъединице фермента). Его влияние на активный центр передается за счет конформационных изменений белковой молекулы, вызываемых связыванием эффектора.
Рис.
5.34. Зависимость
скорости ферментативной реакции в
области насыщения фермента субстратом
от концентрации эффектора при
=2 (верхняя кривая) и 0.1 (нижняя кривая).

![]()
( 5.0)
Коэффициентa определяет характер действия эффектора. Если < 1, то эффектор снижает активность фермента (ингибирует фермент), если > 1, то активирует фермент (Рис. 5 .34).
